可降解亚硝酸盐植物乳杆菌在广式腊肠发酵中的应用
陈桂柳,卢超锐,刘雪萍,吴长力,林梦哲,陈颖琪,张宏梅
(广东工业大学 生物工程系,广州 510006)
广式腊肠具有非常悠久的历史,深受广大消费者的喜爱。但传统腊肠的制作以作坊形式为主,具有规模小、产品性质不稳定的特征,同时也存在产品的安全性问题。发酵肉制品中的亚硝酸盐残留问题是食品安全领域中非常重要的内容[1,2]。因为亚硝酸盐具有优异的发色和抑菌能力,所以它是一种在食品生产中特别是在肉制品制造业中常用的食品添加剂,但它却有致畸、致癌、致甲状腺肿大等危害[3,4]。因此,急需找到一种能够降解发酵肉制品中亚硝酸盐的办法。
目前亚硝酸盐的降解办法主要有物理法、化学法和微生物法3种,微生物法基于其经济、高效等特点得到广泛的重视,其主要是通过菌株如硝化细菌中的假单胞菌(Pseudomonassp.)、芽孢杆菌(Bacillussp.)或发酵中用到的乳酸菌(Lactobacillussp.)等对亚硝酸盐进行降解。解决发酵食品中亚硝酸盐安全问题的最为理想的途径之一,就是从具有代表性的发酵食品中筛选出高效降解亚硝酸盐的乳酸菌菌株作为发酵剂,添加到发酵肉制品中,在改善产品性能的同时提高产品的安全性[5-9]。
本研究以前期在泡菜中分离的两株植物乳杆菌为研究对象,分析其耐氯化钠和耐亚硝酸钠的特征以及降解亚硝酸盐的能力,并将其中一株植物乳杆菌应用到广式腊肠发酵中,通过检测其理化性质和微生物学特征,以探讨其作为广式腊肠发酵剂的可行性。
1 材料与方法
1.1 菌株与培养基
实验菌株:实验所用的菌株分别是LactobacillusplantarumH1和LactobacillusplantarumL1。由本实验室前期从潮汕泡菜中分离得到,并经过革兰氏染色、产乳酸分析、过氧化氢酶分析等生化实验和16S rDNA序列分析鉴定为植物乳杆菌,并于-20 ℃添加20%甘油保护剂低温保存。
培养基:MRS肉汤、PALCAM琼脂、木糖赖氨酸脱氧胆盐(XLD)琼脂、GYP培养基、孟加拉红培养基等,均购自青岛海博生物技术有限公司。
1.2 植物乳杆菌对氯化钠和亚硝酸钠耐受性的研究
配制50 mL的MRS培养基,经118 ℃高压灭菌15 min,备用。从-20 ℃冰箱中取出菌株,待培养基冷却至室温时,分别吸取50 μL菌液于培养基中,并将培养基移至恒温摇床中,30 ℃培养48 h。
在GYP培养基中,加入2.0%的氯化钠或 300 mg/kg的亚硝酸钠,以不加任何其他物质作为空白对照,平行3个样本。移取乳酸菌液于离心管中,5000 r/min ,4 ℃下离心5 min后舍弃上清液,用10 mL的无菌PBS缓冲液清洗乳酸菌,并用50 mL PBS缓冲液悬浮乳酸菌。以1%的接种量(大约为7.0 log CFU/mL)接种于GYP培养基中(含有氯化钠或亚硝酸钠)以及空白对照培养基中。置于恒温摇床30 ℃培养72 h后,使用分光光度计法,在波长660 nm处测量培养基的光密度值[10]。
乳酸菌存活率=(含氯化钠或亚硝酸钠GYP培养基的OD值)/(不含盐GYP培养基的OD值)×100%。
1.3 植物乳杆菌对亚硝酸盐降解能力的研究
亚硝酸盐的检测参照GB 5009.33-2016中的分光光度法进行。将待测液2 mL置于50 mL带塞比色管中,先加入2 mL对氨基苯磺酸溶液混匀,然后避光静置5 min,再加入1 mL盐酸萘乙二胺溶液,用去离子水定容至刻度,摇匀后避光静置15 min,于538 nm处测量其吸光度。
标准曲线的绘制:分别准确吸取0.00,0.20,0.40,0.60,0.80,1.00,1.50,2.00,2.50 mL的亚硝酸钠标准使用液(相当于 0.0,1.0,2.0,3.0,4.0,5.0,7.5,10.0,12.5 μg 亚硝酸钠)置于50 mL带塞比色管中,经紫外分光光度法测定后,绘制成标准曲线。
按1∶1000的接种量将浓度为108CFU/mL的乳酸菌分别接种到含适量NaNO2(160 μg/mL)的MRS培养基后,将pH值调为6.5,30 ℃培养,每隔12 h吸取菌液测量其亚硝酸盐含量。菌液均需经过前处理才可对其进行测量,前处理步骤如下:吸取菌液5 mL于250 mL的带塞锥形瓶中,加入12.5 mL硼砂溶液后沸水浴15 min后将提取液转移到200 mL容量瓶中,先后加入5 mL亚铁氰化钾溶液和5 mL乙酸锌溶液,摇匀,沉淀蛋白质,加入去离子水至刻度,摇匀后室温静置30 min以去除上层脂肪,用滤纸过滤上清液,弃去30 mL初滤液,吸取2 mL剩下的滤液采用分光光度法测定亚硝酸盐含量。
1.4 广式腊肠的制备
将接种了植物乳杆菌H1的100 mL MRS培养基过夜培养,离心分离获得菌体后,用无菌PBS洗涤并用10 mL PBS悬浮菌体,使菌体浓度达到105CFU/mL。
将新鲜猪肉中的肥瘦分开,搅碎后按比例混合,肥瘦比例为2∶8,按肉重加入300 mg/kg亚硝酸钠、2%氯化钠、0.1%抗坏血酸钠、1%葡萄糖、0.6%蔗糖和0.88%香料混合物,充分搅拌5 min混合均匀。腌制1 h,紫外灭菌20 min。将腌制好的猪肉分成每份100 g,共6份。其中3份以1%的接种量(约为8.0 log CFU/g)的发酵剂接种在肉料中,另外3份则加入等量的生理盐水。将接种后的肉料填充到猪肠衣中。制成的腊肠先存放在超净工作台中,以除去肠衣表面的水分。腊肠表面无明显润湿感时,将腊肠悬挂在室内阴凉通风处自然风干,室内温度保持在20 ℃。
1.5 发酵的腊肠在发酵和干燥过程中微生物的检测
将发酵的腊肠在不同时间(0,1,2,5,8,14,21 d)进行取样检测其乳酸菌、霉菌和大肠菌群的数量。其中,乳酸菌采用溴甲酚紫固体培养基,霉菌采用孟加拉红培养基,大肠菌群采用XLD琼脂。计数方法参照国家标准[11-13]。
1.6 腊肠在发酵和干燥过程中pH值与水活度的测定
将发酵的腊肠在不同时间(0,1,2,5,8,14,21 d)进行取样,分别采用pH计(上海精密科学仪器有限公司)和水活度测定仪(无锡市华科仪器仪表有限公司)测定其pH值和水活度的大小。
1.7 数据统计与分析
实验均重复3次,采用Origin 8.0进行数据的分析和统计。
2 结果与讨论
2.1 植物乳杆菌对氯化钠和亚硝酸钠耐受性的研究
由表1可知,H1和L1两株菌在2.0%氯化钠的培养基中生长不受抑制。300 mg/kg亚硝酸钠不能对L1菌的生长产生抑制,而对H1菌有较小的抑制。已有研究表明起始浓度为6.0 log CFU/mL的植物乳杆菌可在浓度为100 mg/L(100 mg/kg)Na2NO2的条件下生长,表明该乳酸菌对亚硝酸钠的耐受能力高[14]。因此,本研究结果表明H1菌和L1菌有更强的耐亚硝酸盐能力。

表1 乳酸菌在含氯化钠或亚硝酸钠培养基中的活性Table 1 Activity of Lactobacillus in culture medium containing sodium chloride or sodium nitrite
注:数据中的“±”表示标准差。当菌的活性在100%以下时,可视为该菌在对应培养基中的生长受到抑制;当菌的活性约为100%时,可视为该菌在对应培养基中的生长不受影响;当菌的活性在100%以上时,可视为该菌对应的培养基中存在能促进该菌生长的因素。
2.2 植物乳杆菌对亚硝酸盐降解能力的研究
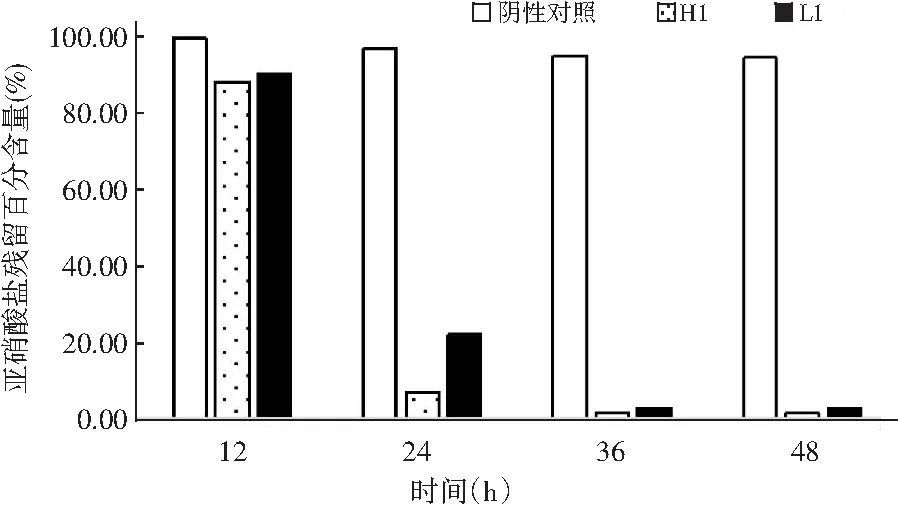
图1 两株植物乳杆菌对亚硝酸盐的降解能力Fig.1 Degradation capability of nitrite by twoLactobacillus plantarum strains
由图1可知,两株植物乳杆菌在MRS培养基中对亚硝酸盐均具有较好的降解能力,在第12~24 h期间,降解速度最快,H1菌对亚硝酸盐的降解率从11.8%增加到92.9%,L1菌对亚硝酸盐的降解率从9.6%增加到77.0%,在第36 h时,两株植物乳杆菌几乎将亚硝酸盐全部降解。有文献表明,来自泡菜的植物乳杆菌5-7-3对亚硝酸盐的降解率为89.94%[15]。因此,在本实验中同样来自泡菜的植物乳杆菌L1和H1也表现出了较好的亚硝酸盐降解能力。
2.3 腊肠在发酵过程中乳酸菌活菌数、pH值和水活度的变化
在传统的广式腊肠中添加H1菌作为发酵剂,通过在不同时间下测定其乳酸菌活菌数、pH值以及水活度来探讨该菌株作为发酵剂的可行性,结果见图2。

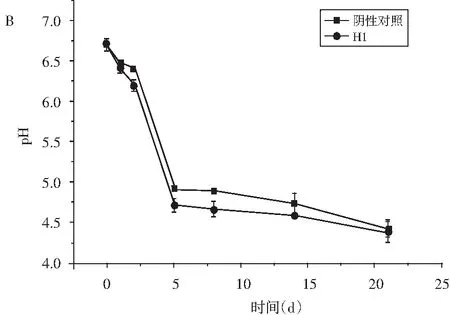

图2 发酵腊肠中乳酸菌活菌数、pH和水活度的变化Fig.2 Changes in the number of live bacteria, pH and wateractivity of Lactobacillus in fermented sausage
注:A表示腊肠在发酵过程中乳酸菌活菌数与发酵天数的关系;B表示腊肠在发酵过程中pH值与发酵天数的关系;C表示腊肠在发酵过程中水活度与发酵天数的关系。
由图2中A可知,添加了H1菌的发酵腊肠的乳酸菌活菌数多于不添加H1菌的发酵腊肠的乳酸菌活菌数。在发酵的前2 d内,两种发酵腊肠中的乳酸菌都快速生长,乳酸菌处在对数生长期。在发酵的第2~8 d之间,添加了H1菌的发酵腊肠的乳酸菌活菌数生长速率减小,但总活菌数还是有增长的趋势,乳酸菌处于生长平稳期。而没有添加H1菌的发酵腊肠的乳酸菌活菌数先增长后减少。到第8天后,两种发酵腊肠的乳酸菌总数都呈现持续减少的趋势,且随着发酵天数的增加,减少的速率越快。
由图2中B可知,在发酵的第0~5 d,两种发酵腊肠的pH值持续快速降低,添加了H1菌的发酵腊肠的pH值比未添加H1菌的发酵腊肠的pH值低。在发酵的第5天后,两者的pH值都持续缓慢下降,但添加H1菌的pH值始终比不添加H1菌的低,说明添加H1菌会降低腊肠的pH值。
由图2中C可知,添加了植物乳杆菌H1的发酵腊肠的水活度与传统发酵腊肠相比,在发酵的第0~5 d水分活度变化不大,但第5天后,添加植物乳杆菌H1会影响腊肠的水活度,相对传统发酵,能使其水活度降低。
2.4 腊肠在发酵过程中有害菌的测定

表2 发酵腊肠中霉菌生长情况Table 2 Growth of mold in fermented sausage
注:涂布平板使用的样液均稀释至104倍;“+”表示培养基上霉菌菌落的数量为0~50个,“++”表示培养基上霉菌菌落的数量为50~100个,“+++”表示培养基上霉菌菌落的数量在100个以上,“-”表示培养基上无霉菌菌落。
由表2可知,两种腊肠在发酵的第0天时,已经存在霉菌。不添加H1菌的发酵腊肠中的霉菌菌落数量随着发酵天数的增加而增多,到发酵第14天才开始减少。添加了H1菌的腊肠中霉菌在发酵第0~5 d之间呈增长趋势,而第5天时,霉菌的数量开始减少,到第14 天时,已经检测不到霉菌。说明添加H1菌可以减少有害菌的数量。
2.5 发酵腊肠中大肠杆菌的测定

表3 发酵腊肠中大肠杆菌数量Table 3 Quantity of Escherichia coli in fermented sausage
注:国家卫生标准规定大肠杆菌在食品中含量不得超过30 CFU/100 g,如超过则判定为样品不合格。
由表3可知,两种腊肠在发酵第0天时,都未检测到大肠杆菌。在发酵的第1~3 d,在不添加H1菌的发酵腊肠中检测到大肠杆菌,而在同时期添加H1菌的发酵腊肠中未检测到大肠杆菌,说明H1菌对大肠杆菌的生长繁殖有抑制效果。
3 结论
传统广式腊肠制作的过程中,参与发酵的微生物种类很多,乳酸菌是非常重要的一类。文中的两株植物乳杆菌均具有良好的耐盐和耐亚硝酸钠能力,同时表现出对亚硝酸钠有良好的降解能力。选择H1菌作为腊肠进行发酵剂进行实验,检测了发酵腊肠的乳酸菌活菌数、霉菌数、大肠杆菌含量、pH值和水活度,对比空白对照的发酵腊肠,探讨H1菌应用到发酵腊肠后对这些数值造成的影响。从实验结果来看,H1菌对发酵腊肠的pH值影响较大,可以降低产品的水活度,同时有可能会对大肠杆菌和霉菌造成抑制效果。说明所选乳酸菌菌株具有较好的环境适应性,并显示出很大的酸化潜力,可以通过抑制致病菌的生长来提高生物安全性。因此,H1菌有望成为一种具有生物安全性的本土发酵剂。另外,腊肠发酵中,菌株的种类多样,植物乳杆菌与其他菌可能存在着营养的竞争关系,也可能是胁迫条件的协同生存。我们将深入研究腊肠中的菌群结构,以及发酵剂菌株与其他菌株之间的相互作用,使产品优良的性状具有稳定性。为实现广式腊肠生产的规模化、规范化以及保证产品的安全性研究奠定了科学基础。

