野生和种植藜蒿不同部位提取物的抗氧化活性和酶抑制活性
谢 星 涂宗财,* 王 辉 张 露 王淑好 王振兴
(1 南昌大学 食品科学与技术国家重点实验室 南昌330047 2 江西师范大学生命科学学院 南昌330022)
藜蒿(Artemisia selengnesis Turcz)是菊科蒿属的多年生草本植物,又名水蒿、芦蒿等,在我国广泛生长在鄱阳湖地区,是一种深受人们喜爱的绿叶蔬菜。野生藜蒿具有很高的药用价值,如消炎、祛风湿、促消化和加强人体免疫力等[1-2]。每年我国藜蒿产量可达数百万吨以上,除了藜蒿嫩茎加工成美食外,藜蒿根和叶常被当作废弃物丢弃,造成潜在资源的浪费。Wang 等[3]研究表明,藜蒿叶多糖APS1 和APS2 具有很好的抗癌活性。A Ryun Kim 等[4]发现藜蒿提取物能抑制MG-63 细胞中IL-6 的增值,具有很好的抗炎活性。余宙等[5]通过动物和人体试食试验研究野生藜蒿提取物具有降血压的作用。涂宗财等[6]研究发现黎蒿50%乙醇提取物具有很好的抗氧化能力,多酚类化合物是其主要活性成分。Zhang 等[7]从藜蒿叶中初步鉴定出57 种化合物,其中的主要化合物是黄酮和酚酸。目前关于野生和种植藜蒿降血糖的研究文献较少,关于野生和种植藜蒿在抗痛风和抗老年痴呆病方面的研究未见报道。
本研究以野生藜蒿叶、茎和根以及种植藜蒿叶和茎为原料,比较藜蒿不同部位提取物的总酚和总黄酮含量,测定其DPPH·清除能力、ABTS+·清除能力以及α-葡萄糖苷酶、黄嘌呤氧化酶和乙酰胆碱酯酶的抑制能力,评价野生和种植藜蒿不同部位提取物在抗氧化、降血糖、抗痛风和预防老年痴呆病方面的应用潜力,为其高值化利用提供理论参考。
1 材料和方法
1.1 材料和试剂
野生和种植藜蒿于2016年4月分别采集于江西省鄱阳湖和江苏省南京市,原料用水漂洗去除泥垢,将其茎、叶和根分开,冻干机冻干后粉碎,干燥器中保存备用。
Folin-Ciocalteu 试剂、Na2CO3、AlCl3、没食子酸、槲皮素、甲醇等,索莱宝生物科技有限公司;2,2'-azino-bis (3-ethyl-benzthiazoline-6-sulphonic acid)(ABTS)、1,1-diphenyl-2-picrylhydrazyl(DPPH)、阿卡波糖、α-葡萄糖苷酶(来源于酿酒酵母)、黄嘌呤氧化酶(来源于牛奶)、黄嘌呤、别嘌呤醇和p-硝基苯基-α-D-吡喃葡萄糖苷(PNPG)、乙酰胆碱酯酶、加兰他敏、碘代硫化胆碱、5,5'-二硫代双(2-硝基苯甲酸),美国sigma 公司。
1.2 仪器与设备
Synergy H1 酶标分析仪,美国Bio Tek 公司;ML104 电子天平,梅特勒托利多仪器(上海)有限公司;TGL-10C 高速台式离心机,上海安亭科学仪器厂;RE-52A 旋转蒸发仪,上海亚荣生化仪器厂。
1.3 试验方法
1.3.1 样品制备 分别称取10 g 野生藜蒿叶、根和茎以及种植藜蒿的叶和茎的粉末,按1∶30 的料液比加入90%甲醇,超声波160 W、50 ℃提取80 min,4 000 r/min 离心5 min,收集上清液,所有样品重复提取3 次,最后合并上清液,50 ℃真空浓缩,最后分别用甲醇定容至50 mL。样品-4 ℃冰箱保存备用。
1.3.2 总酚含量测定 采用Folin-Ciocalteu 法[7]测定样品的总酚含量。以没食子酸(10~60 μg/mL)为标品绘制标准曲线 (Y=0.0046X+0.0665,R2=0.9993)。藜蒿样品中的总酚含量表示为毫克没食子酸当量每克干原料(mg GAE/g DM)。
1.3.3 总黄酮含量测定 采用氯化铝比色法[7]测定藜蒿样品的总黄酮含量。以槲皮素为标品(2~12 μg/mL)绘制标准曲线(Y=0.0209X-0.0197,R2=0.9976)。藜蒿样品中的总黄酮含量表示为毫克槲皮素当量每克干原料(mg QE/g DM)。
1.3.4 DPPH·清除能力测定 参照Wang 等[8]的方法测定藜蒿样品的DPPH·清除能力。以BHT 为阳性对照,试验结果用IC50值表示。IC50值为50%自由基被清除时所需要的样品浓度。
1.3.5 ABTS+·清除能力测定 参照Lu Zhang 等[7]的方法测定藜蒿样品的ABTS+·清除能力。以槲皮素为阳性对照,试验结果用IC50值表示。
1.3.6 α-葡萄糖苷酶抑制活性的测定 参照Sengul Uysal 等[9]的方法测定藜蒿样品的α-葡萄糖苷酶活性抑制能力。取50 μL 适宜浓度的样品溶液与100 μL 0.1 U/mL 的α-葡萄糖苷酶于96孔酶标板上混匀,室温反应6 min 后加入50 μL 5.0 mmol/L 对硝基苯基-D-吡喃葡萄糖苷(0.1 mol/L pH=6.8 PB 配制),再于37 ℃反应10 min,加入100 μL 0.2 mol/L Na2CO3终止反应,最后在405 nm 测吸光值(Ai)。以不加酶和样品的反应体系为空白,阿卡波糖为阳性对照。酶抑制作用计算公式为:
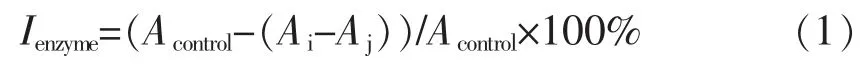
以不含酶的反应体系 (Aj)为样品空白,用90%甲醇代替样品作控制组(Acontrol)。50%的酶活性被抑制时所需要的样品浓度用IC50值表示(mg DM/mL)。
1.3.7 黄嘌呤氧化酶抑制活性的测定 参照Salma Kammoun El Euch 等[10]的方法测定藜蒿样品的黄嘌呤氧化酶抑制活性。50 μL 适宜浓度的样品溶液与60 μL 70 mmol/L pH=7.5 PB 和30 μL 0.1 U/mL 的黄嘌呤氧化酶于96 孔酶标板上混匀,室温反应15 min 后加入60 μL 150 mmol/L 的黄嘌呤,再于室温反应5 min 后测定反应体系在295 nm 处的吸光值(Ai)。以不加样品的反应体系为控制组,不加酶和样品的反应体系为空白,别嘌呤醇为阳性对照。酶抑制活性计算公式同(1),结果用IC50值表示。
1.3.8 乙酰胆碱酯酶抑制活性的测定 参照Salma Kammoun El Euch 等[10]的方法测定藜蒿提取物的乙酰胆碱酯酶抑制活性。取50 μL 适宜浓度的样品溶液与125 μL 3 mmol/L 5,5'-二硫代双(2-硝基苯甲酸)和25 μL 1 U/mL 的乙酰胆碱酯酶于96 孔酶标板上混匀,室温反应15 min 后加入25 μL BTCL (碘代硫化胆碱),室温下反应10 min 后于405 nm 下测吸光值(Ai)。以不加样品的反应体系为控制组,不加酶和样品的反应体系为空白,加兰他敏为阳性对照。酶抑制活性计算公式同(1),结果用IC50值表示。
1.3.9 数据分析 所有试验重复3 次,结果表示为平均值±标准偏差。采用SPSS 19.0 和Origin 8.0 软件对数据进行分析。采用皮尔森相关性分析总酚、总黄酮含量与抗氧化和酶抑制活性之间的相关性。
2 结果与分析
2.1 总酚含量
如图1所示,野生和种植藜蒿不同部位提取物的总酚含量有明显的差别。野生藜蒿叶的总酚含量最高 (30.12 mg GAE/g DM),野生藜蒿茎(22.62 mg GAE/g DM)和根 (15.72 mg GAE/g DM)次之,种植藜蒿叶(9.73 mg GAE/g DM)和茎(4.13 mg GAE/g DM)的总酚含量最低。野生藜蒿不同部位提取物的总酚含量均高于种植藜蒿对应部位的提取物,其中野生藜蒿茎的总酚含量是种植藜蒿茎的5 倍。这种差异可能是由土壤环境、气候条件(光照、降水量等)和生长周期等因素造成的[11]。Rodrigues 等[12]对15 种不同产地来源的蓝莓的总酚含量进行了分析,发现不同蓝莓的总酚含量范围为274.48~694.6 mg GAE/100 g。Tibbetts等[13]对多种野生海藻和养植海藻总酚含量进行了比较,发现野生海藻的总酚含量为11~59 mg GAE/g DW,而养植海藻的总酚含量只有4~5 mg GAE/g DW。
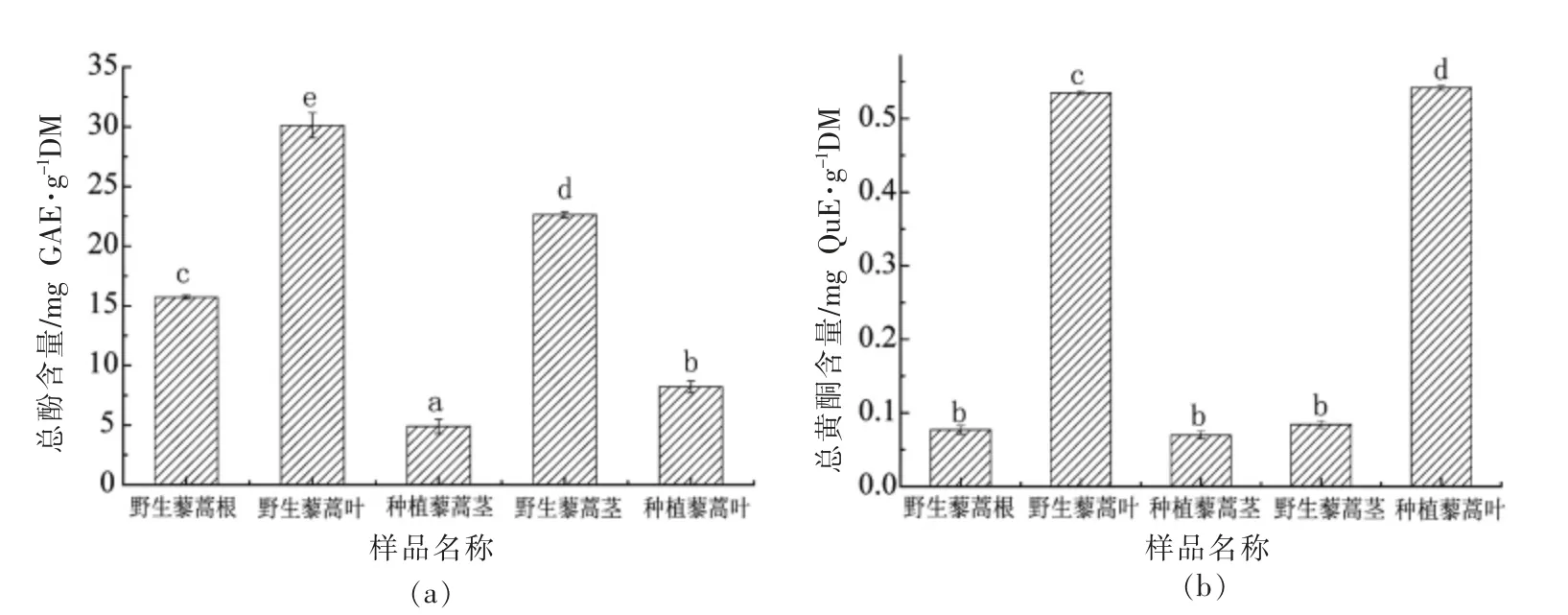
图1 野生和种植藜蒿不同部位提取物总酚(a)和总黄酮(b)含量Fig.1 The total phenolics (a)and total flavonoids (b)content of extracts from different parts of wild and cultivated Artemisia selengensis Turcz
2.2 总黄酮含量
由图1可知,不同藜蒿提取物总黄酮含量大小的顺序为:种植藜蒿叶>野生藜蒿叶>野生藜蒿茎>野生藜蒿根>种植藜蒿茎,野生和种植藜蒿不同部位提取物之间的总黄酮含量都偏低,张露等[7,14]研究表明藜蒿中主要的酚类化合物是酚酸。种植和野生藜蒿叶提取物具有最高的总黄酮含量,分别为0.63 和0.54 mg QuE/g DM(P<0.05);野生藜蒿根和茎提取物以及种植藜蒿茎提取物之间的总黄酮含量范围在0.065~0.085 mg QuE/g DM 之间,野生藜蒿茎和根之间不存在显著性差异(P>0.05)。由此可知,藜蒿中的黄酮类化合物主要存在于藜蒿叶之中。Ouerghemmi 等[15]在比较野生和种植芸香总黄酮含量时也得到了相似的结果,发现其总黄酮含量分别为168.91 和163.26 mg CE/g DW,且两者之间无显著性差异。
2.3 DPPH·清除能力
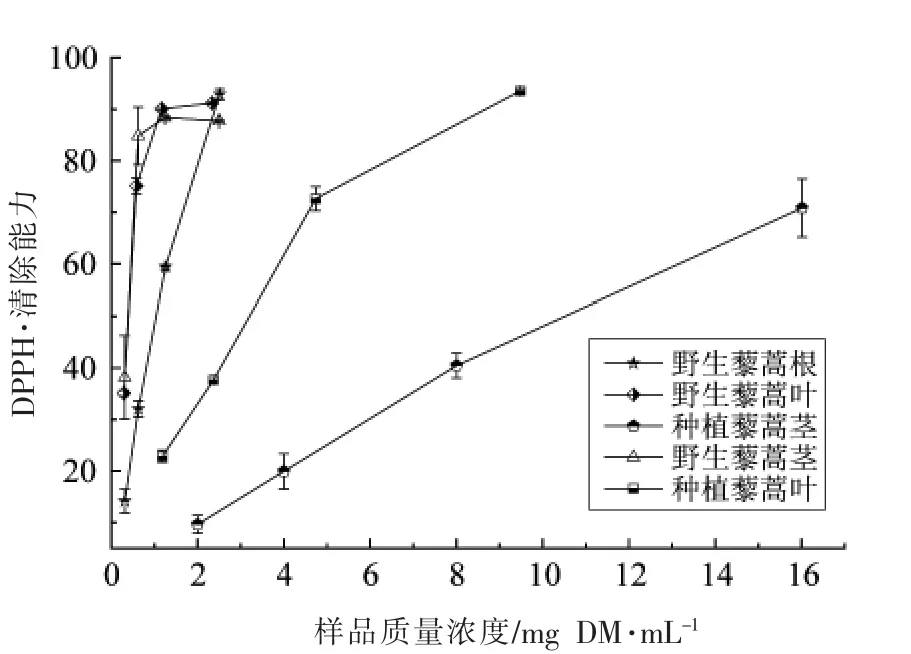
图2 野生和种植藜蒿不同部位提取物DPPH·清除能力Fig.2 The DPPH· scavenging ability of extracts from different parts of wild and cultivated Artemisia selengensis Turcz
如图2所示,所有藜蒿不同部位提取物都具有DPPH·清除能力,且其DPPH·清除能力与提取物的浓度呈明显量效关系,其IC50值见表1。野生藜蒿叶提取物的DPPH·清除能力最强,IC50值为0.37 mg DM/mL,其次为野生藜蒿茎提取物(0.38 mg DM/mL),且两者不存在显著性差异(P>0.05)。种植藜蒿茎的DPPH·清除能力最弱,其IC50值是野生藜蒿茎的31.5 倍。相关性分析表明,藜蒿提取物的DPPH·清除能力与其总酚和总黄酮含量的相关系数分别为-0.78 和-0.293,说明藜蒿提取物中的酚类化合物对其DPPH·清除能力的贡献最大。张露等[16]研究发现,藜蒿茎叶提取物具有很强的DPPH·清除能力,且与总酚含量的相关性最高。
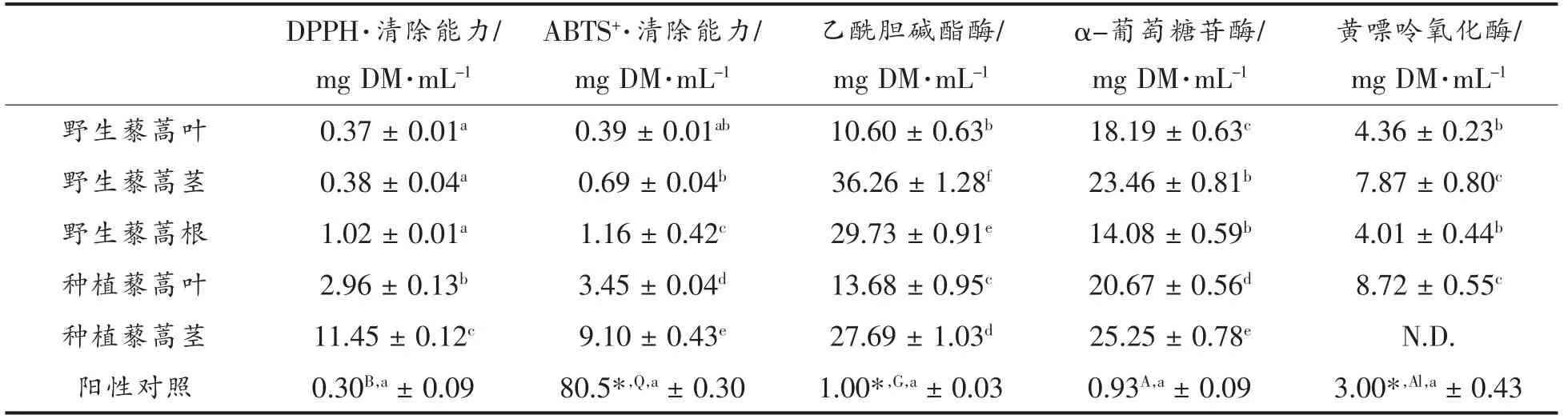
表1 野生和种植藜蒿不同部位提取物DPPH·清除能力、ABTS+·清除能力、α-葡萄糖苷酶、黄嘌呤氧化酶和乙酰胆碱酯酶活性抑制能力的IC50 值Table 1 The IC50 values of DPPH·scavenging ability,ABTS+·scavenging ability,α-glucosidase,xanthine oxidase and acetylcholinesterase inhibition of extracts from various parts of wild and cultivated Artemisia selengensis Turcz
2.4 ABTS+·清除能力
如表1和图3所示,所有藜蒿样品的ABTS+·和DPPH·清除能力的活性变化趋势一致,且不同样品之间的ABTS+·清除能力差异显著(P<0.05)。不同藜蒿提取物ABTS+·清除能力大小顺序为:野生藜蒿叶>野生藜蒿茎>野生藜蒿根>种植藜蒿叶>种植藜蒿茎。野生藜蒿叶提取物具有最高的ABTS+·清除能力,IC50值为0.39 mg DM/mL,其值是种植藜蒿叶的9 倍;种植藜蒿茎的ABTS+·清除能力最低,其值是野生藜蒿茎的13 倍。相关性分析表明,藜蒿提取物中酚类化合物含量与ABTS+·清除能力具有很高的相关性(r=-0.845),黄酮类化合物ABTS+·清除能力相关性低,其相关性系数为-0.242。因此,酚类化合物是藜蒿中最主要的ABTS+·清除剂。
2.5 α-葡萄糖苷酶活性抑制能力
糖尿病是以持续高血糖为诊断特征的一种慢性代谢性的疾病,机体长期处于高血糖状态将引发视网膜病变、肾病和心血管疾病等糖尿病并发症[17]。α-葡萄糖苷酶抑制剂是临床上用于治疗糖尿病的一种有效的药物,它能通过抑制小肠上α-葡萄糖苷酶的活性来减少机体对碳水化合物的吸收,降低糖尿病患者的餐后和空腹血糖水平[18]。但是合成的α-葡萄糖苷酶抑制剂具有腹胀、腹泻等副作用,因此,天然植物来源的无毒副作用的α-葡萄糖苷酶抑制剂成为研究热点[19]。
如图4所示,野生藜蒿根的α-葡萄糖苷酶抑制能力最强,IC50值为14.08 mg DM/mL,其抑制能力是阿卡波糖的1/15。野生和种植藜蒿的叶和茎提取物的IC50值范围为18.19~25.25 mg DM/mL,野生和种植藜蒿的相同部位的提取物之间差异显著(P<0.05)。由此可知,相比藜蒿其它部位提取物,野生藜蒿根更适合作为天然抗糖尿病药物的来源。相关性分析表明,藜蒿提取物中的多酚和黄酮类化合物与其α-葡萄糖苷酶抑制能力的相关性系数分别为-0.371 和-0.165;藜蒿提取物的DPPH·和ABTS+·清除能力与α-葡萄糖苷酶抑制活性相关性系数分别为0.590 和0.617,这表明藜蒿提取物的α-葡萄糖苷酶活性抑制能力是由于其中多种化合物的协同效果,抗氧化成分对α-葡萄糖苷酶活性有很大的抑制作用。
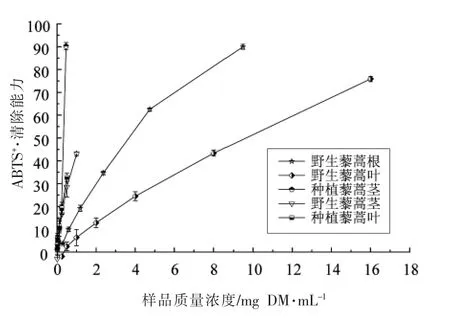
图3 野生和种植藜蒿不同部位提取物ABTS+·清除能力Fig.3 The ABTS+· scavenging ability of extracts from different parts of wild and cultivated Artemisia selengensis Turcz
2.6 黄嘌呤氧化酶抑制能力
黄嘌呤氧化酶是嘌呤代谢过程中的一种关键酶,它能催化次黄嘌呤氧化成黄嘌呤,最终产生尿酸[20]。大部分尿酸是通过肾产生的,尿酸过量产生会引起痛风和高尿酸血症,同时也会提高高血压和肾结石等疾病的发病率[21-22]。治疗痛风和高尿酸血症常用的方法是运用黄嘌呤氧化酶抑制剂降低人体内黄嘌呤氧化酶的活性,从而减少尿酸的生成。但是目前临床上使用的黄嘌呤氧化酶抑制剂如别嘌呤醇具有发热、引起过敏性皮疹和器官受损等副作用[23]。因此,本研究通过藜蒿提取物黄嘌呤氧化酶抑制活性来评估其作为黄嘌呤氧化酶抑制剂的潜力。
如图5和表1所示,野生藜蒿根和叶具有最高的黄嘌呤氧化酶抑制活性,其IC50值分别为4.01 和4.39 mg DM/mL;种植藜蒿茎的黄嘌呤氧化酶抑制活性最弱,其IC50值高于16 mg DM/mL。当样品浓度小于10 mg DM/mL 时,藜蒿样品对黄嘌呤氧化酶抑制能力呈浓度依赖性,但是其活性远低于阳性对照组别嘌呤醇(IC50=3.0 μg/mL)。相关性分析显示,藜蒿提取物总酚和总黄酮含量与黄嘌呤氧化酶抑制能力的相关性系数分别为-0.331 和-0.481,表明藜蒿中黄酮类化合物对黄嘌呤氧化酶的抑制能力贡献大,藜蒿提取物的弱黄嘌呤氧化酶抑制能力可能与其低的黄酮含量有关。
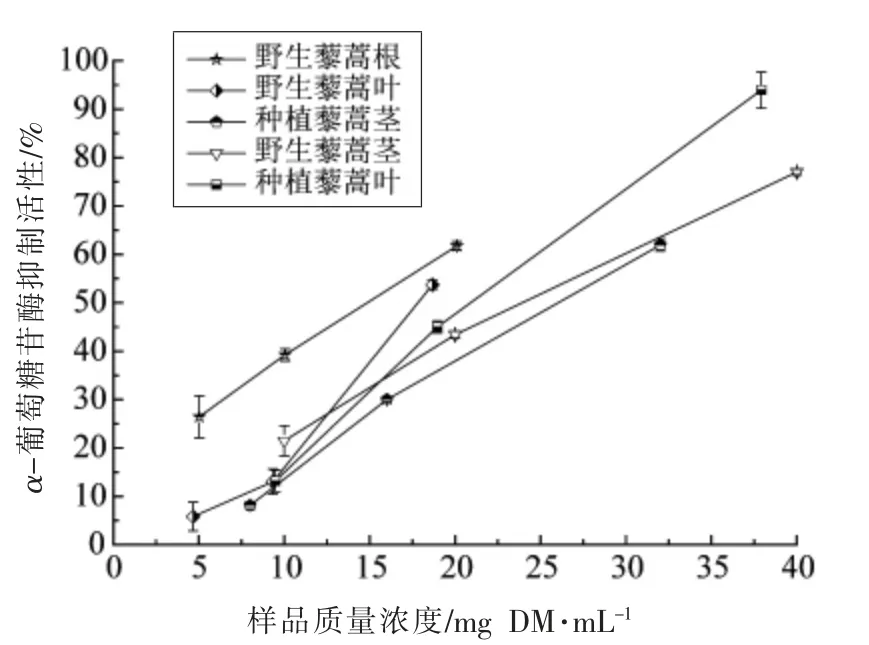
图4 野生和种植藜蒿不同部位提取物α-葡萄糖苷酶活性抑制能力Fig.4 The inhibtion on α-glucosidase activity of extracts from different parts of wild and cultivated Artemisia selengensis Turcz
2.7 乙酰胆碱酯酶抑制能力
乙酰胆碱酯酶可通过催化乙酰胆碱的裂解降低大脑内乙酰胆碱的浓度。当人体中乙酰胆碱酯酶活性过高时,就会造成大脑内乙酰胆碱水平降低,从而终止神经信号的传输,最终引发老年痴呆等疾病[24]。治疗老年痴呆的有效方法之一是使用乙酰胆碱酯酶抑制剂降低乙酰胆碱酯酶活性[25],因此,本研究采用乙酰胆碱酯酶活性抑制能力评定藜蒿提取物在老年痴呆病药物治疗方面的应用前景。
由图6可知,在测量浓度范围内,藜蒿提取物的乙酰胆碱酯酶抑制能力随其浓度的提高不断增强。如表1所示,藜蒿叶提取物具有相对较好的乙酰胆碱酯酶抑制活性,野生和种植藜蒿叶的IC50值分别为10.30 和13.68 mg DM/mL,但远低于样品对照品加兰他敏的活性(IC50=1.0 μg/mL)。野生藜蒿根和茎提取物以及种植藜蒿茎提取物的乙酰胆碱酯酶抑制能力分别是野生藜蒿叶提取物的2.9,3.6 和2.7 倍。相关性分析显示,藜蒿提取物的总黄酮含量与乙酰胆碱酯酶活性的相关性系数为-0.923,呈高度的负相关,这说明藜蒿中的黄酮类化合物是其主要的乙酰胆碱酯酶抑制剂。
3 结论
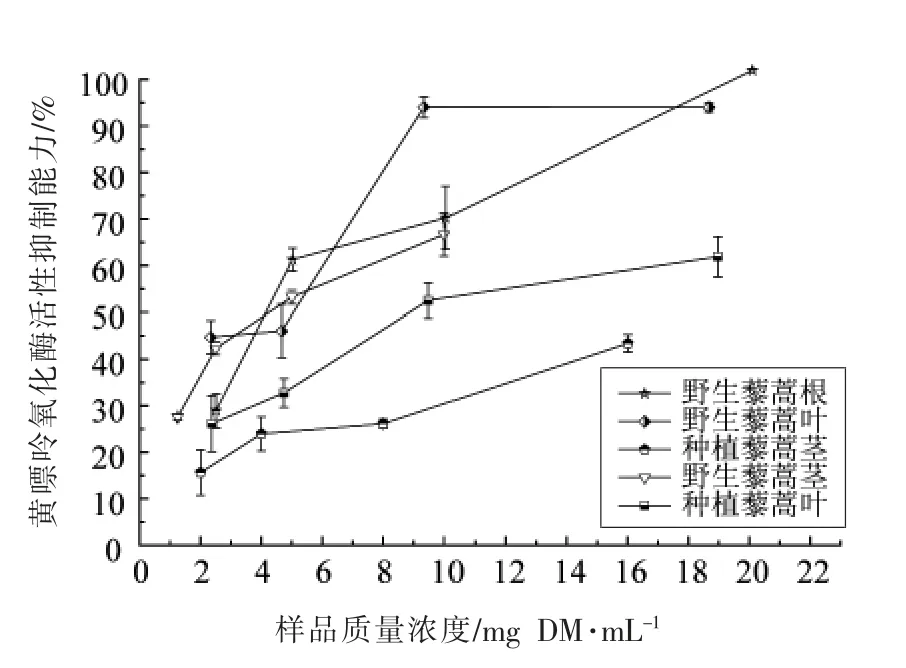
图5 野生和种植藜蒿不同部位提取物黄嘌呤氧化酶活性抑制能力Fig.5 The inhibtion on the activity of xanthine oxidase of extracts from different parts of wild and cultivated Artemisia selengensis Turcz
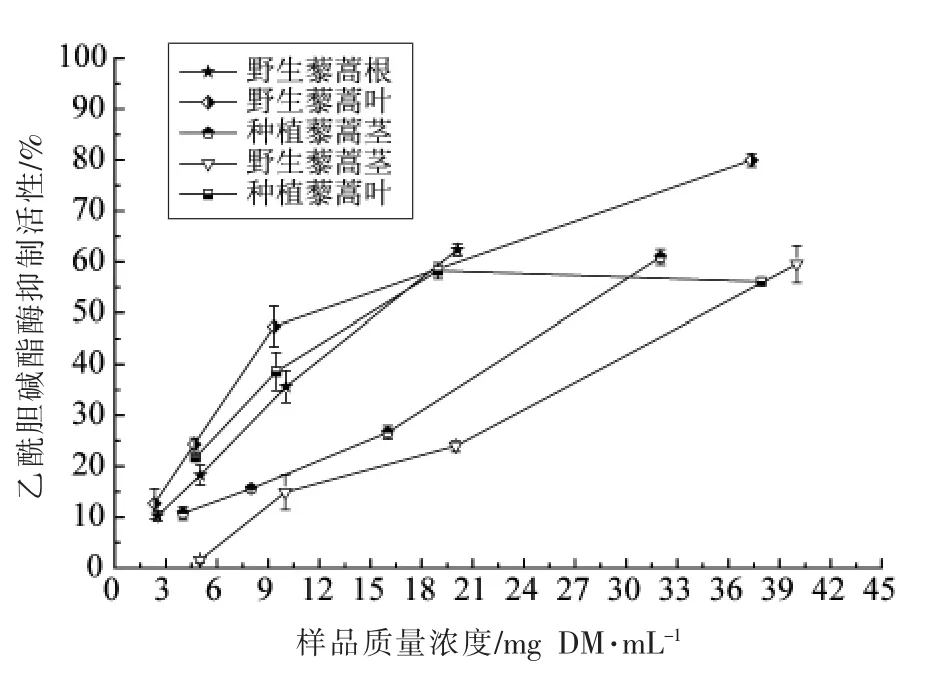
图6 野生和种植藜蒿不同部位提取物乙酰胆碱酯酶活性抑制能力Fig.6 The inhibtion on the activity of acetylcholinesterase of extracts from different parts of wild and cultivated Artemisia selengensis Turcz
本研究首次对野生和种植藜蒿各部位提取物的总酚含量、总黄酮含量、抗氧化活性以及α-葡萄糖苷酶、黄嘌呤氧化酶和乙酰胆碱酯酶的抑制能力进行对比分析。结果表明,野生藜蒿叶的总酚含量最高,种植藜蒿叶的总黄酮含量最高。总体上来说,野生藜蒿各部位提取物的抗氧化活性和酶抑制能力强于种植藜蒿对应部位的提取物。野生藜蒿叶具有最强的DPPH·和ABTS+·清除能力,是藜蒿中最优质的抗氧化活性成分来源。野生藜蒿根提取物具有最好的α-葡萄糖苷酶抑制能力,其IC50值是阿卡波糖的15 倍,可进一步作为高活性α-葡萄糖苷酶抑制剂的筛选材料来源。相比其它藜蒿提取物,野生藜蒿叶和根提取物分别具有较好的乙酰胆碱酯酶和黄嘌呤氧化酶抑制能力,但其抑制能力与阳性对照组相差较大。多酚类化合物是藜蒿中最主要的抗氧化成分,黄酮类化合物是其主要的乙酰胆碱酯酶抑制剂。本研究可为野生和种植藜蒿资源的进一步开发和利用提供借鉴。

