纳米ZnO对小麦秸秆还田土壤中土壤呼吸及土壤酶活性的影响
姜 浩,杨宝山,王 惠,曹鑫磊,高永超,吴庆通
(1.济南大学 水利与环境学院,山东 济南 250022; 2.齐鲁工业大学(山东省科学院)生态研究所 山东省应用微生物重点实验室,山东 济南 250013)
纳米ZnO(ZnONPs)作为常见的纳米材料之一,因其具有传统大颗粒ZnO的特性和其自身独特的纳米特性[1-2],在催化剂、化妆品和纺织品等领域得到广泛的应用[3-5]。ZnONPs的广泛生产和应用增加了其在环境中的大量释放[4-5]。ZnONPs作为一类重要的无机纳米材料,已有学者指出,其对土壤微生物的毒性比有机纳米颗粒更大[6]。此外,这些金属氧化物纳米颗粒还可通过对微生物代谢的毒性作用,影响土壤生态系统的养分循环[7]。
还田秸秆是土壤中有机质和土壤养分的主要来源之一。据统计,近年来小麦秸秆的产量每年达到1.54×108~1.85×108t[8],通过秸秆还田对其进行处理,是减少环境污染,增加土壤有机碳含量的重要途径[9-10]。土壤呼吸是土壤碳素排放到大气的主要途径[11],是农田生态系统中土壤碳排放的一个重要组成部分[12]。纳米颗粒在土壤中的大量积累可能会对土壤呼吸及相应的微生物活性产生影响。但关于秸秆还田条件下ZnONPs对土壤呼吸作用影响的研究,目前还未见开展。因此,开展ZnONPs对小麦秸秆还田后土壤呼吸的影响的研究,探明ZnONPs对土壤碳循环过程的影响,分析其影响因素,对ZnONPs环境风险评价具有重要意义。
1 材料与方法
1.1 材料
1.1.1 供试材料
ZnONPs购自北京博宇高科新材料技术有限公司,淡黄色粉末,纯度为99.9%,平均粒径约14.6 nm,比表面积为51.5 m2/g。
小麦秸秆采自当地收割后的新鲜小麦,带回实验室后风干并粉碎至2 cm以下。
1.1.2 土壤采集
土壤样品于2018年3月采自山东省济南市章丘区(117°23′31.11″E,36°40′5.23″N)冬小麦-夏玉米轮作农田土壤,土壤类型为潮土,取样深度为0 ~ 20 cm。土壤样品采集后迅速带回实验室,去除可见根系、有机碎屑和石头等,将新鲜土样充分混匀后过2 mm筛,并测定土壤基本理化性质:pH值为7.35,w(含水量)为10.13%,w(有机质)为1.66%,w(铵态氮)为8.03 mg/kg,w(硝态氮)为6.18 mg/kg,w(总氮)为0.83 g/kg,备用。
1.2 试验设计
为稳定土壤微生物活性,在试验开始前将供试土壤在(25 ± 3)℃,黑暗条件下预培养2周,期间调节土壤含水量为最大持水量(w)的50%[13]。试验设无任何添加的处理(CS),秸秆还田处理(5 g/kg)[14](SW)和秸秆还田(5 g/kg)并添加ZnONPs(500 mg/kg)[12]3个处理,每个处理重复3次。
将预培养的土壤分装于9个2.5 L的广口瓶底部,每个瓶中装相当于50 g干重的土壤,将ZnONPs和小麦秸秆均匀混合于土壤中,调节土壤含水量至最大持水量的50%,内置装有25 mL NaOH(0.1 mol/L)溶液的50 mL烧杯,盖上瓶塞,用真空硅脂密封。广口瓶置于温室中,温度保持在(25 ± 3)℃、黑暗条件下进行室内矿化实验,分别在第2、4、7、14、21、28、42、56天取出烧杯。用0.05 mol/L HCl反滴定法确定CO2释放量,计算CO2累积排放量[15]。分别在第7、14、56天进行破坏性取样,存于4℃冰箱,用于进行土壤酶活性、土壤理化性质和微生物生物量的测定。
1.3 试验方法
1.3.1 土壤pH值的测定
土壤pH值选用水土比2.5∶1(V/m)采用酸度计测定[4]。
1.3.2 土壤酶活性测定
土壤过氧化物酶的测定采用邻苯三酚比色法[16],其活性以每克土壤2 h内生成焦性没食子酸的毫克数来表示;土壤纤维二糖水解酶的测定由上海通蔚生物科技有限公司利用试剂盒完成,其单位为每克土壤消耗国际单位酶量;β-葡萄糖苷酶的测定采用硝基酚比色法[17],其活性以每克土壤1 h产生的对-硝基酚的微克数表示。
1.3.3 土壤MBC和微生物吸收Zn2+数量测定
土壤MBC的测定采用氯仿熏蒸-硫酸钾提取的方法[4]。微生物中Zn2+含量的测定采用氯仿熏蒸-硝酸铵提取的方法[15]。
2 结果与讨论
2.1 ZnONPs对土壤呼吸的影响
ZnONPs改变了小麦秸秆还田土壤中CO2的释放(图1)。从第4 d开始,秸秆添加处理中CO2的释放均显著高于对照组,且随着天数增加,差异性越明显。与SW处理相比,ZnONPs添加后CO2的释放在整个培养过程中都被抑制,但土壤呼吸作用释放的CO2显著高于对照。在56 d前,SW与SWZ处理间无显著差异。可见,在培养期间,加入小麦秸秆后土壤呼吸作用显著提高,但在ZnONPs处理中CO2的释放明显降低,表明ZnONPs对添加小麦秸秆后的土壤呼吸具有一定的抑制作用。当ZnONPs暴露于土壤中时,对ZnONPs敏感的微生物会受到抑制,这可能是ZnONPs进入土壤后呼吸速率下降的原因[15]。
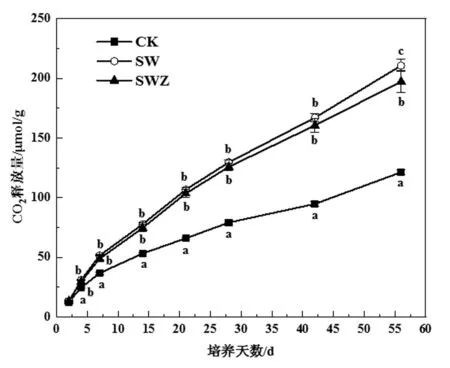
图1 三种处理条件下CO2释放量的变化
2.2 ZnONPs对土壤酶活性的影响

图2 ZnONPs和小麦秸秆对过氧化物酶(A),纤维二糖水解酶(B)和β-葡萄糖苷酶(C)的影响
在添加ZnONPs和小麦秸秆的条件下,3种土壤酶活性产生不同的变化(图2A,2B和2C)。第7 d时,过氧化物酶活性在秸秆处理下最高,ZnONPs添加后其活性降低,而在14 d和56 d后,过氧化物酶活性在各处理间无显著差异(图2A)。在整个培养过程中,添加秸秆的处理组中纤维二糖水解酶的活性显著升高;其中,ZnONPs处理下的纤维二糖水解酶活性在第7 d和56 d显著低于秸秆添加处理,但在第14 d时无显著差异(图2B)。过氧化物酶和纤维二糖水解酶的活性均随着培养天数升高而增加。可见,ZnONPs对过氧化物酶和纤维二糖水解酶的抑制效果较为显著。重金属可以与巯基反应形成金属巯蛋白,从而使酶失去活性或受到抑制[18]。在7 d和14 d后,虽然ZnONPs对β-葡萄糖苷酶活性存在抑制作用,但没有显著差异,而在实验过程的最后阶段(56 d),在添加ZnONPs的处理中,β-葡萄糖苷酶活性显著高于对照组(图2C)。此外,β-葡萄糖苷酶活性随着培养天数的增加有略微降低。纤维素是秸秆中易分解的不稳定的成分,通常比木质素降解的更快[19],这可能是其随培养天数的增加而降低的主要原因。
2.3 ZnONPs对pH值和微生物中Zn2+含量的影响
如表1所示,在整个培养过程中,SW处理的pH值均略低于CK和SWZ处理。在第7 d,SWZ相较于SW显著提高了3.9%;然而14 d后,SW比对照组降低了3.1%,而SWZ比SW的pH值提高了3.6%;培养56 d后,SW与对照组相比降低了1.7%。可见,小麦秸秆添加后,土壤pH值降低,表明外源有机质的添加可影响土壤化学性质;而添加ZnONPs土壤的pH值与对照相比无显著差异,表明ZnONPs的暴露抑制了有机质的分解。事实上,小麦秸秆的分解增加了CO2释放,是土壤pH值降低的可能原因之一。植物残体富含木质素、纤维素和酚类化合物,分解后会在土壤中产生有机酸,也可能导致土壤pH值的降低[15]。此外,SWZ处理的微生物中Zn2+的浓度是对照组的3.4倍,表明ZnONPs添加后释放的Zn2+可被微生物吸收。

表1 ZnONPs和小麦秸秆对土壤pH值和微生物中Zn2+的影响
2.4 ZnONPs对MBC的影响
如图3所示,添加秸秆和ZnONPs后,同一天数不同处理之间及同一处理不同培养天数之间的土壤微生物量碳含量均不存在显著差异。然而,Rashid等[33]发现,高浓度氧化铁纳米颗粒(2000 mg/kg)降低了MBC。由此可见,MBC的变化与NPs的剂量和种类有关,本研究中,ZnONPs在500 mg/kg浓度下,对土壤微生物量影响较小。

图3 ZnONPs和小麦秸秆对微生物生物量碳的影响
3 研究结论
(1)小麦秸秆的添加增强了土壤呼吸作用及过氧化物酶、纤维二糖水解酶和β-葡萄糖苷酶活性,显著促进了土壤中的碳循环过程。
(2)ZnONPs对土壤呼吸和纤维二糖水解酶具有抑制作用,抑制作用的大小随着培养时间的延长而增大。ZnONPs添加后,微生物中Zn2+的含量显著增加。

