不同溶血性大肠杆菌的分离与鉴定
杜荣起,任君,乔启,张晴,刘燕霏,杨建德
(天津农学院 动物科学与动物医学学院,天津 300384)
大肠杆菌(E.coli)在自然界中广泛存在,在1885年被德国细菌学家Escherich分离出来[1]。大肠杆菌不仅是寄生在人体、动物体胃肠道的优势菌群,同时能引起动物和人类的感染,其肠外感染与毒力因子有关。溶血素是肠外感染较重要的致病因子,按照抗原的成分不同可分α溶血、β溶血、γ溶血3种,这3种溶血素可作为疾病严重程度评价的准则[2],溶血素可作用于红细胞、血小板,破坏溶酶体,导致组织缺血性坏死[3]。在兽医临床中,溶血性大肠杆菌可引起猪、犬、牛、鹿、水貂、鸡、鸭的败血症、脓血症和腹泻[4]。在医学临床中,溶血性大肠杆菌可引起败血症、腹膜炎、沙眼和尿道感染[5]。随着人们生活水平的提高,饲养宠物成为人们享受生活的一种方式。而伴侣动物可携带多种人兽共患病,对人类的健康构成潜在的威胁。本文对两株不同溶血性大肠杆菌进行分离与鉴定,以期为治疗此类相关感染提供参考依据。
1 材料
1.1 病料来源
某动物医院,病例1为2018年10月18日收治的4岁龄母犬,病例2为2018年11月6日收治的9岁龄母犬,均患有子宫蓄脓。
1.2 试剂
1.2.1 培养基:麦康凯培养基、血液平板培养基、普通营养琼脂培养基。
1.2.2 肠杆菌科生化鉴定管:葡萄糖、麦芽糖、尿素等,购自杭州生物研究所。
1.2.3 药敏试剂片:氨曲南、头孢噻肟、哌拉西林等,购自杭州微生物试剂公司。
1.2.4 分离菌株16S rRNA 基因序列PCR扩增,上游引物 5'-CAGAGTTTGATCCTGGCT-3'、下游引物5'-AGGAGGTGATCCAGCCGCA-3'由生工生物工程(上海)股份有限公司合成,dNTP和Taq酶均购自生工生物工程(上海)股份有限公司。
2 方法
2.1 病原菌的采集与培养
分别从手术切除的犬子宫中无菌抽取适量脓汁,接种于普通营养琼脂、麦康凯和血平板培养基上,并进行划线培养,37 ℃培育18 h,挑出单个优势菌落进行纯化培养。
2.2 涂片染色镜检
分别挑取分离纯化的单个菌落,涂片、革兰氏染色观察。
2.3 生化试验
分别挑取纯化的单个菌落,无菌接种于肉汤培养基中,37 ℃培养24 h后,接种于肠杆菌科生化鉴定管,37 ℃恒温培养24 h,对比分析记录结果。
2.4 药敏试验
分别挑取纯化的单个菌落无菌接种于肉汤培养基中,37 ℃培养24 h后得到培养菌液(3×109CFU/mL)。取100 μmL菌液接种于普通营养琼脂表面,用“T”型涂布棒均匀涂布,将药敏片均匀等距贴在涂布后的培养基表面,37 ℃培养 24 h,观察结果。
2.5 分离菌株16S rRNA基因序列的PCR扩增
按7F1540R(细菌)试剂盒操作提取2例细菌的DNA。以提取的DNA为模板进行PCR扩增,预计扩增片段为1 500 bp。在94 ℃条件下预变性4 min,经30次循环,94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸1 min,保持72 ℃延伸10 min,最后以4 ℃到PCR扩增结束。
2.6 分离菌株16S rRNA基因序列同源性分析与系统发育树构建
测定的基因序列在NCBI上使用BLAST进行比对,选取与分离菌株相近的序列,在 DNAstar软件上进行同源性对比、分析并构建基因系统发育树。
3 结果
3.1 分离纯化培养后菌落形态特征
病料1分离菌(1 018)在麦康凯培养基上呈粉红色菌落,见图1;在血液平板培养基上呈灰白色,菌落周围形成透明的β溶血环见图2。病料2分离菌(1 106)在麦康凯培养基上呈砖红色菌落,见图3;在血液平板培养基上呈灰黑色,菌落周围形成1~2 mm草绿色溶血环,见图4。

图1 1 018 麦康凯培养基菌落形态
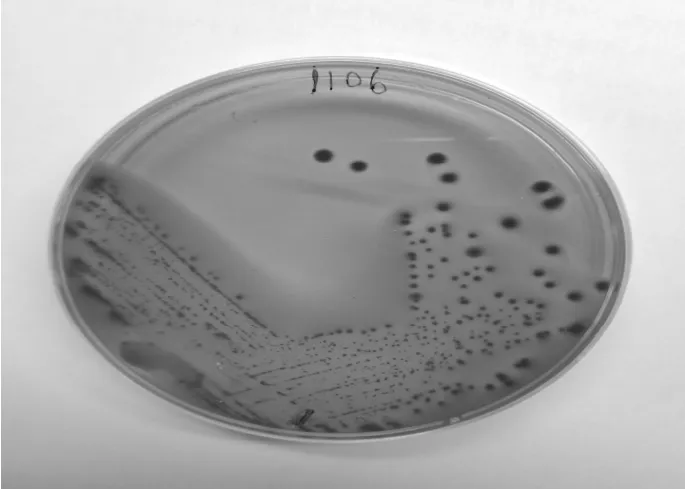
图3 1 106 麦康凯培养基菌落形态

图4 1 106 血平板菌落形态
3.2 涂片染色镜检
1 018、1 106病原菌在油镜下可看到较密集的短杆状革兰氏染色阴性杆菌(图5)。
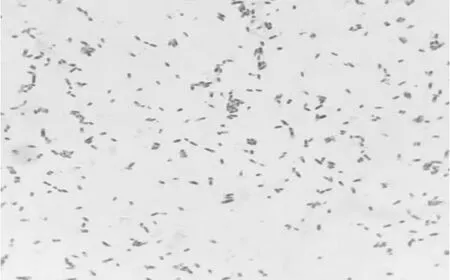
图5 革兰氏染色结果
3.3 生化试验结果
对1 018、1 106两株病原菌进行生化试验,二者均能分解葡萄糖、甘露醇,不能分解麦芽糖、蛋白胨水,不能利用尿素、枸橼酸盐、葡萄糖磷酸盐,不产生硫化氢;1 018半固体琼脂反应阴性,不具有运动性,能分解蔗糖、乳糖。1 106半固体琼脂反应阳性,具有运动性,能分解蔗糖、乳糖,结果见表1。

表1 两株分离菌生化试验结果
3.4 药敏试验结果
药敏试验,按照CLSL药敏试验标准分为耐药(R)、中度敏感(I)、高度敏感(S),结果见表2。

表2 分离菌药敏试验结果
3.5 分离菌16S rRNA基因序列PCR扩增
得到的2株菌经PCR扩增测序,16S rRNA 基因序列电泳后的基因扩增片段长度为1 475和1 481 bp,1 018基因登录号为MK729002,1 106基因登录号为MK729003。
3.6 分离菌株16S rRNA基因序列同源性比对
经基因测序获得的基因序列在 NCBI上进行BLAST比对,选取5株相近参考序列,将分离菌16S rRNA 基因序列经DNAstar软件中的Megalign与该5株16S rRNA 基因序列进行同源性比对。结果,1 018、1 106的16S rRNA 基因序列与溶血性大肠杆菌的 16S rRNA 基因序列的同源性均在97%以上,见图6。

图6 分离菌16S rRNA 基因序列与参考序列同源性比对结果
3.7 分离菌株16S rRNA基因序列与参考序列构建进化树结果
采用DNAStar中的Megalign将分离菌16S rRNA基因序列与参考序列进行比较分析,经Neighbor-Joining法进行进化树构建。经进化树分析发现,1 018与CP016358的同源性高达100%;1 016与NR-114042的同源性高达99.7%(图7)。

图7 分离菌16S rRNA 基因与参考序列构建进化树分析
4 讨论
此次从犬子宫蓄脓中分离出的2株细菌,在培养基上的生长状态与染色镜检的结果与何焕学等提到的溶血性大肠杆菌培养特征与革兰氏染色镜检结果一致[4]。生化试验结果与杨万秋报道的兔溶血性大肠杆菌分离鉴定中的生化试验结果基本符合[6]。分离菌株 16S rRNA的基因序列和 NCBI中参考大肠杆菌16S rRNA 基因同源性达99.7%以上,综合分析2株病原菌的生理生化特 征[7-8],确定为α、β溶血性大肠杆菌。根据药敏结果分析表明,β溶血性大肠杆菌对卡那霉素、链霉素、头孢噻吩、氧氟沙星、麦迪霉素、头孢呋辛、妥布霉素耐药,α溶血性大肠杆菌对麦迪霉素耐药,可见这两株细菌在耐药性方面存在一些差异,分析原因可能与动物使用过抗生素类药物有关。β溶血性菌株的耐药性明显高于α溶血性菌株,这可能与病原菌的致病力强弱有关,形成β溶血的病原菌毒力明显高于α溶血的病原菌,赵新书等的研究结果表明,病原菌产生耐药性和多重耐药最重要的是与长期过度使用抗生素类药物有着密不可分的关系[9]。
犬子宫蓄脓是犬子宫有大量脓汁聚集,伴有增生与病菌感染的产科疾病[10],是兽医临床上常见的疾病。该病的引发原因与动物的产后感染、内分泌代谢紊乱以及病原菌感染有关,主要的致病菌为大肠杆菌[11],此两例犬子宫蓄脓是犬在发情期时在激素和孕酮的作用下,产生大量溶血性大肠杆菌造成的,同时大肠杆菌也是败血症、腹膜炎、心包炎以及猪水肿病的罪魁祸首[12-13]。化脓性疾病病灶区作为人兽共患病的传染源所产生的疾病也对人类的健康构成了潜在的威胁。此次研究进一步明确溶血性大肠杆菌的生物学特性,为今后溶血性大肠杆菌疾病的发生和预防提供一定的理论基础,为防治化脓性疾病所引起的人畜共患病提供参考依据。

