忽地笑ABCG5转运蛋白基因(LaABCG5)的克隆和表达分析
刘彦彤, 王 蓉, 汪 仁
〔江苏省中国科学院植物研究所(南京中山植物园), 江苏 南京210014〕
忽地笑〔Lycorisaurea(L’Hér.) Herb.〕隶属于石蒜科(Amaryllidaceae),是国内常见的多年生草本植物,全株含有丰富的生物碱,包括水仙环素(narciclasine)、加兰他敏(galanthamine)和石蒜碱(lycorine)等,其中石蒜碱和水仙环素被用于治疗白血病,还作为抗肿瘤药物[1-2],而加兰他敏是治疗小儿麻痹症、重症肌无力和阿尔茨海默症等疾病的关键药物[3]。目前,加兰他敏的主要获取方式是从石蒜科植物中提取,但其含量仅在0.08%左右[3]。加兰他敏的生物合成途径最早由Barton等[4]提出,其中部分关键酶已经明确。在合成途径的上游,酪氨酸脱羧酶LaTYDC1将酪氨酸转化为酪胺同3,4-二羟基苯甲醛合成异喹啉类生物碱的前体骨架降孤挺花啶[5]。Kilgore等[6-7]在黄水仙(NarcissuspseudonarcissusLinn.)的鳞茎中先后发现2个关键酶,即4-O-甲基转移酶NpN4OMT和细胞色素P450 NpCYP96T1。Sun等[8]发现O-甲基转移酶LaOMT1参与加兰他敏的合成,且加兰他敏在忽地笑的花、鳞茎和叶片中含量较高。通过分析加兰他敏合成途径中关键酶的组织定位发现,加兰他敏主要在鳞茎中合成[6-7],推测加兰他敏在合成部位与储存部位之间有特异转运蛋白,参与了加兰他敏的跨膜转运和长距离运输。
ABC(ATP-binding cassette)转运蛋白是一类跨膜蛋白,全称为腺苷三磷酸结合盒转运蛋白,这类转运蛋白通过水解ATP释放能量实现底物的跨膜转运[9]。ABC转运蛋白广泛存在于原核和真核生物体内,参与激素转运、脂质分泌、有毒物质集中和次生代谢物转运等生理生化过程[10],在植物生长发育中发挥关键作用。ABC转运蛋白结构主要包含2个部分,分别是水解ATP的核苷酸结合结构域(NBD,nucleotide binding domain)和提供转运途径的含有多个α-螺旋的跨膜结构域(TMD,transmembrane domain)[11]。NBD位于膜的胞质面,通过结合和水解ATP产生能量为转运底物提供动力。TMD则是利用NBD释放的能量选择底物并进行跨膜运输。两者相辅相成共同实现了ABC转运蛋白的转运功能[12]。根据蛋白质结构域的不同,可以将大多数真核生物的ABC转运蛋白分为8个主要亚家族(A至H),其中,ABCG转运蛋白是ABC家族中体系最大的亚家族,ABCG亚家族具有结构域类型为NBD-TMD的反向序列,与其他亚家族相区别[13-14]。
植物中ABC转运蛋白参与多种次生代谢产物的运输,如日本黄连(CoptisjaponicaMakino)中转运蛋白CjMDR1参与由胞外向胞内转运小檗碱(berberine)的运输过程[15],拟南芥〔Arabidopsisthaliana(Linn.) Heynh.〕中转运蛋白AtABCG14参与细胞分裂素由胞内向胞外的运输[16],Physcomitrellapatens(Hedw.) Bruch et Schimp.中转运蛋白PpABCG7参与蜡质由胞内向胞外的分泌过程[17]。本研究通过对茉莉酸甲酯(MeJA,methyl jasmonate)处理忽地笑比较转录组数据的分析,结合加兰他敏在忽地笑体内的分布和积累特性,报道了1个可能参与加兰他敏转运和积累过程的ABCG5转运蛋白基因,通过生物信息学分析、激光扫描共聚焦显微镜及实时荧光定量PCR(qRT-PCR)技术,确定了该转运蛋白的三级结构、跨膜结构域和亚细胞定位,并对该转运蛋白基因的表达特性进行分析,以期为石蒜科植物生物碱积累与转运的研究奠定基础。
1 材料和方法
1.1 材料
忽地笑的花于2018年8月采自江苏省中国科学院植物研究所药用植物资源苗圃,根、鳞茎和叶片等于同年10月采自同一苗圃。所有样品于-80 ℃保存。
实验使用的大肠杆菌感受态菌株TOP10和拟南芥原生质体载体pAN580为本实验室保存; SMARTerTMRACE cDNA Amplification Kit购自美国Clontech公司;RNAiso试剂盒、T4 DNA连接酶、pMD19-T载体和PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time)反转录试剂盒购自宝生物工程(大连)有限公司;Phanta Super-Fidelity DNA Polymerase、AceQ®qPCR SYBR®Green Master Mix、2×TaqMaster Mix (Dye Plus)和DL2000 DNA Marker购自南京诺唯赞生物科技有限公司;AxyPrep DNA凝胶回收试剂盒购自天津子涵生物科技有限公司。实验中所有引物(表1)合成及核酸序列测序均由生工生物工程(上海)股份有限公司完成。
表1 供试引物序列及用途
Table 1 Sequences and usages of primers tested

引物 Primer序列(5′→3′) Sequence (5′→3′)用途 UsageLaABCG5-53CCATCTGCATAAGGTGGTGGTGGTGGAG5′-RACELaABCG5-101ATGGCAGTACCGGTTCCTTCGATCTTTC5′-RACELaABCG5-471GAAGGGTACGAAAACTAGTGCATTGGCG3′-RACELaABCG5-547AGAATGCGTCTAGACTCGGATTGAGTCC3′-RACELaABCG5-FCTTCTAAAATGAAGGAAATAGAAGGT克隆全长Cloning full lengthLaABCG5-RCCTCATATTAAAGAACTATACTTCCA克隆全长Cloning full lengthLaABCG5-RT-FCGCAGGTTAATGTCGTCGAG实时荧光定量PCR Real-time quantitative PCRLaABCG5-RT-RCTCCACCACCACCACCTTAT实时荧光定量PCR Real-time quantitative PCRLaTIP41FGCAACCATCCAAAGTTTAACTGCT实时荧光定量PCR内参Real-time quantitative PCR internal referenceLaTIP41RAATGTGCAAGCAGGGCTAGTAA实时荧光定量PCR内参Real-time quantitative PCR internal referenceLaABCG5-pAN580-FATGAATGATTACGCCAGCTTGCATG亚细胞定位Subcellular localizationLaABCG5-pAN580-RACCTATGACATAAGATGTCAAC亚细胞定位Subcellular localization
1.2 方法
1.2.1 基因的克隆及序列比对
1.2.1.1 RNA提取 参照RNAiso试剂盒操作手册,称取约0.1 g植物组织,液氮速冻后均匀研磨,加入RNAiso reagent 1 mL,振荡混匀后室温静置5 min,再加入三氯甲烷200 μL,振荡混匀后室温静置5 min,12 000 r·min-1离心10 min;取上层水相,加入等体积异丙醇,轻柔混匀,室温静置10 min,12 000 r·min-1离心10 min;去上清液,用体积分数75%乙醇洗涤沉淀,12 000 r·min-1离心10 min,去上清液;待乙醇挥发后,沉淀用RNase-free水溶解。
1.2.1.2 基因全长克隆 根据cDNA已知的基因片段755 bp设计RACE特异性引物(引物序列见表1),进行5′-RACE和3′-RACE巢式PCR反应。PCR扩增体系总体积为50.0 μL,包含5×SF Buffer 10.0 μL、dNTP Mix 1.0 μL、Phanta®Super-Fidelity DNA Polymere 1.0 μL、10 μmol·L-1正向和反向引物各2.0 μL、模板cDNA 1.0 μL及ddH2O 33.0 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性30 s、56 ℃退火30 s、72 ℃延伸2 min,共32个循环;72 ℃延伸10 min。使用AxyPrep DNA凝胶回收试剂盒回收目的条带。回收的核酸片段与pMD19-T载体连接,转化大肠杆菌感受态菌株TOP10,阳性菌落送生工生物工程(上海)股份有限公司测序。
1.2.1.3 生物信息学分析 使用ORF finder(https:∥www.ncbi.nlm.nih.gov/orffinder/)分析并确定忽地笑ABCG5基因的开放阅读框;通过BLASTp(https:∥blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸序列比对分析;利用MEGA 7.0中neighbor-joining(NJ)方法构建系统进化树;利用DNAMAN进行同源序列比对;通过ExPASy(http:∥web.expasy.org/cgi-bin/protparam/protparam)在线分析蛋白质的理化性质;通过SOPMA(https:∥npsa-prabi.ibcp.fr/cgi-bin/secpred_sopma.pl)在线分析蛋白质二级结构;通过SWISS(http:∥swissmodel.expasy.org/interactive)模拟蛋白质三级结构;通过TMHMM(http:∥www.cbs.dtu.dk/services/TMHMM-2.0/?tdsourcetag=s_pcqq_aiomsg)在线分析蛋白质跨膜结构域。
1.2.2 基因相对表达量的比较
1.2.2.1 MeJA处理 将成熟度较高的忽地笑种子播种于灭菌蛭石中,置于光照时间16 h·d-1、光照强度100 μmol·s-1·m-2、温度22 ℃的光照培养箱中,用1/4 MS溶液浇灌,每隔3周更换1次蛭石,培养9个月。用一定量二甲基亚砜(DMSO,dimethyl sulfoxide)助溶MeJA,用ddH2O配制终浓度100 μmol·L-1MeJA溶液。用100 μmol·L-1MeJA溶液喷施幼苗叶片,对照组用等体积DMSO水溶液喷施,分别在喷施后0、6、12、24和36 h取叶片。所有样品于-80 ℃保存。
1.2.2.2 qRT-PCR分析 以忽地笑的LaTIP41基因作为内参基因[18]。qRT-PCR反应体系的总体积为20.0 μL,包含AceQ®qPCR SYBR®GreenMaster Mix 10.0 μL、10 μmol·L-1正向和反向引物各0.5 μL、模板cDNA 1.0 μL及ddH2O 8.0 μL。PCR扩增程序:95 ℃预变性5 min;95 ℃变性15 s、56 ℃退火15 s、72 ℃延伸20 s,共40个循环。采用2-ΔΔCt法[8]计算基因的相对表达量。
1.2.3 亚细胞定位 首先利用在线软件WoLF PSORT(https:∥wolfpsort.hgc.jp/)预测忽地笑ABCG5转运蛋白的亚细胞定位,然后用引物LaABCG5-pAN580-F和LaABCG5-pAN580-R克隆获得不含终止密码子的LaABCG5片段,并将其构建到pAN580载体中与绿色荧光蛋白(GFP)标签融合表达。根据Yoo等[19]的方法,将构建的pAN580-LaABCG5-GFP与本实验室构建的膜定位标记载体pAN580-PIP2A-mCherry同时转化拟南芥原生质体,避光孵育12~16 h,用Zeiss LSM780激光扫描共聚焦显微镜(德国Carl Zeiss公司)在激发光波长488 nm、发射光波长505~530 nm 条件下进行观察。
1.3 数据统计
利用SPSS 17.0软件对实验数据进行统计,采用Student-Newman-Keulsa方法进行差异显著性分析。
2 结果和分析
2.1 LaABCG5基因全长克隆
根据前期忽地笑比较转录组数据库中LaABCG5基因的部分序列信息设计引物,结合RACE克隆技术,分别获得已知片段5′端长度为1 052 bp和3′端长度为780 bp的DNA片段,再设计引物获得长度为2 135 bp的序列。经ORF finder分析LaABCG5基因的开放阅读框,编码区长度为1 896 bp(图1),编码631个氨基酸。
2.2 系统进化树与同源序列比对分析
将LaABCG5的氨基酸序列与其他植物ABC转运蛋白的氨基酸序列进行聚类分析,结果(图2)表明:LaABCG5与拟南芥ABCG5转运蛋白(GenBank登录号为OAP10401.1)的同源性最高,然后与烟草(NicotianatabacumLinn.)ABCG10-like和ABCG23-like转运蛋白(GenBank登录号分别为XP_016437027.1和XP_016433361.1)聚为一支。LaABCG5与拟南芥ABCG1和ABCG16转运蛋白(GenBank登录号分别为OAP11713.1和OAP04470.1)的同源性也较高,与拟南芥其他ABCG转运蛋白也有一定程度的同源性。

图1LaABCG5基因的PCR扩增图谱
Fig. 1 PCR amplification pattern ofLaABCG5gene

LaABCG5: 忽地笑ABCG5转运蛋白 ABCG5 transporter fromLycorisaurea(L’Hér.) Herb.; AtABCG5,AtABCG16,AtABCG1,AtABCG7,AtABCG14,AtABCG25,AtABCG12: 分别为拟南芥中ABCG5、ABCG16、ABCG1、ABCG7、ABCG14、ABCG25和ABCG12转运蛋白Respecting ABCG5, ABCG16, ABCG1, ABCG7, ABCG14, ABCG25, and ABCG12 transporters fromArabidopsisthaliana(Linn.) Heynh., respectively; NtABCG10-like,NtABCG23-like,NtABCG35-like: 分别为烟草中ABCG10-like、ABCG23-like和ABCG35-like转运蛋白Respecting ABCG10-like, ABCG23-like, and ABCG35-like transporters fromNicotianatabacumLinn., respectively; NpPDR1: 皱叶烟草PDR转运蛋白PDR transporter fromNicotianaplumbaginifoliaViv.; CjMDR1: 日本黄连MDR转运蛋白MDR transporter fromCoptisjaponicaMakino.
图2 LaABCG5与其他植物ABC转运蛋白的系统进化树
Fig. 2 Phylogenetic tree of LaABCG5 and ABC transporters from other plants
采用BLASTp对LaABCG5与其他植物ABCG5转运蛋白的氨基酸序列进行多重比对,结果(图3)显示:LaABCG5与海枣(PhoenixdactyliferaLinn.)和油棕(ElaeisguineensisJacq.)的ABCG5转运蛋白(GenBank登录号分别为XP_008810921.1和XP_010911492.2)的同源性分别为66.87%和66.57%,与番木瓜(CaricapapayaLinn.)和毛果杨(PopulustrichocarpaTorr. et Gray)的ABCG5转运蛋白(GenBank登录号分别为XP_021899883.1和XP_002309921.2)的同源性分别为62.91%和62.83%,与银白杨(PopulusalbaLinn.)ABCG5转运蛋白(GenBank登录号为TKR79274.1)的同源性为62.20%。

LaABCG5: 忽地笑ABCG5转运蛋白ABCG5 transporter fromLycorisaurea(L’Hér.) Herb.; EgABCG5: 油棕ABCG5转运蛋白ABCG5 transporter fromElaeisguineensisJacq.; PtABCG5: 毛果杨ABCG5转运蛋白ABCG5 transporter fromPopulustrichocarpaTorr. et Gray; PdABCG5: 海枣ABCG5转运蛋白ABCG5 transporter fromPhoenixdactyliferaLinn.; CpABCG5: 番木瓜ABCG5转运蛋白ABCG5 transporter fromCaricapapayaLinn.; PaABCG5: 银白杨ABCG5转运蛋白ABCG5 transporter fromPopulusalbaLinn.
图3 LaABCG5与其他植物ABCG5转运蛋白氨基酸序列的多重比对
Fig. 3 Alignment of amino acid sequences between LaABCG5 and ABCG5 transporters from other plants
2.3 LaABCG5的蛋白质结构和跨膜结构域预测
LaABCG5的蛋白质理化性质分析结果表明:LaABCG5的理论相对分子质量为70 451,理论等电点为pI 8.37。蛋白质二级结构预测结果显示:LaABCG5的氨基酸序列中α-螺旋有308个氨基酸,所占比例为48.81%;延伸链有85个氨基酸,所占比例为13.47%;β-转角有32个氨基酸,所占比例为5.07%;无规则卷曲有206个氨基酸,所占比例为32.65%。根据同源建模原理,PDB数据库中已存在的ABCG2与LaABCG5的氨基酸序列的同源性达到31.36%,预测结果较好。使用ABCG2的蛋白质结构作为模板,对LaABCG5的三级结构进行建模,结果见图4。
蛋白质跨膜结构域的分析结果(图5)显示:膜内氨基酸为1~385、442~461和519~524位,膜外氨基酸为409~418、482~495和548~612位,跨膜区域氨基酸为386~408、410~441、462~481、496~518、525~547和613~630位,表明LaABCG5是一个膜定位的蛋白,与转运蛋白的功能吻合。
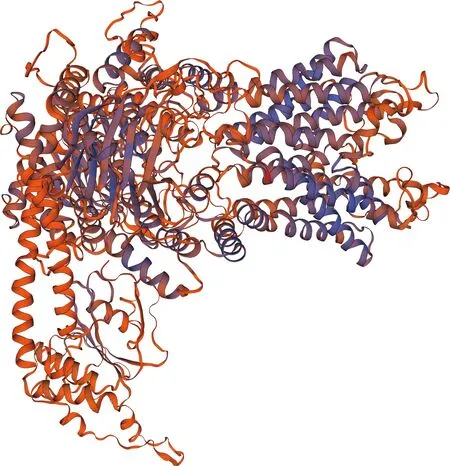
图4 LaABCG5的三级结构
Fig. 4 Tertiary structure of LaABCG5


图5 LaABCG5的跨膜结构域
Fig. 5 Transmembrane domain of LaABCG5
2.4 不同组织中LaABCG5基因的表达特性分析
结果(图6)显示:LaABCG5基因在忽地笑的根、鳞茎、叶片、花瓣和雌蕊中均有表达,其中,在叶片和雌蕊中相对表达量较高,显著高于其他组织,而在鳞茎中相对表达量最低。说明LaABCG5基因在忽地笑中有组织表达特异性。

图6 忽地笑不同组织中LaABCG5基因的相对表达量
Fig. 6 Relative expression ofLaABCG5gene from different tissues ofLycorisaurea(L’Hér.) Herb.
2.5 MeJA处理后LaABCG5基因的表达特性分析
结果(图7)显示:100 μmol·L-1MeJA处理后6 h,LaABCG5基因相对表达量为对照(DMSO处理后6 h)的8.16倍,二者间存在显著差异;100 μmol·L-1MeJA处理后12 h,LaABCG5基因的相对表达量均与对照(DMSO处理后12 h)无显著差异。

图7 MeJA处理后忽地笑叶片中LaABCG5基因的相对表达量
Fig. 7 Relative expression ofLaABCG5gene from leaf ofLycorisaurea(L’Hér.) Herb. after MeJA treatment
2.6 LaABCG5的亚细胞定位分析
通过在线软件WoLF PSORT预测分析,LaABCG5可能定位于细胞膜。为了进一步明确LaABCG5的功能及亚细胞定位,构建LaABCG5-GFP融合蛋白用于拟南芥原生质体表达,并通过激光扫描共聚焦显微镜进行观察,结果(图8)显示:LaABCG5-GFP融合蛋白在细胞膜上有明显的表达,且与共同转化表达的定位于细胞膜的PIP2A-mCherry标记蛋白有较好的重合。说明在亚细胞水平上,LaABCG5主要定位于细胞膜。

1: 表达LaABCG5-GFP(绿色)的原生质体A protoplast expressing LaABCG5-GFP (green); 2: 表达PIP2A-mCherry(红色)的原生质体A protoplast expressing PIP2A-mCherry (red); 3: 原生质体的叶绿素(蓝色)Chlorophyll (blue) of the protoplast; 4: 1、2和3的叠加图像Merged images of 1, 2, and 3; 5,6,7: 表达pAN580-GFP空载体的原生质体A protoplast expressing pAN580-GFP empty vector.
图8 LaABCG5的亚细胞定位
Fig. 8 Subcellular localization of LaABCG5
3 讨 论
植物生长过程中会产生各种用于减少胁迫和自我保护且不参与生长和发育的物质,称为次生代谢产物,常见的植物次生代谢产物包括萜类、生物碱、芥子油和糖类等[20]。许多次生代谢产物有较高的药用价值,如青蒿素、紫杉醇和小檗碱等[21]。次生代谢产物的合成和代谢长期以来一直备受关注,有关其转运和积累的运输过程也是研究人员的关注点之一。目前,植物中ABC转运蛋白被认为在次生代谢产物的运输转导过程中承担了重要的角色[22-24]。Chen等[25]定义了第1个ABC转运蛋白家庭成员是参与细胞的药物外排和促进多药耐药机制形成的多耐性(MDR, multidrug resistance)转运蛋白,将其归类于ABCB亚家族的一类转运蛋白。Shitan等[26]根据小檗碱主要特异性存储于日本黄连的根中,在日本黄连根中发现了有转运小檗碱功能的CjMDR1转运蛋白。已有研究结果显示:加兰他敏在忽地笑的花、鳞茎和叶片中含量较高[8],且在MeJA处理下中国石蒜(LycorischinensisTraub)中加兰他敏含量会显著增加[27]。作者在MeJA处理忽地笑比较转录组数据库中发掘到一个在MeJA处理下相对表达量升高的ABC转运蛋白基因,通过NCBI验证发现其与拟南芥中AtABCG5基因有较高的相似度,故命名为LaABCG5。LaABCG5基因全长1 896 bp,编码631个氨基酸。生物信息学分析结构显示:LaABCG5含有6个跨膜区域。qRT-PCR结果显示:LaABCG5基因在雌蕊和叶片中相对表达量较高,与加兰他敏的积累组织[8]部分重合;在100 μmol·L-1MeJA处理后6 h,LaABCG5基因的相对表达量较对照显著增加,与加兰他敏含量在MeJA处理后的变化[27]也吻合。在亚细胞水平上,LaABCG5定位于细胞膜。这些证据都体现了该基因的组织特异性和表达模式与其承担的功能有紧密联系。
Shitan等[15,26]研究认为,日本黄连中CjMDR1基因主要在其根状茎、叶柄和花中表达,而CjABCB2基因则相对集中在根状茎的木质部表达,二者组织定位不同,但是在不同的组织部位同样承担着小檗碱从胞外向胞内运输的转运功能,CjMDR1可能在小檗碱含量不高的组织中起到积累小檗碱的作用,而CjABCB2则与小檗碱由根到根状茎的长距离转运相关。韩小康等[28]的研究结果显示:MeJA处理后6 h,忽地笑LaABCG3基因的表达水平升高了近4倍。LaABCG3基因主要集中在花瓣和种子中表达[28],LaABCG5基因主要集中在雌蕊和叶片中表达,2个基因的组织定位有明显的差异,推测在其承担的功能上可能有较好的互补。王晓燕等[29]研究认为,在忽地笑不同器官中加兰他敏的亚细胞积累模式存在差异,这也暗示可能有多种转运蛋白在加兰他敏的转运过程中协同合作,共同完成。本研究新发现的LaABCG5为忽地笑体内次生代谢产物的跨膜转运和积累机制提供了候选研究对象,但其具体的转运功能仍待进一步深入研究。

