松褐天牛肠道微生物的分离与鉴定
谢谷艾,金明霞,喻爱林,涂业苟,阙生全,熊彩云,刘晓华,贺义昌
松褐天牛肠道微生物的分离与鉴定
谢谷艾1,2,金明霞2,3*,喻爱林2,涂业苟2,阙生全2,熊彩云2,刘晓华2,贺义昌1,2
(1. 江西农业大学 农学院,江西 南昌 330045;2. 江西省林业科学院,江西 南昌 330013;3. 南京林业大学 林学院,江苏 南京 210000)
松褐天牛又名松墨天牛,它不但能钻蛀松树,而且成虫还会传播对松树致命的病害——松材线虫病。松褐天牛被列为国际、国内检疫性害虫。松褐天牛身上所携带的松材线虫是我国南方马尾松等松树的重要危害源,其致病能力强、传播速度快、治理难度大。作为松褐天牛寄宿的主要对象——马尾松中缺乏氮素,所以其肠道中存在着能由其他渠道获取氮素的菌群。据研究肠道菌群在营养供给、消化及吸收上起到了至关重要的作用,并通过这种方式影响松褐天牛的生长发育。研究通过涂布法和划线法分离菌落,使用无氮培养基以及生理生化检测的方法,研究松褐天牛幼虫肠道微生物的种类。从因松材线虫病致死的马尾松树干中采集活体松褐天牛幼虫进行人工培养后解剖,将其肠道制成匀浆后利用Ashby无氮培养基筛选出天牛幼虫肠道中的固氮菌,分离纯化,并进行生理生化检测。试验结果与《伯杰细菌鉴定手册(中文第八版)》比照得出从松褐天牛幼虫肠道中提取的菌中有肠杆菌属(Hormaeche and Edwards, 1960)、气球菌属(Williams,Hitch and Cowan, 1953)、柠檬酸杆菌属(Werkman and Gillen, 1932)、固氮菌属()、埃希氏菌属(Castellani and Chalmers, 1919)、克雷伯氏菌属()、沙雷氏菌属(, 1823)、氮单胞菌属(Winogradsky, 1938)、爱德华氏菌属(Ewing and McWhorter,1965),通过研究松褐天牛肠道固氮微生物的菌属可有针对性的寻找抑制其活性的药剂以达到防治虫害的目的。此种方法具有专一、绿色等优点,在杀灭害虫的同时对其他动植物影响小。
松褐天牛;菌种筛选;肠道固氮菌;生理生化测试
松褐天牛又名松墨天牛(Hope)、松天牛,隶属于鞘翅目(Coleoptera),天牛科(Cerambyeidae),沟胫天牛亚科(Lamiinae),墨天牛属()[1]。广泛分布于我国各地,其集中分布于南方及西南方各省市[2]。松褐天牛成虫会啃食松树幼嫩的树枝和树皮,松褐天牛幼虫会钻蛀松树的树干,从而导致松树的枯萎。不仅如此,成年松褐天牛身上所携带松材线虫还会传播对松树致死的松材线虫病。有研宄表明携带松材线虫松褐天牛的比例高达30%[3]。松褐天牛和其传播的松材线虫病使得超过1.4×106株松树死亡,仅2005年发生面积就达7.7 hm2,严重威胁着我国林业的健康发展[4]。所以有效防治松褐天牛迫在眉睫。
为了寻求对松褐天牛的有效防治方法和措施,不同学者已从松褐天牛的生物学特性、生态学特征及其生理生化等多个角度开展研究[5]。随着技术发展,人们对生物肠道微生物的研究越来越多。研究表明肠道共生菌可为宿主提供营养、必须氨基酸和消化食物等方面起重要作用[6-7]。以往的研究结果为笔者了解肠道细菌和松褐天牛之间的关系提供了参考,但对于松褐天牛肠道内的固氮菌的研究还未见报道,对肠道固氮菌的研究不仅为开发新的害虫控制策略提供帮助,也为开发新的固氮微生物资源提供了可能。
日本学者最早对松褐天牛的生物学、生态学特性,发生规律进行过较深入研究[7]。有文献表明,我国境内越往东南部,其种群密度越大,越向西北,随海拔高度及纬度的增加松褐天牛的种群数量渐少[8]。松材线虫病从1982年在南京首次发现至今,疫区范围扩大到江苏、浙江和江西等14省区,累计致死松树5亿多株,毁灭松林超30万hm2,造成经济损失上千亿元,对生态安全构造严重威胁[9]。松褐天牛是以缺乏氮素营养的木材为食,是寡氮营养型昆虫,木材含氮量极低,一般为0.1%以下,碳氮比值约1 000∶1,而且,木头中大多数可用的氮主要以顽固的细胞壁结构糖蛋白形式存在,一些以生物碱的形式存在,仅有0.001%的可用氮以游离氨基酸形式存在。因此,限制性氮对松褐天牛来说是一个特别极端的营养障碍。松褐天牛的天敌防治主要是通过生物间食物链,利用捕食性、寄生性天敌和病原微生物进行有效控治[10]。近代以来,随着微生物生态学技术的日趋完善和发展,昆虫肠道菌群和肠道微生态系统的研究进入了一个崭新的阶段,对于以昆虫肠道微生态和肠道微生物研究为核心的害虫防控方法的探索也正在成为国内外研究的热点之一[11]。
1 材料与方法
1.1 天牛幼虫肠道菌解剖材料及试剂
试供天牛幼虫为劈开受感染的马尾松树干中采集,以松木屑进行饲养,实验前停止喂食12 h,使其排空肠道内食物残渣。
试剂:75%乙醇,去离子水,0.1 mol/L pH值7.0的磷酸盐缓冲液。
工具:超净工作台,体视显微镜,蜡盘,尖头镊子,50 mL烧杯,手术剪刀,昆虫针,研钵,无菌纱布,胶头滴管,1 500 μL微量离心管(均为同规格微量离心管),1 000 μL移液枪,200 μL移液枪。
1.2 肠道固氮菌生理生化测试材料及试剂
(1)革兰氏染色剂。甲液:结晶紫2 g溶于20 mL乙醇(95%);乙液:草酸铵0.8 g溶于80 mL去离子水;使用时将甲液与乙液充分混匀后染色。(2)革兰氏碘液。碘1 g;碘化钾2 g;去离子水300 mL,先将碘化钾溶于去离子水中然后再加入碘,用玻璃杯搅拌至碘完全溶解,贮存于棕色磨口试剂瓶中避光保存。(3)革兰氏复染剂。藏红O溶液(2.5%的藏红O 95%乙醇溶液)10 mL溶于100 mL去离子水中。(4)糖酵解试验。溴麝香草酚蓝0.2 g;1 mol/L氢氧化钠5 mL;去离子水95 mL。(5)硝酸盐还原试验。甲液:对氨基苯磺酸0.8 g;5 mol/L醋酸溶液100 mL。乙液:α-萘胺0.5 g;5 mol/L醋酸溶液100 mL。(6)M.R试验。将0.1 g甲基红溶于300 mL体积分数95%乙醇中,再加入200 mL去离子水。(7)V.P试验。0.3%肌酸,40%氢氧化钠溶液。(8)吲哚试验。对二甲基氨基苯甲醛1 g;乙醇95 mL;37%~38%浓盐酸20 mL;先将对二甲基氨基苯甲醛溶于乙醇中后缓慢加入浓盐酸,置于棕色试剂瓶中避光保存。
1.3 实验仪器
SW-CJ-2G净化工作台、KYC-1102C恒温培养摇床、GZX-9070MBE电热鼓风干燥箱、WH-2微型旋涡混合仪、SPX-150BⅢ生化培养箱、RGX-250E人工气候箱、BK-300生物显微镜、XTL-330体视显微镜、立式压力蒸汽灭菌锅、艾柯超纯水机和海尔特种冰箱。
1.4 菌种物理性质检测实验方法
1.4.1 松褐天牛幼虫解剖及肠道匀浆的制作 步骤:在超净工作台中将天牛幼虫用清水洗净后浸入75%乙醇中2~3 min以杀死幼虫,用去离子水清洗幼虫表面3遍。用手术剪沿着松褐天牛幼虫的体侧线小心剪开,并用昆虫针刺穿其头部使其固定在蜡盘上。在体视镜下用尖头镊子从幼虫肛门位置将幼虫表皮撕开并小心剥离其脂肪使消化道暴露,可用微量生理盐水冲洗幼虫肠道以洗去黏着在肠道上的脂肪,用尖头镊子小心将其肠道与其脂肪分离并从幼虫的头部和肛门处截断将完整的肠道取下。因注意在分离肠道与脂肪时不要将肠道从中间扯断。(1)匀浆液的制作:迅速将幼虫肠道完整取出置于研钵中滴入磷酸缓冲液进行研磨。(2)取匀浆液1 000 μL作为0号匀浆,迅速加入去离子水10倍梯度稀释至10-7备用,既得松褐天牛肠液。
1.4.2 肠道菌的分离与纯化 本实验使用的是Ashby培养基来筛选与培养肠道匀浆中有固氮作用的菌类。磷酸氢二钾0.2 g;碳酸钙5 g;七水合硫酸镁0.2 g;葡萄糖10 g;氯化钠0.2 g;二水合硫酸钙0.1 g;琼脂18 g;去离子水1 000 g将上述混合后调节pH至7.0±0.2,121 ℃高压蒸汽灭菌30 min(加热时需要不断搅拌碳酸钙防止糊底,灭菌取出培养基之后也要将碳酸钙摇匀)。在超净工作台中倒平板,每皿约20 mL培养基。
在超净工作台中用200 μL移液枪吸取10-1,10-3,10-5,10-7的肠道匀浆各100 μL于培养基上用玻璃涂布器涂布接种,每个浓度各2个平板置于人工气候箱中30 ℃倒置培养一周。待平板上长出菌落后在超净工作台中挑取表征各异的菌落在培养基平板上划线、纯化、培养,重复上述步骤直至平板中菌的形态为单菌落。将纯化后的菌落分别标号。
1.5 菌种生理生化测试
(1)氧化酶活性测试。试剂:盐酸二甲基对苯撑二胺。步骤:将滤纸剪成长条型置于洁净的培养皿中,滴加1%盐酸二甲基对苯撑二胺溶液使滤纸略湿润。用铂丝挑取少量纯化的单菌落涂抹在被试剂润湿的滤纸上,若在短时间内滤纸变红则为阳性反之则为阴性。
委员会调查中最有意义的发现之一来自对相对新的、未开发的数据集——三角测量台网畸变的分析。美国海岸与大地测量局的J.F.Hayes和A.L.Baldwin在震后15个月内复测了加州北部三角台网的大部分。他们的细致分析(Ⅰ卷,114~145页)证明了1868年海沃德断层地震和1906年地震都出现位移的证据。对于1906年地震,他们发现同震水平位移与圣安德烈斯断层大致平行,断层两侧的点朝相反的方向移动,与所观察到的右旋断错一致。他们进一步总结出,位移量随着离开断层的距离呈非线性方式减小,且断层附近减小最快(图2)。
(2)过氧化氢酶活性测试。试剂:3%过氧化氢。步骤:用1 000 μL移液枪向1.5 mL微量离心管中移1 000 μL的过氧化氢溶液,用铂丝蘸取少量菌落插入离心管中。若铂丝上出现气泡则为阳性反之为阴性。
(3)苯丙氨酸脱氨酶活性测试。培养基:酵母膏3 g;氯化钠5 g;磷酸氢二钠1 g;DL-苯丙氨酸2 g;琼脂12 g;去离子水1 000 mL,pH 7.0,121 ℃高压蒸汽灭菌10 min,倒试管斜面。试剂:10%氯化铁溶液。接种与培养:将菌种接种于试管斜面上置于人工气候箱中37 ℃培养8~24 h后测定。结果观察:用胶头滴管将氯化铁溶液滴加到斜面上,当斜面上溶液变为绿色时为阳性,即表明已经生成了苯丙酮酸,不变色则为阴性。
(4)鸟氨酸脱羧酶、赖氨酸脱羧酶、精氨酸双水解酶活性测试。培养基:蛋白胨5 g;葡萄糖1 g;0.2%溴麝香草酚蓝溶液12 mL;去离子水1 000 mL,调pH到6.8,每1 000 mL培养基中加入所需要测定的氨基酸5 g,所加的氨基酸需要先溶解于15%的氢氧化钠中。L-d 赖氨酸5 g+15%氢氧化钠溶液5 mL;L-d鸟氨酸5 g+15%氢氧化钠溶液6 mL;精氨酸5 g+15%氢氧化钠溶液5 mL。加入所测的氨基酸之后再次调pH至6.8,121 ℃高压蒸汽灭菌10 min。
接种与培养:用1 000 μL移液枪各吸取1 000 μL培养基分装于无菌的微量离心管中,用铂丝接种环接种。(36±1)℃培养18~24 h。结果观察:若培养基变为蓝色则说明氨基酸脱羧产生了碱性物质为阳性,若培养基变为黄色则说明无碱性物质产生,但葡萄糖分解产酸使溴麝香草酚蓝变黄为阴性。
(5)硝酸盐还原试验。培养基:蛋白胨1 g;葡萄糖0.2 g;0.2%溴麝香草酚蓝5.4 mL;去离子水200 mL调pH至7.4,121 ℃高压蒸汽灭菌10 min,每管4~5 mL分装于试管中。接种与培养:将测定菌接种于硝酸盐液体培养基中,(35±2)℃培养3 d。结果观察:取洁净的试管用1 000 μL移液枪取培养液与甲、乙液各1 000 μL加入试管中。若溶液出现红色、瑰红、棕红等颜色则表示亚硝酸盐存在,为硝酸盐还原阳性,若无红色出现则为阴性。
(6)吲哚产生试验。培养基:1%胰蛋白胨水溶液,调pH至7.4±0.2,115 ℃高压蒸汽灭菌30 min分装于试管中。接种与培养:28 ℃恒温培养2或3 d,当培养液长菌明显浑浊后,沿试管壁缓慢加入少量对二氨基甲基苯甲醛试剂。结果观察:若在溶液分层处出现红色则为阳性,无色则为阴性。若显色不明显可加入4~5滴乙醚后摇动,使乙醚分散于液体中萃取培养液中的吲哚后静置,待乙醚与培养液分层后用胶头滴管缓慢加入对二氨基甲基苯甲醛试剂。若培养液中有吲哚时,吲哚可被乙醚提取至上层,使显色反应更明显。
(7)M.R试验。培养基:蛋白胨1 g;葡萄糖1 g;磷酸氢二钾1 g;去离子水200 mL,调pH至7.0~7.2,115 ℃高压蒸汽灭菌30 min后分装于试管中。接种与培养:用接种环将试验菌接种于培养液中,(36±1)℃培养2~6 d。结果观察:在培养液中用胶头滴管滴加少量甲基红试剂,若培养液为红色则为阳性,黄色则为阴性。
(8)V.P试验。培养基,接种与培养:与M.R试验相同。结果观察:用移液枪取等量培养液与氢氧化钠溶液后加入少许肌酸,若培养液出现红色则为阳性,反之为阴性。
(9)明胶液化试验。培养基:蛋白胨2.5 g;牛肉膏1.5 g;明胶60 g;去离子水500 mL,调pH7.0~7.2 121 ℃高压蒸汽灭菌15 min,分装试管。接种与培养:取待试验菌穿刺接种于明胶斜面中,并留两支未接种的试管做空白对照。20 ℃人工气候箱中培养3~5 d。结果观察:如明胶表面长有菌落但是明胶表面无凹陷且为稳定的凝块则为阴性,反之为阳性(若明胶不凝结可以放入冰箱中降温使其凝结后取出)。
(10)糖酵解试验。本实验中所测试的糖类有:葡萄糖、蔗糖、乳糖、麦芽糖、阿拉伯糖、木糖、鼠李糖、海藻糖、棉籽糖、半乳糖。培养基:蛋白胨2 g;氯化钠5 g;磷酸氢二钾2 g;琼脂5 g;1%溴麝香草酚蓝溶液3 mL;所测糖类5 g(乳糖为7.5 g);去离子水500 mL。将蛋白胨、盐、琼脂、水先混匀,加热融化后加入所测糖类,调pH7.2±0.2,最后加入溴麝香草酚蓝溶液。121 ℃高压蒸汽灭菌15 min分装于试管中做高层。接种与培养:用接种针穿刺接种于高层中,每株菌做4组。35 ℃培养2 d观察结果。结果观察:若培养基中指示剂变黄产酸为阳性;培养基仍为蓝色则为阴性。
(11)醇类发酵试验。本实验中所测试的醇类有:甘露醇、山梨醇、肌醇。培养基及接种培养方法同糖类发酵。结果观测:若培养基中指示剂变黄则为阴性,培养基仍为蓝色则为阳性。
(12)淀粉水解试验。培养基:可溶性淀粉15 g;琼脂7.5 g;去离子水500 mL,121 ℃高压蒸汽灭菌20 min倒平板。接种与培养:用接种丝在挑取待测试菌落划线法接种,置于恒温培养箱中35 ℃培养2~5 d。结果观察:在平板上滴加革兰氏碘液使平板变为蓝黑色。若菌落周围出现透明圈则说明其有分解淀粉的能力,为阳性。若无透明圈出现则为阴性。
2 结果与分析
2.1 天牛肠道菌形态特征及革兰氏染色结果
2.1.1 肠道菌的物理性质 本次实验共解剖3批松褐天牛幼虫,分别制作肠道匀浆并采取划线分离法筛选菌株后纯化,并从其中挑选出9种形态、性状各异的菌落。从第一批天牛幼虫肠道中挑选出0、3、3’、5、5’这5支菌株,从第二批天牛幼虫肠道中挑选出5-a、5-b、5-b’这3支菌株,从第三批天牛幼虫肠道中挑选出3~这1支菌株,共9只菌株,分别标号1~9号便于记录,如图1所示。
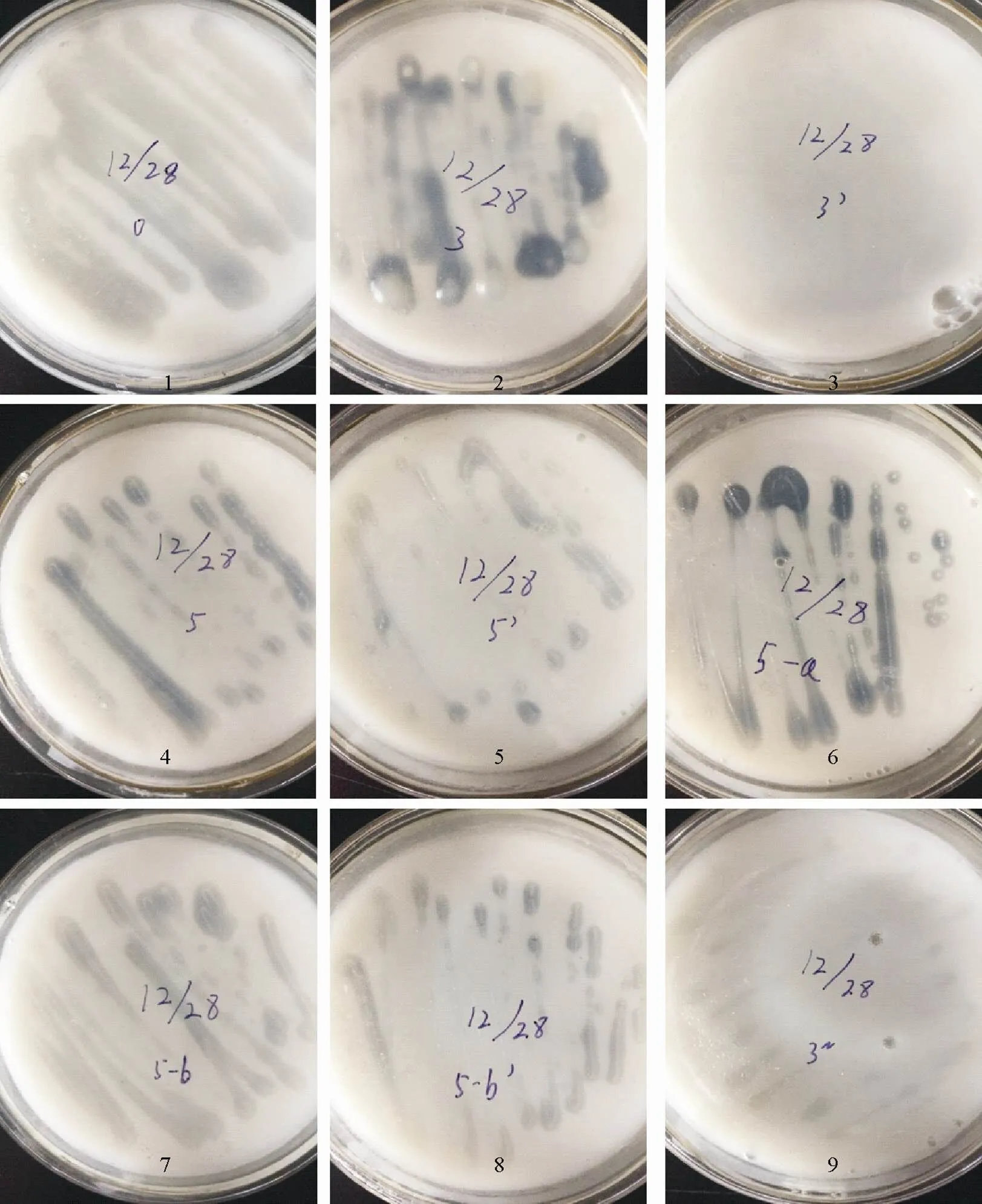
图1 天牛幼虫肠道菌菌形态观测结果
2.1.2 肠道菌革兰氏染色结果 将上述9支菌保存在28 ℃恒温培养箱中培养并批量接种,待纯化菌在培养皿上长出明显菌落时观察其形态特征,并做革兰氏染色。染色结果如图2。
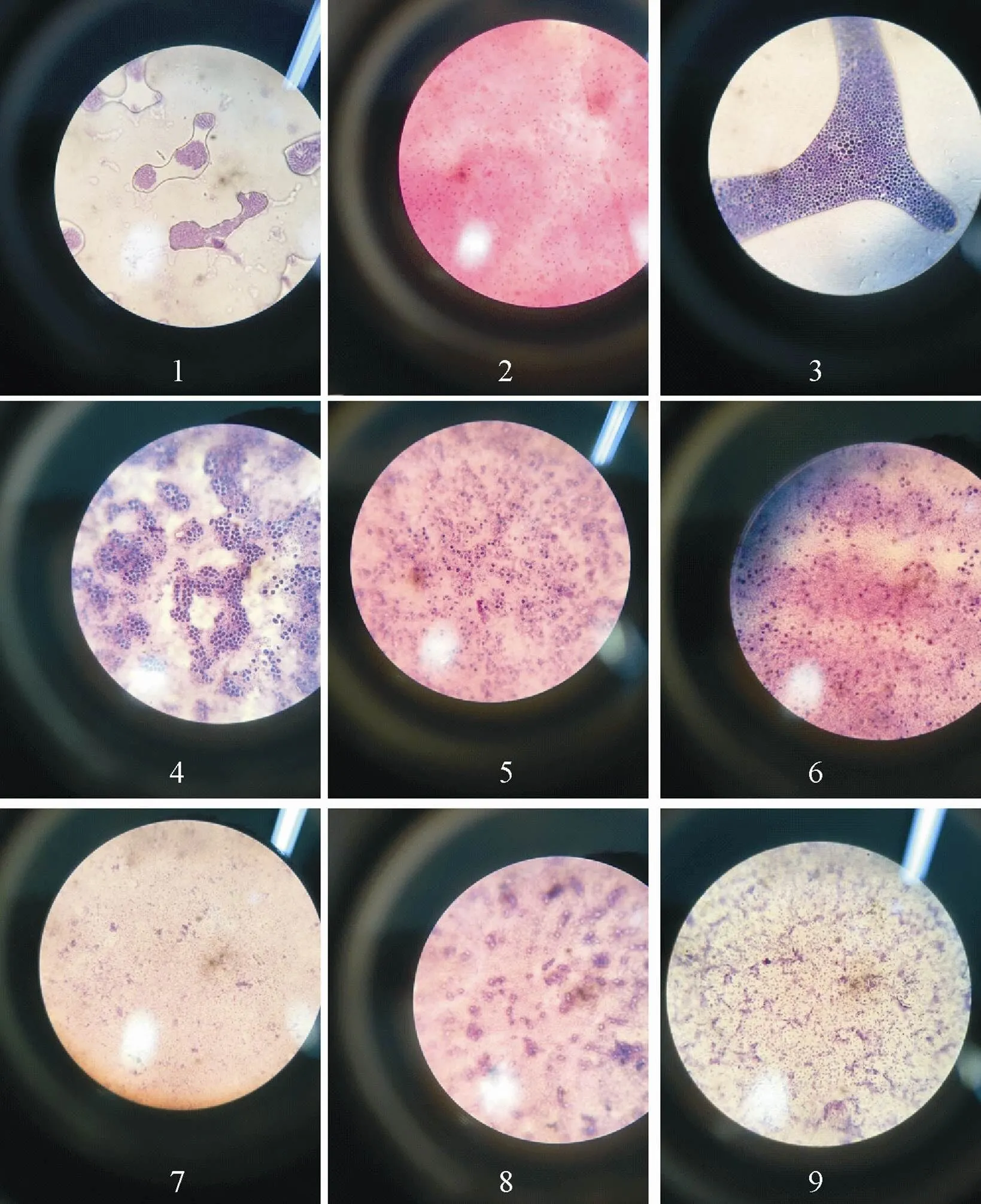
图2 天牛幼虫肠道菌的革兰氏染色检测结果
经宏观观测菌落形态特征及革兰氏染色后使用显微镜油镜观察后得到结果如表1所示。

表1 细菌形态特征及培养性状表
2.2 天牛肠道菌生理生化测试结果
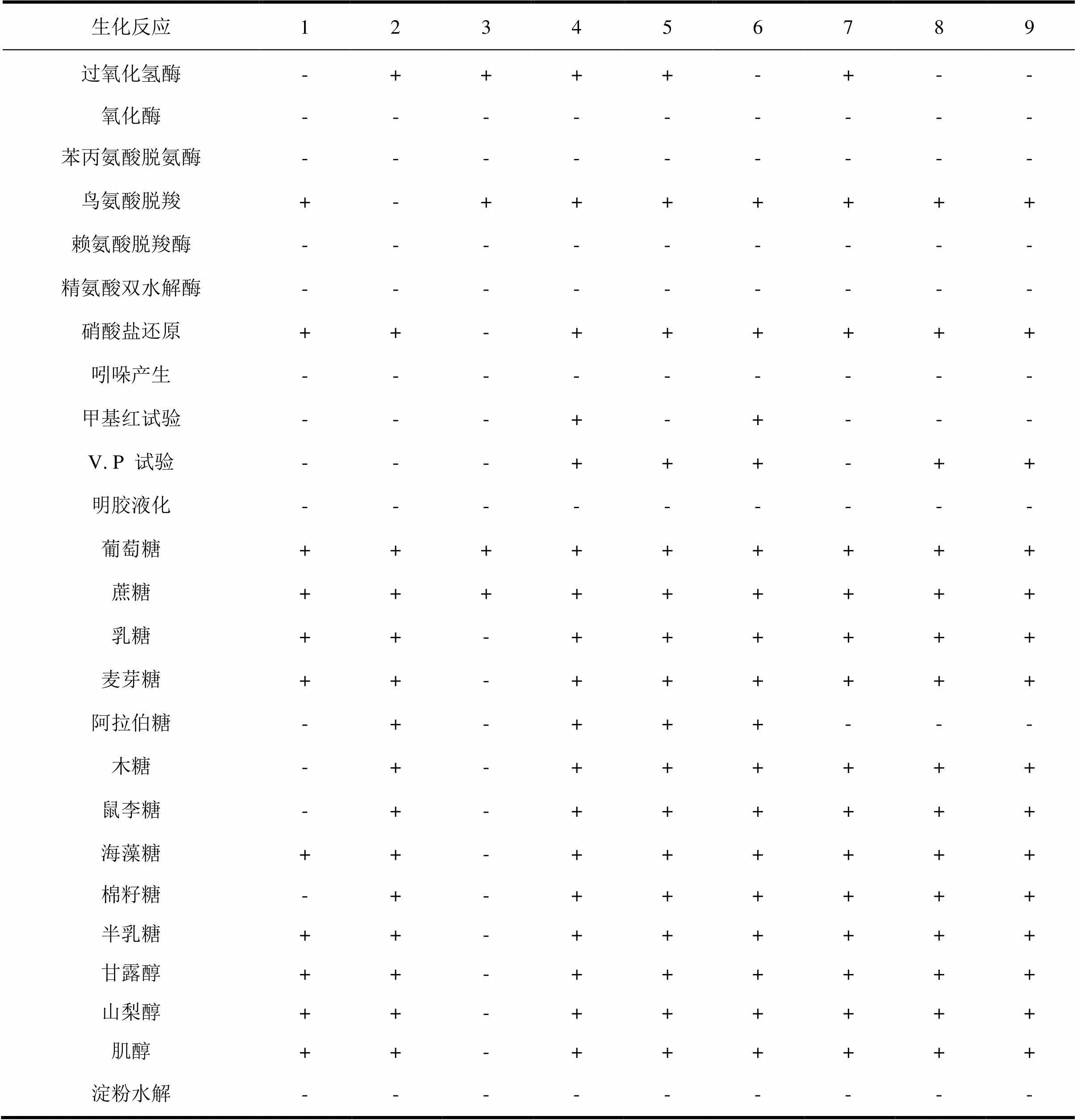
表2 松褐天牛肠道微生物生理生化测试结果
“+”: 阳性;“-”: 阴性
2.3 肠道菌鉴定结果
根据从松褐天牛幼虫肠道分离出固氮菌株的菌株性状、菌落形态、革兰氏染色、生理生化检测进行的实验结果。参照《常见细菌系统鉴定手册》[12]和《伯杰细菌鉴定手册》(第八版)[13]。将上述1~9号共计9个菌株分别鉴定为肠杆菌属(Hormaeche and Edwards, 1960)、气球菌属(, Hitch and Cowan, 1953)、柠檬酸杆菌属(Werkman and Gillen, 1932)、固氮菌属()、埃希氏菌属(Castellani and Chalmers, 1919)、克雷伯氏菌属()、沙雷氏菌属(,1823)、氮单胞菌属(Winogradsky, 1938)、爱德华氏菌属(Ewing and McWhorter, 1965)。
3 结论与讨论
3.1 结 论
在针对目前松木重要病虫害对象松褐天牛幼虫其肠道固氮微生物的研究,提出通过松褐天牛生长繁殖所必须依赖的肠道固氮菌群的特性从基因工程来找开口以寻求改造其肠道固氮菌群的特性来防治松褐天牛。
现研究结果如下:(1)本次实验培养的菌株在无氮培养基中无氮素,所以细菌在无氮培养基上生长只能通过固定空气中的氮气来提供生长繁殖所必须的氮素。(2)本研究通过研究松褐天牛幼虫肠道菌群,并全程使用Ashby培养基无氮培养基来筛选、培养从幼虫肠道中得到9支菌株。(3)通过单菌落形态、革兰氏染色以及生理生化测试鉴定结果为肠杆菌属(Hormaeche and Edwards, 1960)、气球菌属(Williams, Hitch and Cowan, 1953)、柠檬酸杆菌属(Werkman and Gillen, 1932)、固氮菌属()、埃希氏菌属(Castellani and Chalmers, 1919)、克雷伯氏菌属()、沙雷氏菌属(, 1823)、氮单胞菌属(Winogradsky, 1938)、爱德华氏菌属(Ewing and McWhorter, 1965)。这几种菌均和《伯杰细菌鉴定手册》(第八版)中描述大体一致。
3.2 讨 论
本次实验中从天牛幼虫肠道获得的菌株并不是一次性采集完全,而是分了3批不同时间段的天牛各5只,以消除个体差异。但3次采集的结果大体相同只有少数菌株存在差异,说明松褐天牛幼虫肠道中所存在的固氮菌是普遍存在的。
为排除无氮培养基中的菌是来自于松褐天牛幼虫肠道匀浆中,每次在分离与纯化过程中设置了一个空白对照皿并置于空气中暴露[15]。结果空白对照培养皿鲜有染菌,仅有的一次空白皿所染的也是霉菌,继续培养一周后并无出现细菌的菌落。
将所得的固氮菌从Ashby培养基中转移至普通的牛肉膏蛋白胨培养基中培养一周后发现部分固氮菌的形态特征发生了变化,接种回Ashby培养基后又变回原来的形态。推测可能是因为在牛肉膏蛋白胨培养基中有充足的氮素,所以该菌的其他形状得以表达。
[1] 宋红敏, 徐汝梅.松墨天牛的全球潜在分布区分析[J]. 昆虫知识, 2006, 43(4): 535-539.
[2] 萧刚柔. 中国森林昆虫[M]. 2版. 北京: 中国林业出版社, 1992: 483.
[3] 才琪, 阎合. 从黄山抵御疫情之措施思考我国松材线虫病防控策略[J]. 中国森林病虫, 2015, 34(2): 43-45.
[4] 泽桑梓, 闫争亮, 赵涛, 等. 我国松褐天牛防治及引诱技术研究的现状及前景分析[J]. 西部林业科学, 2010, 39(3): 93-97.
[5]Kishi Y. Pine wood nematode and the Japanese pine sawyer[M]. Thomas Company Limited, 1995.
[6] 傅慧静. 松墨天牛肠道细菌多样性和粘质沙雷氏菌木质素降解特性的研究[D]. 福州: 福建农林大学, 2017.
[7] 杨义婷, 郭建洋, 龙楚云, 等.昆虫内共生菌及其功能研究进展[J]. 昆虫学报, 2016, 57(1): 111-122.
[8] 孔维娜. 入侵种松材线虫的关键传媒-松墨天牛的耐寒性[D]. 晋中: 山西农业大学, 2005.
[9] 国家林业局公告, 2009年第3号[J]. 国家林业局公报, 2009(2): 13-19.
[10] 罗淋淋, 蔡紫玲, 林同. 松墨天牛的天敌生防利用研究进展[J]. 中国植保导刊, 2015 (2): 21-25.
[11] 袁秀洁. 桑天牛成虫肠道优势细菌菌群研究[D]. 保定: 河北农业大学, 2010.
[12] 朱诚棋, 王博, 沈婧, 等. 松墨天牛综合防治进展[J]. 中国植保导刊, 2017, 37(2): 19-24.
[13] 布坎南R E, 吉本斯N E. 伯杰氏细菌鉴定手册[M]. 8版. 北京: 科学出版社, 1984.
[14] Yu D, Huang X L, Zou C Y, et al. Isolation and identification of sinapine-degrading bacteria from the intestinal tract of laying hens[J]. Animal Nutrition, 2016(1): 61-66.
[15] 徐晓芬. 类芽孢杆菌BD3526在无氮固体培养基上产胞外多糖的研究[J]. 食品工业科技, 2017(16):101-106.
Isolation and Identification of Microbe in the Intestinal Tract of Pine Sawyer
XIE Gu-ai1,2, JIN Ming-xia2,3*, YU Ai-lin2, TU Ye-gou2, QUE Sheng-quan2, XIONG Cai-yun2, LIU Xiao-hua2, HE Yi-chang1,2
(1. College of Agronomy, Jiangxi Agricultural University, Nanchang 330045, China; 2. Jiangxi Academy of Forestry, Nanchang 330013, China; 3. College of Forestry, Nanjing Forestry University, Nanjing 210000, China)
Pine sawyer is also known as the pine inks. It can not only drill a pine tree, and its adults can also spread the deadly disease of pine trees, Pine wood nematode disease. So, it is listed as an international and domestic quarantine pest. Pine wood nematode carried onis an important source of damage to pine trees such asin the south of China. Its virulence is strong,with fast transmission speed, and so it is difficult to govern. The main object of the lodging of the pine brown beetles is the lack of nitrogen in, and so there are bacteria in the intestines that can fix nitrogen from the air. According to the study, intestinal flora has played a crucial role in the digestion and absorption of nutrient supply, and by this way influences’s development and health. Through isolation and culture with traditional identification methods, this article studied the species of intestinal microbes in the larva of. First, the larva ofwere collected from the trunk ofkilled by pine wood nematode disease and dissected after artificial culture. The nitrogen fixing bacteria in the intestines of the larva of the cattle were screened and purified by Ashby nitrogen free medium after making the homogenate of the intestine, and physiological and biochemical tests were carried out. Result references were Common bacterial system identification manual and Berger Bacterial Identification Manual (Eighth Chinese Edition). To achieve the purpose of determining the category to which it belonged, the manual test results and the identification of bacteria Berger (Eighth Edition) were used to get the following as, (Hormaeche and Edwards, 1960), and gas aureus (Williams, Hitch and Cowan, 1953),(Werkman and Gillen, 1932),genera (), Mr Bush’s bacteria (Castellani and Chalmers, 1919), and(), serratia (, 1823), nitrogen is a bacterium (Winogradsky, 1938), Edward's bacteria genera (Ewing and Mr McWhorter, 1965). By studying the bacteria of the nitrogen fixing microorganisms in the intestinal tract of the pine Brown sky, the bacteria could be targeted to find the agent to inhibit the activity of the bacteria in order to prevent and control the insect pests. This method had concentrated and organic advantages, and had little effect on other animals and plants while killing pests.
pine sawyer; strain screening; intestinal azotobacter; physiological and biochemical responses
S763.38
A
2095-3704(2020)01-0040-08
2020-01-10
江西省林业科学院青年人才培养项目(2017522501,2018521601)、江西省林业科技创新项目(201613)和江西省林业科学院重点项目(2016512501)
谢谷艾(1992—),男,助理研究员,博士生,主要从事森林保护研究,378269742@qq.com;*通信作者:金明霞,副研究员,博士生,370686315@qq.com。
谢谷艾, 金明霞, 喻爱林, 等. 松褐天牛肠道微生物的分离与鉴定[J]. 生物灾害科学, 2020, 43(1): 40-47.
10.3969/j.issn.2095-3704.2020.01.09

