乳酸对阴沟肠杆菌生物膜形成的抑制作用
刘亚文,靳盼盼,许晓曦*,刘 芳*,孙芝兰
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.青海湖肉业有限责任公司,青海 海南州 813000)
阴沟肠杆菌(Enterobacter cloacae)属革兰氏阴性菌,广泛存在于人和动物的粪便及肠道,此外在水、泥土和植物中也均可检出。虽然是肠道正常的菌种之一,但是作为条件致病菌,阴沟肠杆菌已经成为引发感染的主要致病菌。有资料表明该菌对鸡、猪等动物具有致病作用,引起以腹泻为主要症状的感染[1]。另外,在鸡肉胴体表面、龙虾制品、包装食品的表面、米粉等中也发现了阴沟肠杆菌[2-4]。目前研究发现,阴沟肠杆菌引起的细菌性疾病越来越难以根治的部分原因与生物膜的形成有关,因为被生物膜保护的细菌对杀菌剂(抗生素等)、宿主自身的免疫机制甚至是恶劣的环境都有很强的抵抗性。因此,生物膜内细菌所独有的生物学特点,使得抗生素治疗对其效果较差[5]。尤其是一些致病菌较易附着定植生成生物膜,使得灭菌过程非常缓慢[6]。更有研究表明,生物膜的形成使病变细胞的耐药性提高约10~1 000 倍[7],即使没有耐药基因的微生物,一旦生成生物膜,抗菌药物的治病性也会有很大程度的降低,但是当生物膜被人为破坏后,抗菌药物又可有效地作用于特定的微生物。
近年来,有机酸作为一种天然的有机化合物对食源性病原体的污染有显著作用,比如一定浓度的乳酸能有效清洗牛肉表面的致病菌[8],尽管有机酸被批准用于食物防腐剂,但其在实践中并没有被广泛接受。有研究表明,从植物中提取的莽草酸可破坏金黄色葡萄球菌的细胞膜进而显示出对其有效的抗菌活性[9]。银杏酸C15:1和C17:1能够显著抑制聚苯乙烯和玻璃表面上的大肠杆菌生物膜形成[10]。植物中所含精油和其有机提取物可以明显抑制细菌生物膜的形成[11-13]。此外,一些成分通过影响生物膜形成过程中的细菌黏附、胞外聚合物等成分和群体感应系统的生成[14-15]来抑制生物膜的生成。大蒜提取物、茶多酚、香芹酚等物质也不断被用于抑制生物膜的实验中,并取得预期效果。从国内外的相关报道来看,有关有机酸抑菌效果的研究较多,研究表明,低质量浓度的乳酸对大肠杆菌、金黄色葡萄球菌和蜡样芽孢杆菌的生长基本没有抑制;而当乳酸质量浓度超过0.9 mg/mL时则对这3 种菌有一定的抑制作用,其最小抑菌浓度(minimal inhibitory concentration,MIC)分别为0.9、1.8、3.6 mg/mL[16]。相对而言,有关有机酸对细菌生物膜抑菌效果的研究较少。本实验以阴沟肠杆菌为目标菌株,研究乳酸对该菌生物膜的抑制效果,为冷鲜肉的抑菌防腐技术提供新思路和理论参考。
1 材料与方法
1.1 菌株与材料
阴沟肠杆菌(E. cloacae CY4)为江苏省农业科学院畜禽加工研究室从新鲜羊肉中分离并保存。
胰蛋白胨大豆肉汤(tryptic soy broth,TSB)北京陆桥技术责任有限公司;苯乳酸 美国Sigma-Aldrich公司;乳酸 天津市科密欧化学试剂有限公司;柠檬酸西陇化工股份有限公司。
1.2 仪器与设备
PE(Ultra View VOX)转盘式激光共聚焦显微镜(confocal laser scanning microscope,CLSM) 美国珀金埃尔默股份有限公司;EVO-LS10扫描电子显微镜(scanning electron microscope,SEM) 德国卡尔蔡司股份公司;Bio Photo meter plus核酸蛋白测定仪 德国艾本德股份公司;酶标仪 美国BioTek Instruments有限公司;Czone系列抑菌圈测量及菌落计数仪 杭州迅数科技有限公司。
1.3 方法
1.3.1 菌种分离及培养
将分离得到的阴沟肠杆菌CY4接种于新鲜无菌的TSB中,振荡培养至对数期,在TSB琼脂平板培养基上划线并过夜培养,挑取典型的单菌落接种至新鲜的TSB液体培养基继续培养至对数期,重复实验3 次。将菌液与体积分数50%的无菌甘油以1∶1的体积比混合均匀,置于-40 ℃冷冻保存。活化时只需将冻存的菌液解冻,然后按1%接种量接种于无菌TSB液体培养基,37 ℃、200 r/min振荡培养12 h待用。
1.3.2 乳酸对阴沟肠杆菌CY4的MIC的测定
按照二倍稀释法测定乳酸对阴沟肠杆菌CY4的MIC,将过夜活化好的阴沟肠杆菌CY4菌液按1%接种量接种到10 mL TSB液体培养基内并加入适量乳酸(根据乳酸的质量浓度计算出接种到一定体积培养基所需的乳酸体积),使得乳酸的最终质量浓度分别为10、5、2.50、1.25、0.625、0(对照组)mg/mL,37 ℃培养24 h。取每个梯度的菌液在600 nm波长处测定其光密度值,以能抑制阴沟肠杆菌CY4生长的最低乳酸质量浓度为MIC。
1.3.3 乳酸对阴沟肠杆菌CY4生长的影响
将过夜活化好的阴沟肠杆菌CY4菌液按1%接种量接种到5 mL TSB液体培养基内并加入适量乳酸,使得菌液中乳酸终质量浓度依次为5、2.50、1.25、0.625 mg/mL。在37 ℃、200 r/min下恒温振荡培养24 h,根据预实验结果分别取2、4、5、6、12、24 h样品菌液200 μL,测定其在600 nm波长处的光密度值并绘制菌体在不同条件下的生长曲线,分析不同质量浓度乳酸对CY4菌株生长的影响。
1.3.4 乳酸对阴沟肠杆菌CY4泳动能力的影响
采用软琼脂平板法[17-19]测定阴沟肠杆菌CY4的泳动能力。Swimming固体培养基含有1%(质量分数,后同)胰蛋白胨、0.5%氯化钠、0.25%葡萄糖和0.3%琼脂。Swarming固体培养基含有2.50% LB培养基、0.05%葡萄糖和0.5%琼脂。在以上培养基中分别加入适量乳酸(终质量浓度分别为1/2、1/4、1/8 MIC)。将CY4菌置于TSB液体培养基中培养至对数期,离心并去除上清液,用0.01 mol/L磷酸盐缓冲液(phosphate buffered saline,PBS)(pH 7.4)重悬菌体,调节菌悬液的OD600nm至0.8~1.0之间。在每个固体培养基表面中心滴加3 μL菌悬液,分别在37 ℃下静置培养8、20 h,利用Czone系列抑菌圈测量及菌落计数仪拍照并测定扩散菌圈的直径。
1.3.5 乳酸对阴沟肠杆菌CY4生物膜形成的影响
1.3.5.1 阴沟肠杆菌成膜能力的测定
按1.3.3节方法制备含不同质量浓度乳酸的CY4菌液(乳酸的质量浓度分别为1/2、1/4、1/8 MIC),混匀加入96 孔细胞培养板中,分别在12、24、48、72 h取样处理。吸除上层培养基并用PBS洗涤,晾干加入质量分数0.1%的结晶紫染液静置染色30 min。吸除染液之后再次使用无菌PBS洗涤3 次,用体积分数95%的乙醇溶液脱色30 min,570 nm波长处测定其光密度值。
1.3.5.2 生物膜胞外多糖质量浓度的测定
按1.3.3节方法制备含不同质量浓度乳酸的各梯度菌液(乳酸质量浓度分别为1/2、1/4、1/8 MIC),混匀加入24 孔细胞培养板中,分别在12、24、48、72 h取样处理。吸除上层培养基,无菌PBS洗涤3 次,然后加入1 mL的无菌PBS,连同孔壁和孔底黏附的菌体一起转移于10 mL离心管中,6 000 r/min离心30 min,取上清液[20]。使用苯酚-硫酸法[21]测生物膜的胞外多糖质量浓度,取上清液1 mL,加入0.5 mL体积分数9%的苯酚溶液,加5 mL浓硫酸,100 ℃水浴15 min,冷却至室温测吸光度,对比生长曲线得多糖质量浓度。
1.3.6 乳酸对阴沟肠杆菌CY4生物膜微观形态的影响
1.3.6.1 CLSM观察
按1.3.3节方法制备含不同质量浓度乳酸的各梯度菌液(乳酸的质量浓度分别为1/2、1/4 MIC),混匀加入到Nunc™ Lab-Tek™ 8 孔腔室载玻片中,培养48 h后取样处理。吸除上层培养基并用无菌PBS洗涤,晾干后加入染液避光染色30 min。使用LIVE/DEAD Bac Light™试剂盒对CY4生成的生物膜进行染色,染液现配现用并避光保存。吸除染液后洗净并室温晾干,加入体积分数2.5%的戊二醛溶液固定30 min,然后晾干移除上层隔板,并滴加BacLight™ Mounting Oil,-20 ℃避光保存,用于CLSM观察[22]。显微镜观察选取60 倍油镜。
1.3.6.2 SEM观察
按1.3.3方法制备含不同质量浓度乳酸的各梯度菌液(乳酸的质量浓度分别为1/2、1/4 MIC),混匀加入到Nunc™ Lab-Tek™ 8 孔腔室载玻片中,48 h取样处理。吸除培养基用无菌PBS洗涤并室温晾干,加入体积分数2.5%戊二醛溶液固定后晾干。移除隔板后用体积分数1%的锇酸溶液固定90 min。接下来用乙醇梯度脱水[23],再使用体积分数100%叔丁醇洗涤。将处理完成的载玻片进行喷金处理用于SEM观察,拍照时选取放大倍数为2 000 倍和5 000 倍[24]。
1.3.7 乳酸对阴沟肠杆菌CY4生物膜菌体内相关基因表达量的影响
按1.3.3节方法制备含不同质量浓度乳酸的各梯度菌液(乳酸的质量浓度分别为1/2、1/4 MIC),37 ℃恒温振荡培养12~24 h,离心吸除上层培养基,加入1 mL无菌PBS,再次离心收集菌泥。按照RNA prep Pure培养细胞/细菌总RNA提取试剂盒的步骤说明提取菌体的总RNA,接下来立即去除DNA并反转录为cDNA。表1为实时荧光定量聚合酶链式反应(polymerase chain reaction,PCR)实验的引物,反应体系共20 μL,其中SYBR Premix ExTaqⅡ 10 μL、引物2 μL、cDNA 3 μL、RNase Free dH2O 5 μL。目标基因的相对表达采用2-ΔΔCt法评估,ΔΔCt=Ct处理组(Ct目标基因-Ct管家基因)-Ct对照组(Ct目标基因-Ct管家基因),以log2(2-ΔΔCt)>1或log2(2-ΔΔCt)<-1作为基因高表达的评价标准。
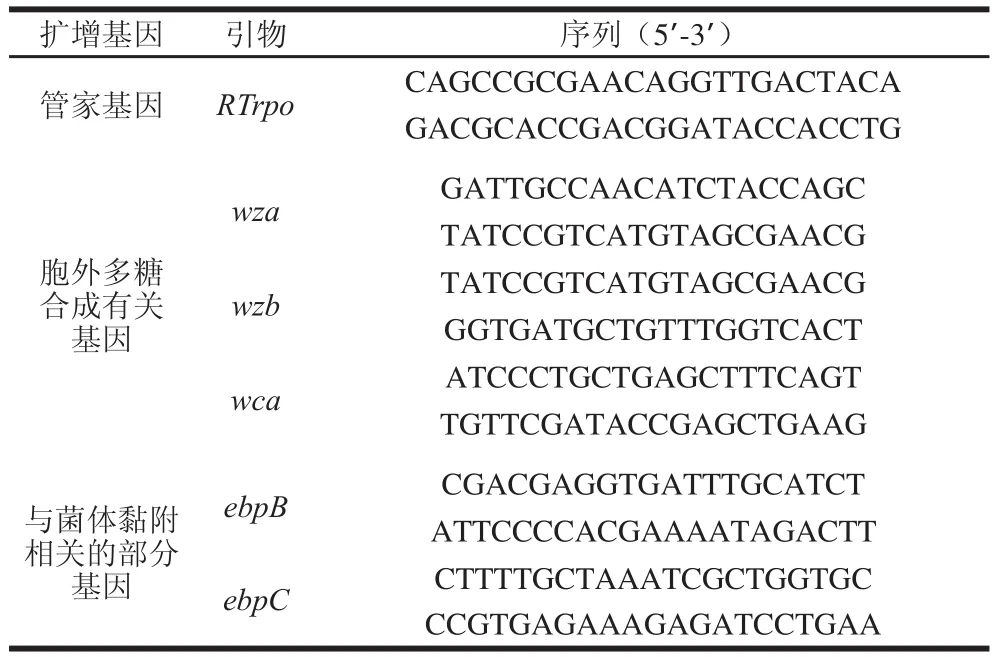
表1 实时荧光定量PCR引物序列Table 1 Primer sequences used for real-time PCR
1.4 数据统计与分析
每个指标重复实验3 次,两个平行。测定结果以平均值±标准差表示,采用Excel软件、SPSS 17.0软件和Statistix 8软件进行数据分析和制图。显著性水平设置为P<0.05(采用Tukey HSD显著性分析方法)。
2 结果与分析
2.1 乳酸对阴沟肠杆菌CY4生长的影响

图1 不同乳酸质量浓度下阴沟肠杆菌CY4生长曲线Fig. 1 Growth curves of Enterobacter cloacae CY4 in the presence of different lactic acid concentrations
根据对阴沟肠杆菌CY4菌液浑浊度及OD600nm的检测,可确定乳酸对阴沟肠杆菌CY4的MIC为5 mg/mL。由图1可知,在乳酸质量浓度达到5 mg/mL时,阴沟肠杆菌CY4的生长完全被抑制;当乳酸质量浓度为2.50 mg/mL时,CY4的生长较对照组有轻微的抑制;而当乳酸质量浓度为1.25 mg/mL和0.625 mg/mL时,可以看出其对CY4的处理结果和对照组相比无明显的抑制现象,基本和对照组的生长曲线重合。即在质量浓度为1.25 mg/mL和0.625 mg/mL时,经乳酸处理的菌株CY4的最大生长量与对照组基本一致,因此接下来研究几个亚抑菌浓度(2.50、1.25、0.625 mg/mL)的乳酸对菌株CY4生物膜的抑制作用。有研究表明,当没食子酸质量浓度大于8 mg/mL时会影响大肠杆菌和变形链球菌的生长,而低质量浓度的没食子酸对生物膜的抑制作用可能与除抗菌作用外的其他因素有关[25]。0.5 mg/mL的莽草酸只对金黄色葡萄球菌的生物膜有作用而对菌体的浮游生长没有显著干扰[18]。
2.2 乳酸对阴沟肠杆菌CY4泳动能力的影响
由图2A可知,经乳酸处理菌株的泳动范围相对于对照组而言明显缩小,在Swimming平板中,随着质量浓度的增大,菌圈一直在缩小(图2A2~A4),甚至在质量浓度为2.50 mg/mL时,菌圈不仅是处理组中直径最小的,颜色也非常淡;而在Swarming平板中,经过20 h的培养,对照组菌株的泳动范围明显较其他处理组的大,而随着处理质量浓度的增大,其菌圈直径也在不断缩小(图2A5~A8)。由图2B可知,乳酸的处理对阴沟肠杆菌CY4泳动能力(Swarming和Swimming)有明显的抑制作用,且随着质量浓度的升高,菌圈直径越来越小,不同质量浓度之间也存在显著性差异(P<0.05)。研究发现,菌体的运动性与细胞的初期黏附和生物膜形成有关,比如没食子酸和阿魏酸抑制了金黄色葡萄球菌的菌株运动并影响其生物膜的形成,也就是说有些有机酸可以通过降低菌体的运动性来减少生物膜的形成量[26]。在本实验中由于鞭毛的泳动能力对菌株早期的黏附聚集形成生物膜有很大的影响,因此乳酸很有可能通过抑制阴沟肠杆菌的运动对菌株早期的黏附能力产生影响,并抑制菌落聚集形成生物膜。
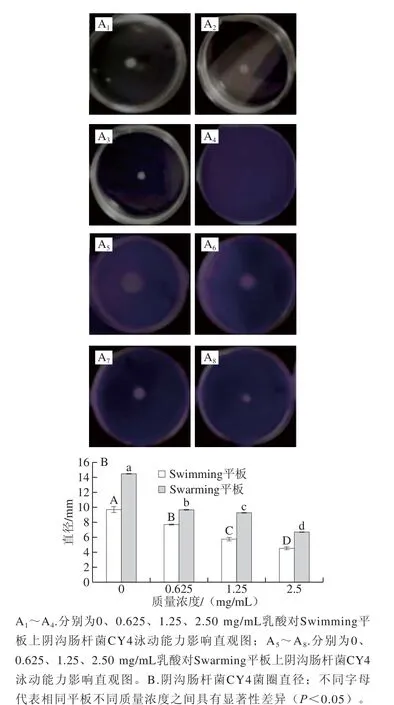
图2 乳酸对阴沟肠杆菌CY4泳动能力的抑制作用Fig. 2 Lactic acid inhibited swimming and swarming motilities of Enterobacter cloacae CY4
2.3 乳酸对阴沟肠杆菌CY4生物膜形成的影响
2.3.1 阴沟肠杆菌的成膜能力
生物膜的胞外聚合物中含有大量糖分,结晶紫作为一种碱性染料,易与多糖物质及核酸结合,因此根据结晶紫染色后的颜色深浅及光密度值的变化可以推测菌株成膜能力的强弱[27]。

图3 乳酸对阴沟肠杆菌CY4生物膜成膜能力的影响Fig. 3 Effect of lactic acid on biofilm formation of Enterobacter cloacae CY4
由图3A可知,以12 h的结晶紫染色孔板为例,不同质量浓度乳酸处理的阴沟肠杆菌生物膜在颜色上有明显不同,随着乳酸质量浓度的升高,染色程度越浅。如图3B所示,通过对不同处理时间在570 nm波长处测得的光密度值可知,12 h时,各乳酸处理组均与对照组有显著差异(P<0.05),且不同质量浓度乳酸处理组之间也都存在显著性差异(P<0.05);而在长时间的培养条件下,0.625 mg/mL乳酸处理组与对照组相比无显著性差异(P>0.05),1.25、2.50 mg/mL的乳酸仍可显著抑制菌株的成膜能力(P<0.05)。
乳酸处理极大地影响了阴沟肠杆菌生物膜的成膜能力,其影响程度可能与生物膜的成熟程度有关。现有研究表明,有机酸具有抗菌膜活性。如柠檬酸对从原料乳中分离出的金黄色葡萄球菌菌株形成的生物膜具有显著抑制作用[28],莽草酸对金黄色葡萄球菌形成的生物膜有显著影响,没食子酸和绿原酸对金黄色葡萄球菌的生物膜形成和代谢活性也有明显的抑制作用[29]。
2.3.2 生物膜胞外多糖质量浓度
胞外多糖是细菌生物膜结构的基础,与生物膜的合成及抗生素抗性的形成有着较强关联[30],因此,通过对细菌胞外多糖合成的抑制可达到阻碍生物膜的形成的目的。通过苯酚-硫酸法得到多糖标准曲线,测得多糖质量浓度与吸光度的线性关系方程为y=0.006 8x+0.000 7(r2=0.99),用于计算多糖质量浓度。

图4 乳酸对阴沟肠杆菌CY4 生物膜胞外多糖合成的影响Fig. 4 Effect of lactic acid on extracellular polysaccharide production in Enterobacter cloacae CY4 biofilm
由图4可知,乳酸处理相对于对照组有显著性差异(P<0.05),且随着处理时间的延长,多糖质量浓度也在不断增加,对照组和较高乳酸质量浓度处理组在48 h达到最高合成量,而较低乳酸质量浓度处理组在72 h仍略有增长。综上,在72 h的培养过程中,乳酸处理可明显抑制多糖的合成。
2.4 乳酸对阴沟肠杆菌CY4生物膜微观形态的影响
2.4.1 CLSM观察结果

图5 乳酸对阴沟肠杆菌CY4生物膜成膜厚度的影响Fig. 5 Effect of lactic acid on the thickness of Enterobacter cloacae CY4 biofilm
CLSM可在一定程度上反映成膜厚度的变化[31]。由图5可知,在48 h时,有机酸的处理明显地对菌体生物膜厚度产生了影响。由图5A可知,对照组培养的生物膜结构厚重且紧密平整,整体呈现绿色,但仍可见部分受损细胞表现为红色。通过对比2.50 mg/mL(图5B)和1.25 mg/mL(图5C)乳酸处理组可知,经过乳酸处理的生物膜厚度明显变薄,且随着质量浓度的升高,生物膜的厚度随之变薄。这一结果表明,乳酸在很大程度上影响了生物膜胞外物质的含量,也就是说,有机酸处理可以使得菌株生长所产生的具有保护机制的生物膜有效减少,有利于进一步的灭菌保鲜操作。
2.4.2 SEM观察结果
由图6可知,在48 h时,乳酸处理明显对菌体的外在聚集状态产生了影响。对于对照组(图6A)来说,菌体形成了明显的聚集形状且表面较紧密,菌体呈现出大小一致的圆杆状,菌体表面可明显看到有很厚的附着物包裹。乳酸处理组SEM观察结果如图6B、C所示,菌体明显呈现散乱无章的状态,细胞层数较对照组变少,且不能形成规则紧密的聚集团,表面空隙较多,乳酸的处理可能对细菌结构产生致变作用,使得菌体之间长短不一且表面凹凸不平,菌体之间连接不紧密,高质量浓度的处理使样品之间的空隙变得更大。

图6 乳酸对阴沟肠杆菌CY4生物膜菌体聚集状态的影响Fig. 6 Effect of lactic acid on cell aggregation in Enterobacter cloacae CY4 biofilm
由图6可以明显看出乳酸处理的阴沟肠杆菌生物膜形成的完整性情况,证实了乳酸具有抗菌膜活性。未经处理的对照组生物膜表面有明显的附着物包裹,并形成较厚的聚集体,相对而言,经乳酸处理的生物膜出现明显的单层和结构松散现象,随着乳酸质量浓度的增大,菌体表面的附着物也在明显地减少,菌体越来越清晰且相互之间的黏连减少(图6B、C)。此外,部分菌株受损变形,长短不一。这一现象和先前的研究相符合:目前市场上的很多抗生素制剂也能够对结构复杂的生物膜有一定的破坏作用并有可能使菌落结构松散[24]。
2.5 乳酸对阴沟肠杆菌CY4生物膜菌体内相关基因表达量的影响
由图7可知,乳酸对阴沟肠杆菌CY4生物膜菌体内相关基因表达量有显著影响。经乳酸处理的生物膜菌体中的相关基因表达量明显地较对照组菌体中的基因表达量低(log2(2-ΔΔCt)<-1)。其中ebpB、ebpC是生物膜黏附相关基因,wza、wzb、wca是与胞外多糖合成相关基因。以log2(2-ΔΔCt)>1或log2(2-ΔΔCt)<-1作为基因高表达的评价标准,如图7所示,2.50 mg/mL和1.25 mg/mL的乳酸处理均显著下调了阴沟肠杆菌CY4内相关基因的表达量。相关基因表达量的下调也进一步说明了乳酸的处理影响了多糖物质的合成及分泌,致使细菌的黏附聚集和扩散能力下降,因此抑制了生物膜的生成。

图7 阴沟肠杆菌CY4生物膜内菌体细胞相关基因表达量变化Fig. 7 Changes in relative expression levels of biofilm-related genes in Enterobacter cloacae CY4
3 结 论
近年来,由于人们对于食品安全问题的关注,生物膜抑制的有关研究也越来越深入,抑制物的选择越来越趋向于天然、安全、抑菌效果强的物质。本实验选取乳酸对阴沟肠杆菌CY4形成的生物膜进行研究。通过结晶紫染色实验发现亚抑菌浓度下的乳酸处理对CY4生物膜的形成有明显的抑制作用;CLSM和SEM观察发现乳酸处理使细菌生物膜的厚度大幅降低、结构松散、表面孔洞较多且不平滑,菌株表面附着物大幅减少;菌体泳动能力实验和胞外多糖质量浓度检测结果说明乳酸处理影响了菌体黏附和多糖合成能力;实时荧光定量PCR结果进一步证实了乳酸降低了菌体内与黏附和多糖产生相关基因的转录水平。本研究表明,亚抑菌浓度下的乳酸通过抑制多糖物质的合成及分泌、降低菌体的黏附聚集能力来抑制阴沟肠杆菌CY4生物膜的形成。

