壳寡糖胍对胰岛素抵抗及相关蛋白的作用
王园园,刘晓非,邹雅露,张 海,郑淇方,赵励彦,吴蕴棠
壳寡糖胍对胰岛素抵抗及相关蛋白的作用
王园园1,刘晓非1,邹雅露1,张 海1,郑淇方1,赵励彦1,吴蕴棠2
(1. 天津大学材料科学与工程学院,天津 300072;2. 天津医科大学公共卫生学院,天津 300072)
针对壳寡糖胍(COSG)对动物体内胰岛素抵抗治疗效果及相关机制尚不明确的问题,建立高脂高糖饮食联合链脲佐菌素诱导的2型糖尿病(T2DM)大鼠模型,并进行COSG灌胃给药治疗8周,研究COSG对T2DM大鼠体内胰岛素抵抗及相关信号通路的影响.结果显示,COSG可明显降低T2DM大鼠血清中总胆固醇(TC)、甘油三酯(TG)和低密度脂蛋白(LDL)水平并提高血清中高密度脂蛋白(HDL)水平;此外,COSG可下调T2DM大鼠的空腹血糖(FBG)和空腹胰岛素(FINS)含量,并减小T2DM大鼠胰岛素抵抗指数(HOMA-IR).进一步研究相关蛋白发现,COSG可抑制骨骼肌中p38 丝裂原活化蛋白激酶(p38MAPK)的磷酸化以及提高胰岛素受体底物-1(IRS-1)酪氨酸位点的磷酸化,并提高蛋白激酶B(AKT)的磷酸化水平和促进葡萄糖转运蛋白4(GLUT4)转移至细胞膜,从而促进细胞对葡萄糖的摄取;另外,COSG还可以降低磷酸烯醇式丙酮酸羧激酶(PEPCK)和肌糖原水平,进而抑制糖异生.从而,COSG达到改善胰岛素抵抗的作用.总之,COSG可改善T2DM大鼠胰岛素抵抗,具有良好的应用前景.
壳寡糖胍;2型糖尿病;胰岛素抵抗;葡萄糖转运蛋白4;胰岛素信号蛋白
2型糖尿病(T2DM)主要特征为胰岛素抵抗,骨骼肌是胰岛素抵抗发生的主要器官[1].人体内约80%由胰岛素介导的葡萄糖转运和利用是由骨骼肌完成的[2],因此,促进骨骼肌细胞葡萄糖代谢能够有效增强机体组织对胰岛素的敏感性[3].
葡萄糖转运蛋白4(GLUT4)在骨骼肌组织中高度表达,并与体内胰岛素抵抗密切相关[4].在胰岛素信号作用下,葡萄糖转运蛋白4可从细胞内转移至细胞膜上,促进细胞摄取葡萄糖[5].研究表明,GLUT4相关信号通路主要有胰岛素受体底物1(IRS-1)/磷脂酰肌醇-3-激酶(PI3K)/蛋白激酶B(AKT)途径和p38促分裂原活化蛋白激酶(p38MAPK)途径[6].研究表明上述两条途径的激活可增强GLUT4介导的葡萄糖摄取,改善2型糖尿病胰岛素抵抗[7].
对于T2DM的治疗,目前广泛采用双胍类药物二甲双胍(Met),但长期服用会产生一些副作用,例如对肠道的刺激性和偶见乳酸性酸中毒等[8-9].因此,本研究采用了具有降糖作用的天然药物壳寡糖(COS)[10],将Met引入COS中制备壳寡糖胍(COSG).前期研究结果显示,GOSG具有比Met更好的调节血糖效果且对肠道的刺激性较低[11-12],并且COSG在体外胰岛素抵抗L6骨骼肌细胞模型中显著地促进了细胞对葡萄糖的摄取[11].但是,COSG对动物体内胰岛素抵抗治疗效果及相关机制尚不明确.
因此,本研究通过建立高脂高糖饮食联合链脲佐菌素(STZ)诱导的T2DM模型,以Met和COS为对照,研究COSG对T2DM大鼠体内胰岛素抵抗的治疗作用.此外,还测定了COSG对骨骼肌中p38MAPK、IRS1、Akt和GLUT4蛋白表达以及PEPCK和肌糖原含量的影响,以探究COSG改善胰岛素抵抗的可能机制.
1 实验材料与方法
1.1 试剂和材料
COS(重均分子量1500g/mol,脱乙酰度93%),购自山东青岛医学研究所.双氰胺,由中国上海阿拉丁化学公司提供.乙醇和浓盐酸(37%,质量分数),购自中国天津江天化学技术有限公司.二甲双胍(Met)和考马斯亮蓝蛋白测定试剂盒,由中国南京建城生物技术研究所提供.β-actin,购自中国北京中山金桥.其他试剂均为分析纯,购自中国天津市第三化学试剂厂.
1.2 壳寡糖胍的合成和表征
图1为壳寡糖胍的合成路线.首先取20g重均分子量1500g/mol的COS加入四口烧瓶中,向四口烧瓶中加入70mL 0.2mol/L的盐酸溶解COS.取合适原料配比的双氰胺加入到锥形瓶中,加入适量的蒸馏水,50℃下超声振动促使双氰胺溶解.将溶解后的双氰胺加入到配好的COS溶液中,使用1mol/L的盐酸调节pH至中性,置于微波反应器中反应.反应结束后,将产物旋蒸去除溶剂,透析除去小分子杂质,烘干,研磨后,得到产物COSG.称重,留待后续使用[11]。
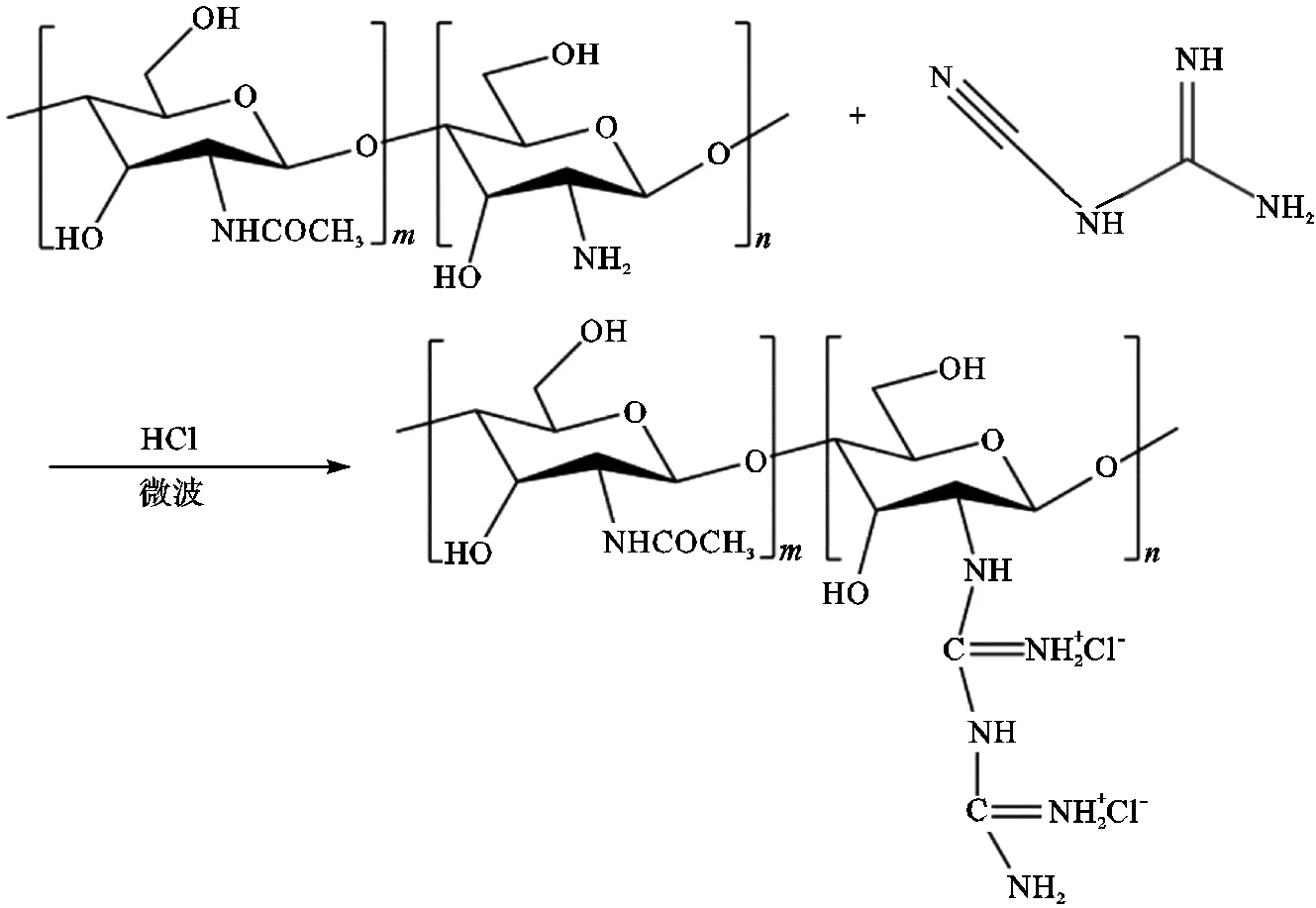
图1 COSG的合成路线
1.3 动物实验
实验动物为天津市动物实验中心提供的成年雄性SD大鼠,共30只,清洁级.将所有大鼠饲养于温度为(23±1)℃和湿度为55%±5%的不锈钢笼中,采取每笼4、5只的分笼喂养方式,并给予12h光照和12h黑暗循环.大鼠饲养7d后,将大鼠随机分为5组:C组(正常空白对照组)、M组(高脂高糖饮食联合STZ诱导模型对照组)、Met组(Met治疗组)、COS组(脱乙酰度为93%的壳寡糖治疗组)和COSG组(由上述壳寡糖合成的壳寡糖胍组).其中正常对照组大鼠喂养普通饲料,其他组大鼠喂养高脂高糖饲料,高糖高脂饲料热量组成:碳水化合物20.1%,脂肪59.8%,蛋白质20.1%,总热量为20.9kJ/g.高脂高糖饲料喂养8周后,禁食12h,按25mg/kg剂量尾静脉注射STZ,构建T2DM大鼠模型,随机血糖>16.7mmol/L为T2DM造模成功,造模成功率约为80%.在接下来的8周,所有组均以原饲料继续喂养,其中药物干预组通过灌胃方式给药(溶剂:蒸馏水,pH=7),空白组灌胃相应剂量的蒸馏水,各组大鼠每日下午同一时间灌胃一次,直至实验结束.所有实验均经中国天津医学科学院放射医学研究所动物实验伦理审查委员会批准.
1.4 样品采集
血液样品:实验期结束,将大鼠禁食12h,然后在乙醚麻醉下通过股动脉穿刺放血处死.将血清样品储存在-20℃冰箱中用于进一步分析.
体重:每周二选定同一时间测定并记录大鼠的体重.
组织标本:实验结束后每组大鼠放血处死,将骨骼肌组织立即取出,液氮冷冻,并在-70℃低温冰箱中保存.
1.5 血样分析
血脂包括总胆固醇(TC)、甘油三酯(TG)、低密度脂蛋白(LDL)和高密度脂蛋白(HDL),使用酶比色法化学试剂盒测定(中升生物技术有限公司提供).采用葡萄糖氧化酶法测量空腹血糖(FBG)含量.使用大鼠胰岛素ELISA试剂盒(南京建城生物工程研究所提供)测定空腹胰岛素(FINS)水平.根据FBG与FINS计算了胰岛素抵抗稳态模型评估(HOMA-IR)作为胰岛素抵抗的指标[13].
1.6 蛋白质印迹法
将组织在缓冲液中匀浆,并通过考马斯亮蓝法测定细胞样品的蛋白质含量.根据总蛋白质浓度添加PBS和缓冲液.然后,根据标准曲线将各组的总蛋白质质量浓度调节至5μg/μL.将蛋白质在8%~10%十二烷基硫酸钠-聚丙烯酰胺凝胶上电泳,并转移到聚偏二氟乙烯膜上.在封闭缓冲液中封闭1h后,将聚偏二氟乙烯膜与一抗在4℃温育过夜,然后用TBST冲洗3次,并在室温下与二抗孵育2h.使用凝胶图像分析系统测量和计算条带的光密度以确定蛋白质含量.
1.7 磷酸烯醇式丙酮酸羧激酶(PEPCK)和肌糖原含量的测定
使用分光光度计法测试PEPCK和肌糖原含量.检测步骤如下.
(1)样品前处理:按照组织质量(g)与提取液体积(mL)为1∶5~1∶10的比例进行冰浴匀浆,取上清液置冰上待测.
(2)测定步骤:①分光光度计预热30min以上,调节波长到340nm,用蒸馏水调零.②配置工作液:使用之前将试剂1中加入试剂2和试剂3混合溶解待用;没用完的试剂4℃条件下可保存1周.配制试剂4:在使用前将2.5mL蒸馏水加入使其充分溶解待用;没用完的试剂4可在4℃条件下保存1周. ③将配置好的工作液和试剂4置于37℃(哺乳动物)或25℃(其他物种)温度环境下预热5min.然后将样本、试剂4和工作液依次加入到1mL的石英比色皿中混匀,在样本加入的同时开始对其计时,记录样品在340nm波长下的初始吸光度1和1min后的吸光度2,对其差值进行计算.
(3)按照样本鲜重对PEPCK的活性进行计算.酶活力单位的定义:每min每g组织消耗1nmol NADH.
(4)其中,在肌糖原的样品前处理步骤中,需要将肌肉组织进行水解并进一步将糖元水解液制备成糖元检测液以进行后续的检测步骤.
1.8 统计分析
实验结果表示为平均值±标准偏差(SD).使用GraphPad Prism 6.0(San Diego,CA,USA)软件进行单因素方差分析(ANOVA),随后进行Bonferroni事后检验.当<0.05时,认为有统计学意义.对照组与其他组相比,<0.05表示为#,<0.01表示为##,<0.001表示为###;模型组与其他组相比,<0.05表示为★,<0.01表示为★★,<0.001表示为★★★.
2 结果与讨论
2.1 COSG的表征
用红外吸收光谱表征壳寡糖及其衍生物的结构,如图2所示,上方黑色谱线为COS的红外谱线,下方红色谱线为COSG的红外谱线.图中,3414cm-1对应着C—H和N—H的吸收峰,并且由于分子中存在大量的氢键作用,该峰明显增强变宽. 2918cm-1处对应着C—H伸缩振动峰.1626cm-1、1060cm-1和602cm-1处的吸收峰分别对应着仲胺的伸缩振动吸收峰、弯曲振动峰以及摇摆振动峰.COSG与COS相比可以观察到,由于仲胺基团的增多,在1626cm-1和1060cm-1的区域中具有更强的特征吸收.此外,COSG在3414cm-1处的峰变宽,这是由于N—H基团的量的增加,分子内氢键作用加强的结果.因此,这些证据都表明在COS上成功接枝了双胍基团.
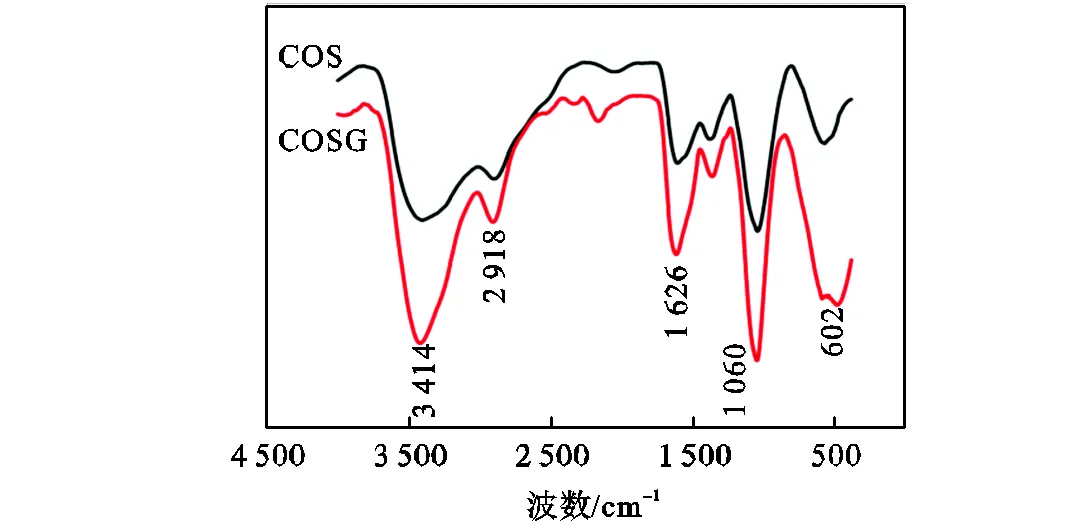
图2 红外吸收光谱
为了进一步确定产物的成功合成,使用核磁共振碳谱进行分析表征(见图3).由于壳寡糖是壳聚糖降解后的产物,其所处化学环境与壳聚糖相同.已知壳聚糖环上各个C的化学位移分别为97.03(C1)、76.03 (C4)、75.01(C5)、71.49(C3)、60.23(C6)、56.23(C2).在图中可以观察到COSG除了上述化学位移外,在165.16(C7)和155.10(C8)处出现新的化学位移,这证明了壳寡糖上成功引入了胍基.
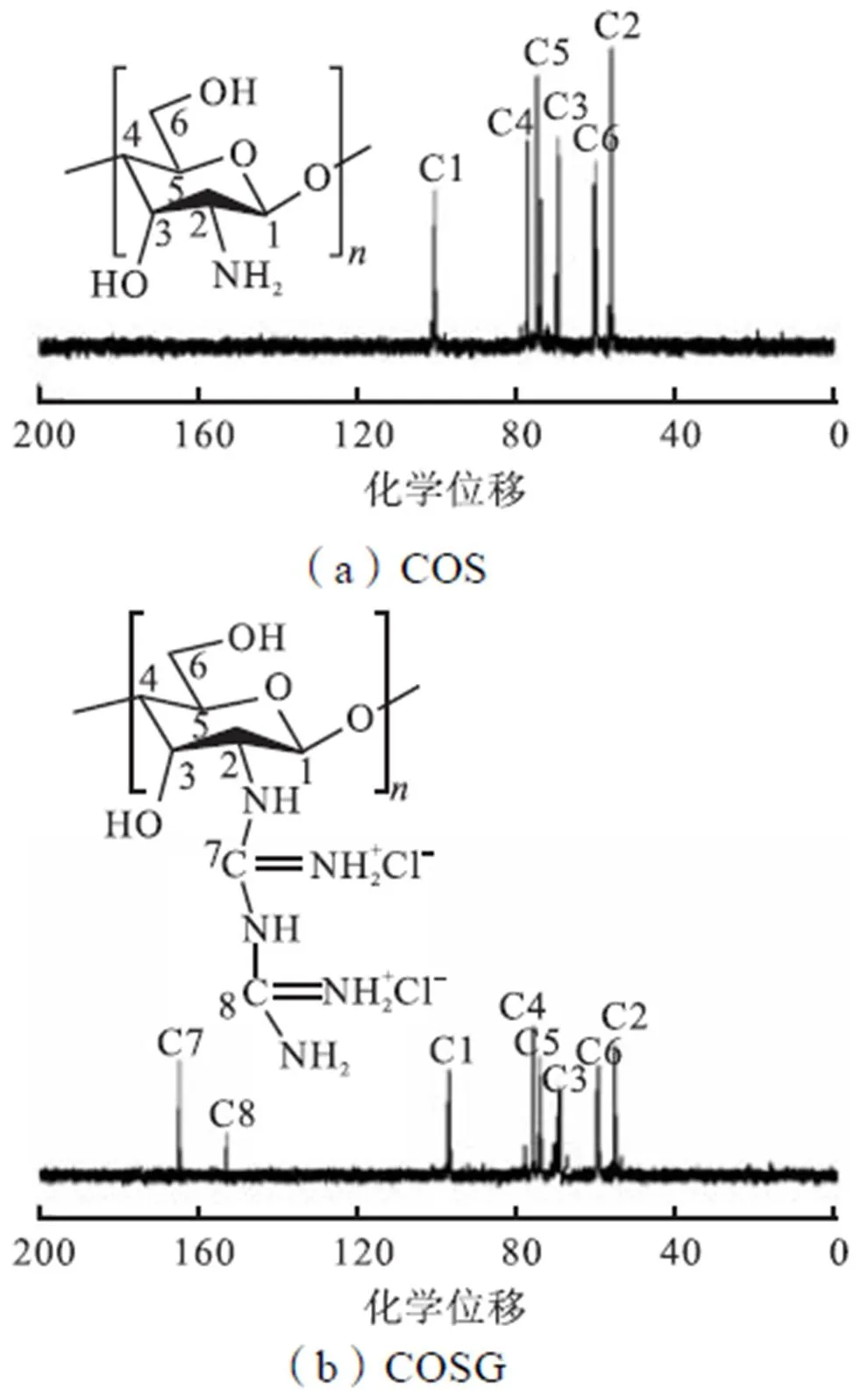
图3 核磁共振碳谱
2.2 COSG对体重的影响
T2DM大鼠通常伴有食欲不振且体重减轻的症状[2].如图4所示,糖尿病大鼠与空白对照组相比体重明显下降,差异有统计学意义.经Met、COS和COSG的治疗后体重均有不同程度的上升,其中COSG和Met上升效果最佳,表明了药物对糖尿病大鼠体重减轻具有良好的控制作用.
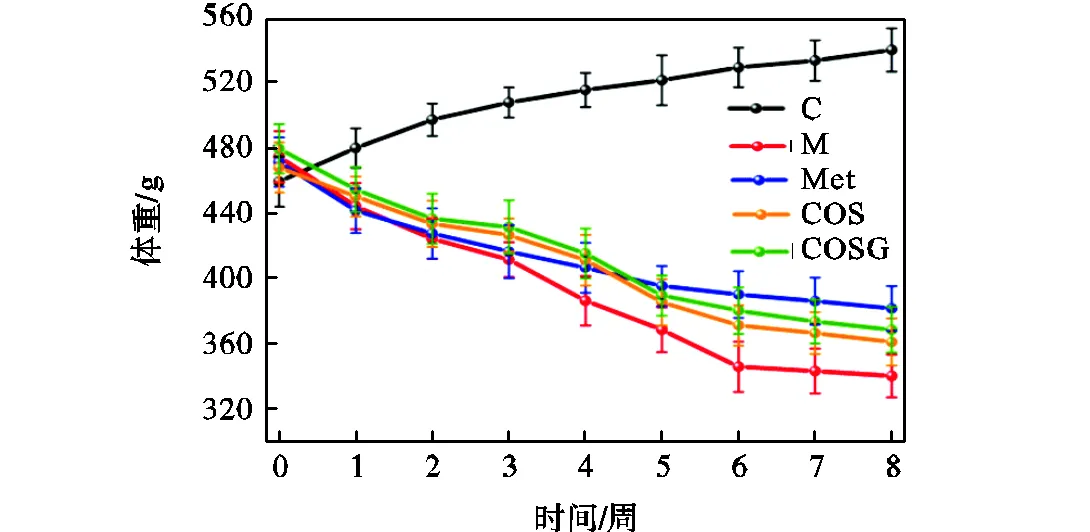
图4 体重的动态变化
2.3 血样分析
T2DM大鼠除了体重减轻的症状外,通常还伴有高血糖和高脂血症[14].如表1所示,模型组TC、TG和LDL含量明显高于空白组,差异有统计学意义.经过Met、COS和COSG治疗后,各组TC、TG和LDL含量均有所下降,作用效果为COSG>Met>COS.对于HDL含量,可见模型组中HDL水平明显降低,经各组治疗后均有所提高,其中COSG效果最优,其次为COS组.
测定各组大鼠FBG和FINS含量以进一步确定COSG对胰岛素抵抗的治疗效果.由表1可知,模型组FBG和FINS含量水平相比于空白对照组显著增加,经各组治疗后均有不同程度的降低,其中COSG可降低FINS含量至模型组的55.37%,达到了最佳的治疗效果.
为评估具体参数,计算了各组的HOMA-IR指 数[13].结果显示模型组HOMA-IR指数明显上升,表现出胰岛素抵抗的症状.经Met、COS和COSG的治疗后HOMA-IR指数均有降低,达到了治疗效果,且COSG效果最优,证明了COSG具有调节血糖血脂水平并改善胰岛素抵抗的作用.
2.4 COSG对骨骼肌GLUT4转膜的影响
在胰岛素抵抗发展过程中,GLUT4起着重要作用,它可从细胞内膜室转移到质膜以促进葡萄糖的摄取,改善体内胰岛素抗性[4-5].在本研究中各组总GLUT4蛋白含量有所变化,但差异无统计学意义(见图5).
表1 Met、COS和COSG对胰岛素抵抗的影响
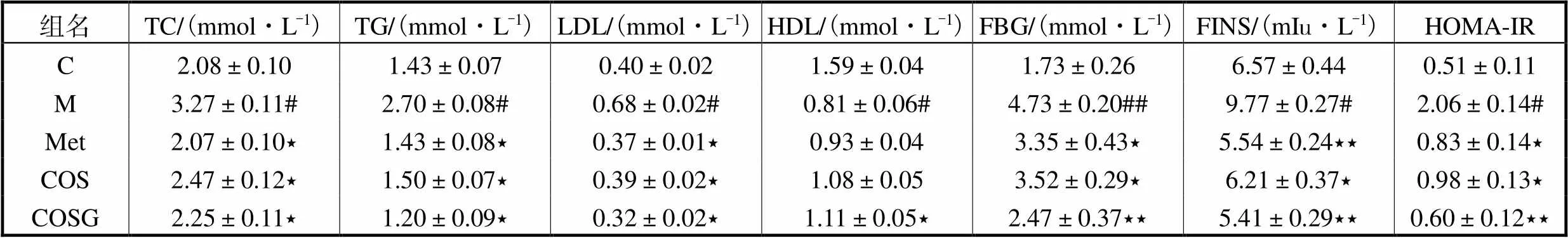
Tab.1 Effects of Met,COS,and COSG on IR
对膜GLUT4含量进行测试可见,相比正常组,模型组膜GLUT4含量显著降低,经过Met、COS和COSG治疗后膜GLUT4含量均有不同程度的上升.其中,COSG上升效果最佳.计算转膜比可见,模型组转膜比显著下降,经过各组治疗均有所上升.其中COSG上升效果最佳,转膜比高达0.69.总之,研究发现COSG可通过增加胰岛素刺激的GLUT4易位到细胞膜,从而改善胰岛素抵抗.
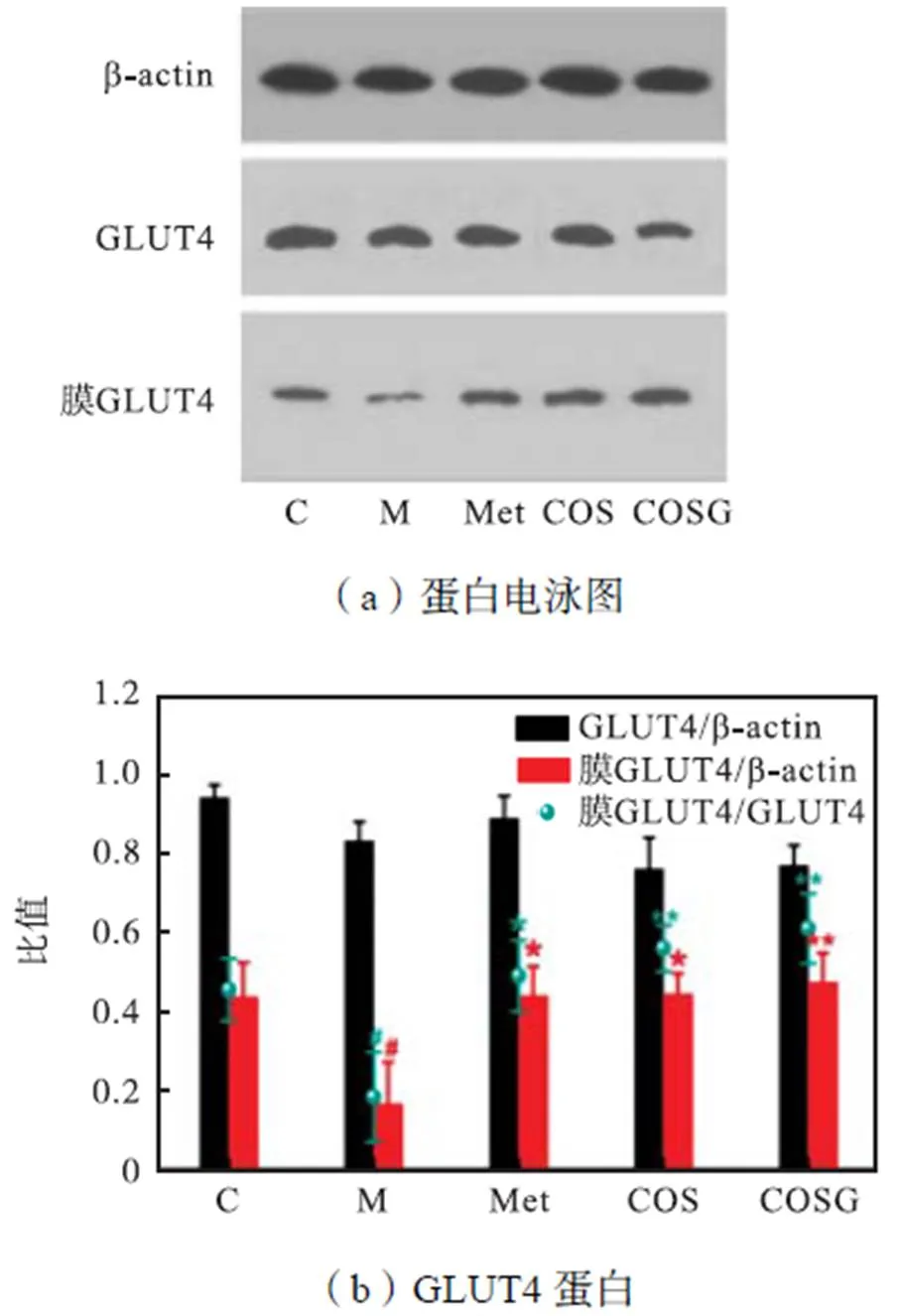
图5 Met、COS和COSG对GLUT4的影响
2.5 COSG对骨骼肌IRS-1(Tyr)/PI3K/AKT通路的影响
研究表明,GLUT4相关胰岛素抵抗的信号途径主要由IRS-1/PI3K/AKT介导[6].Kido等[15]指出,IRS-1的表达降低可阻碍胰岛素信号传导的传递.在实验中,IRS-1基因敲除的小鼠显示出胰岛素抵抗症状.另外有研究表明[16],当胰岛素与骨骼肌细胞膜表面的受体结合时,IRS-1的酪氨酸磷酸化被激活,并可进一步激活PI3K和Akt的磷酸化,引起级联反应,促进GLUT4向细胞膜转运.文献[17]中使用渥曼青霉素抑制PI3K的表达,发现PI3K/Akt上游的胰岛素反应和激活由IRS-1的酪氨酸磷酸化介导.IRS-1酪氨酸磷酸化降低,导致IRS-1与PI3K相互作用的能力降低,从而使得胰岛素信号传导受到抑制.在本研究中发现与上述报道相同的作用通路,模型组胰岛素刺激的IRS-1磷酸化受损(见图6).而经Met和COSG治疗,可分别使IRS-1酪氨酸磷酸化提高至1.56倍和2.04倍.对Akt含量(见图7)测试可见,磷酸化Akt以及磷酸化比值在模型组中的水平显著低于空白组,经过Met和COSG的治疗后,均有明显提高,其中COSG的Akt磷酸化比值最高,为0.61. 上述结果表明COSG可提高IRS-1(Tyr)的磷酸化与Akt磷酸化水平,并可能通过激活经典的IRS-1/PI3K/Akt通路改善胰岛素抵抗.
2.6 COSG对骨骼肌p38 MAPK表达的影响
GULT4相关胰岛素抵抗的另一途径为p38 MAKP通路[18-20].研究提出,p38 MAPK活化可导致IRS-1蛋白的丝氨酸位点磷酸化增加,并抑制PI3K-Akt信号传导途径从而导致胰岛素抵抗[21].另有研究表明[22],对氧磷酶1可以通过抑制p38MAPK磷酸化的方式来激活IRS-1(Tyr)的磷酸化,从而通过IRS-1/Akt途径促进GLUT4的转膜,最终改善骨骼肌细胞的胰岛素抵抗.还有研究发现[23],过表达野生型p38 MAPK的小鼠表现出IRS-1丝氨酸磷酸化增强和胰岛素刺激的IRS-1酪氨酸磷酸化降低.在本研究中各组p38 MAPK水平有所变化,但差异无统计学意义(见图8).然而磷酸化p38 MAPK水平在模型组中显著提高,经过Met、COS和COSG的治疗有所下降,其中COSG治疗效果最佳.计算p38 MAPK磷酸化比值可见,模型组相比正常组显著升高,经过各组治疗可降低p38MAPK磷酸化比值,其中COSG治疗效果最佳,可降低p38 MAPK磷酸化比值至0.69,效果最优.基于此,上述研究可能为本文提供了一种可能机制.COSG可能通过抑制p38 MAPK的磷酸化从而提高IRS-1酪氨酸位点的磷酸化,使得Akt的磷酸化增加,导致细胞内GLUT4易位至细胞膜,从而增加葡萄糖摄取,改善胰岛素抵抗.
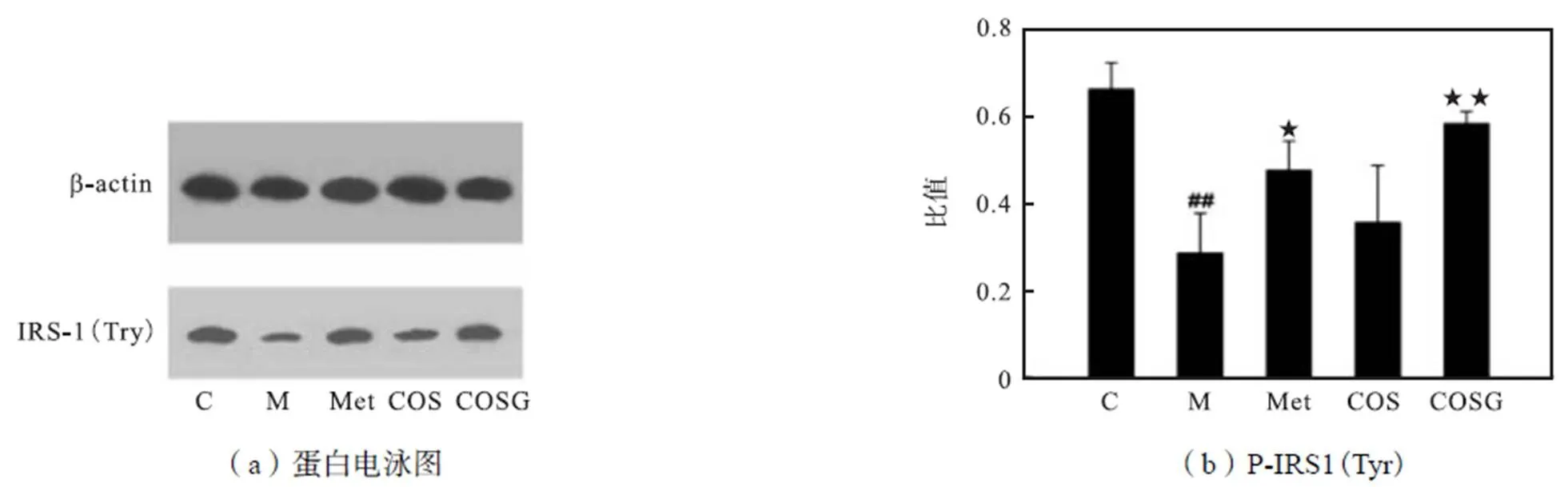
图6 Met、COS和COSG对P-IRS1(Tyr)的影响
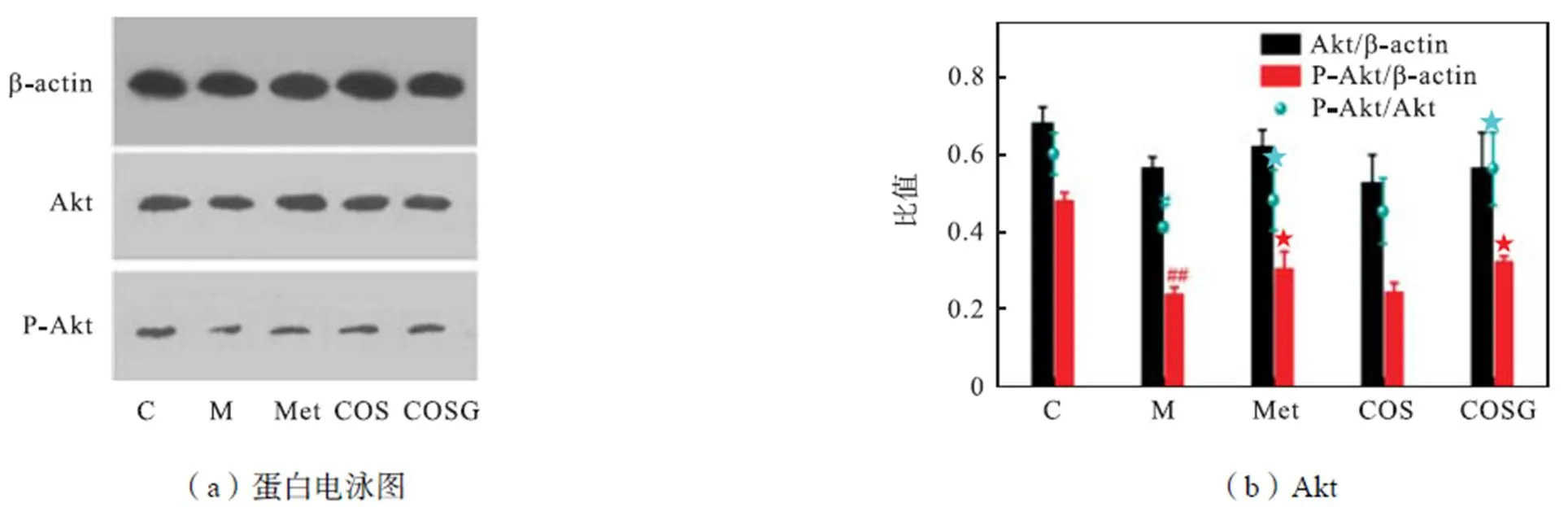
图7 Met、COS和COSG对Akt的影响
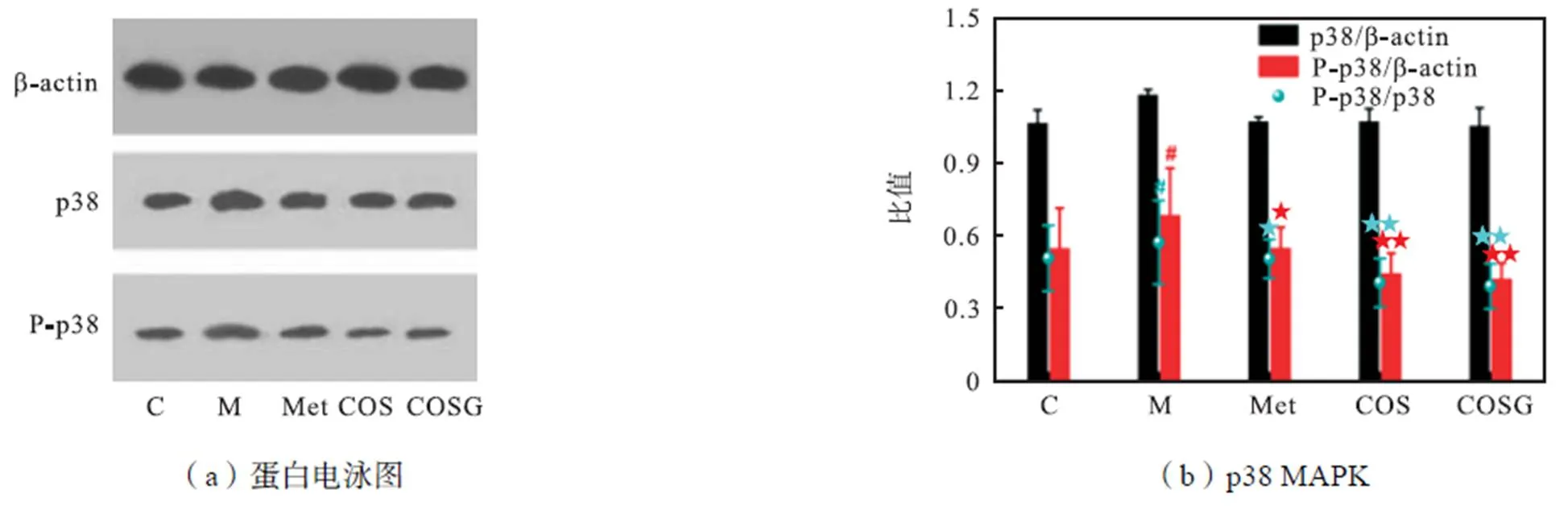
图8 Met、COS和COSG对p38 MAPK的影响
2.7 COSG对骨骼肌PEPCK含量的影响
已知胰岛素除了通过促进葡萄糖的摄取调节体内葡萄糖稳态外,还可以通过抑制糖异生来调节体内葡萄糖水平[24-26].糖异生是非己糖前体形成葡萄糖的合成代谢途径,对葡萄糖生成高度负责,也是维持血液循环的重要机制.PEPCK是一种重要的糖异生酶,其过表达可能导致糖原合成受损,并影响全身胰岛素反应性[27-28].本研究结果(见图9)显示,模型组PEPCK水平明显高于空白组,经过Met、COS和COSG的治疗后,PEPCK含量显著降低,其中COSG的下降效果最明显,略优于Met.
肌糖原含量结果(见图10)显示,模型组肌糖原含量明显低于空白组.经过Met和COSG治疗后,可明显上调肌糖原含量.其中COSG组中上调肌糖原的作用显著,可达到正常组肌糖原含量的90.07%.这些结果表明COSG具有减少肌肉糖异生的能力,可能有助于进一步改善胰岛素抵抗.
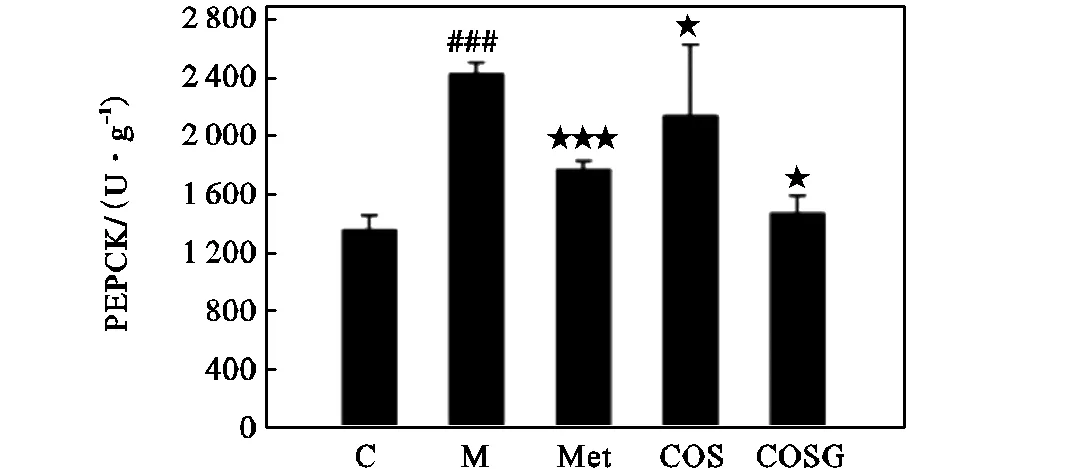
图9 Met、COS和COSG对PEPCK的影响
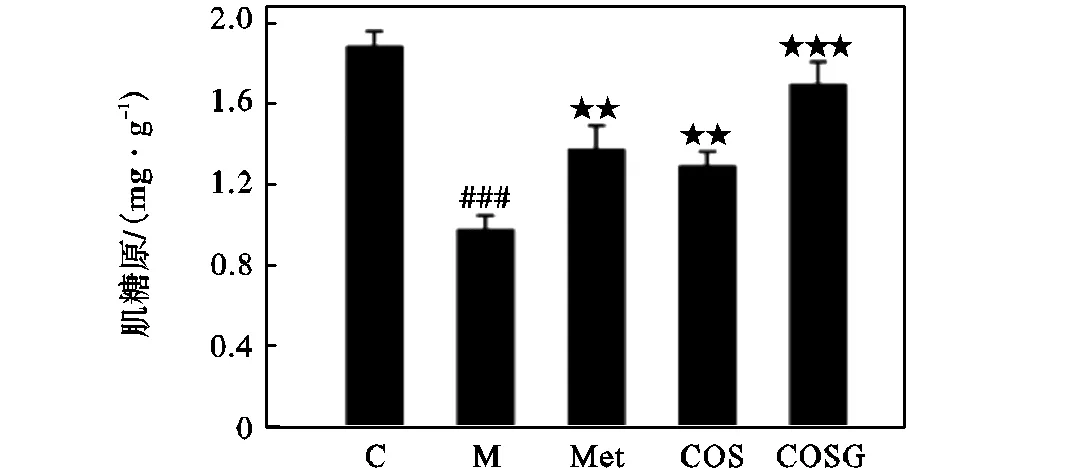
图10 Met、COS和COSG对肌糖原的影响
3 结 语
本文研究结果表明COSG有利于改善T2DM大鼠胰岛素抵抗,并调节骨骼肌中胰岛素抵抗相关蛋白的表达.其中,COSG可抑制p38 MAPK的磷酸化以及提高IRS-1(Tyr)蛋白的磷酸化;COSG还可上调Akt的磷酸化水平并促进GLUT4转移至细胞膜,促进细胞对葡萄糖的摄取;另一方面,COSG还可降低PEPCK和肌糖原的表达,进而控制糖异生,从而达到改善胰岛素抵抗的目的.总之,本文研究结果表明了COSG对体内胰岛素抵抗的治疗作用,可为开发治疗T2DM的药物提供重要的理论依据.
[1] DeFronzo R A,Jacot E,Jequier E,et al. The effect of insulin on the disposal of intravenous glucose:Results from indirect calorimetry and hepatic and femoral venous catheterization[J]. Diabetes,1981,30(12):1000-1007.
[2] Saltiel A R,Kahn C R. Insulin signalling and the regulation of glucose and lipid metabolism[J]. Nature,2001,414(6865):799-806.
[3] Mayerson A B,Hundal R S,Dufour S,et al. The effects of rosiglitazone on insulin sensitivity,lipolysis,and hepatic and skeletal muscle triglyceride content in patients with type 2 diabetes[J]. Diabetes,2002,51(3):797-802.
[4] Holten M K,Zacho M,Gaster M,et al. Strength training increases insulin-mediated glucose uptake,GLUT4 content,and insulin signaling in skeletal muscle in patients with type 2 diabetes[J]. Diabetes,2004,53(2):294-305.
[5] Mingrone G,Rosa G,Rocco P D,et al. Skeletal muscle triglycerides lowering is associated with net improvement of insulin sensitivity,TNF-α reduction and GLUT4 expression enhancement[J]. International Journal of Obesity,2002,26(9):1165-1172.
[6] Tian C,Chang H,La X,et al. Wushenziye formula improves skeletal muscle insulin resistance in type 2 diabetes mellitus via PTP1B-IRS1-Akt-GLUT4 signaling pathway[J]. Evidence-Based Complementary and Alternative Medicine,2017,12(8):2129-2139.
[7] Ito Y,Obara K,Ikeda R,et al. Passive stretching produces Akt-and MAPK-dependent augmentations of GLUT4 translocation and glucose uptake in skeletal muscles of mice[J]. Pflügers Arch,2006,451(6):803-813.
[8] Hundal R S,Krssak M,Dufour S,et al. Mechanism by which metformin reduces glucose production in type 2 diabetes[J]. Diabetes,2000,49(12):2063-2069.
[9] Nauck M,Frid A,Hermansen K,et al. Efficacy and safety comparison of liraglutide,glimepiride,and placebo,all in combination with metformin,in type 2 diabetes[J]. Diabetes Care,2009,32(1):84-90.
[10] 姚芳莲,田欣露,孙 达. 光交联羧甲基壳聚糖衍生物水凝胶的制备及性能研究[J]. 天津大学学报:自然科学与工程技术版,2019,52(5):508-514.
Yao Fanglian,Tian Xinlu,Sun Da. Preparation and characterization of photo-crosslinking hydrogel of carboxymethyl chitosan derivative[J]. Journal of Tianjin University:Science and Technology,2019,52(5):508-514(in Chinese).
[11] Wang Li,Liu Zongbao,Liu Xiaofei,et al. Microwave-assisted synthesis of chitooligosaccharide guanidine and its effect on GLUT4-dependent glucose uptake through an Akt-activated protein kinase signaling pathway in L6 skeletal muscle cells[J]. RSC Advances,2016,6:90777-90785.
[12] Zhang Hai,Zhang Shengsheng,Wang Li,et al. Chitooligosaccharide guanidine inhibits high glucose-induced activation of DAG/PKC pathway by regulating expression of GLUT2 in type 2 diabetic nephropathy rats [J]. Journal of Functional Foods,2018,41(12):41-47.
[13] Bonora E,Formentini G,Calcaterra F,et al. HOMA-estimated insulin resistance is an independent predictor of cardiovascular disease in type 2 diabetic subjects[J]. Diabetes Care,2002,25(7):1135-1141.
[14] Saravanan S,Pari L. Role of thymol on hyperglycemia and hyperlipidemia in high fat diet-induced type 2 diabetic C57BL/6J mice[J]. European Journal of Pharmacology,2015,761(19):279-287.
[15] Kido Y,Burks D J,Withers D,et al. A novel insulin analog with unique properties[J]. Diabetes,2003,52(9):2227-2238.
[16] Cai S,Sun W,Fan Y,et al. Effect of mulberry leaf(Folium Mori)on insulin resistance via IRS-1/PI3K/Glut-4 signalling pathway in type 2 diabetes mellitus rats[J]. Pharmaceutical Biology,2016,54(11):2685-2691.
[17] Martin K A,Merenick B L,Ding M,et al. Rapamycin promotes vascular smooth muscle cell differentiation through insulin receptor substrate-1/phosphatidylinositol 3-kinase/Akt2 feedback signaling[J]. Journal BiologicalChemistry,2007,282(49):36112-36120.
[18] Furtado L M,Poon V,Klip A. GLUT4 activation: Thoughts on possible mechanisms[J]. Acta Physiologica Scandinavica,2003,178(4):287-296.
[19] Somwar R,Kim D Y,Sweeney G,et al. GLUT4 translocation precedes the stimulation of glucose uptake by insulin in muscle cells: Potential activation of GLUT4 via p38 mitogen-activated protein kinase[J]. Biochemical Journal,2001,359(3):639-649.
[20] Somwar R,Kim D Y,Sweeney G,et al. GLUT4 translocation precedes the stimulation of glucose uptake by insulin in muscle cells: Potential activation of GLUT4 via p38 mitogen-activated protein kinase[J]. Biochemical Journal,2001,359(3):639-649.
[21] Hemi R,Yochananov Y,Barhod E,et al. P38 mitogen-activated protein kinase-dependent transactivation of ErbB receptor family[J]. Diabetes,2011,60(4):1134.
[22] Gluzer M K,Aviram M,Hayek T. Paraoxonase1 (PON1)reduces insulin resistance in mice fed a high-fat diet,and promotes GLUT4 overexpression in myo-cytes,via the IRS-1/Akt pathway[J]. Atherosclerosis,2013,229(1):71-78.
[23] Shi Y. Mammalian target of rapamycin inhibitors activate the AKT kinase in multiple myeloma cells by up-regulating the insulin-like growth factor receptor/insulin receptor substrate-1/phosphatidylinositol 3-kinase cascade[J]. Molecular Cancer Therapeutics,2005,4(10):1533-1540.
[24] Liu S H,Chang Y H,Chiang M T. Chitosan reduces gluconeogenesis and rncreases glucose uptake in skeletal muscle in streptozotocin-induced diabetic rats[J]. Journal of Agricultural and Food Chemistry,2010,58(9):5795-5800.
[25] Agius L. New hepatic targets for glycaemic control in diabetes[J]. Best Practice & Research Clinical Endocrinology & Metabolism,2007,21(4):587-605.
[26] Nerurkar P V,Nishioka A,Eck P O,et al. Regulation of glucose metabolism via hepatic forkhead transcription factor 1(FoxO1) by(noni) in high-fat diet-induced obese mice[J]. British Journal of Nutrition,2012,108(2):218-228.
[27] Liu J,Wu X,Franklin J L,et al. Mammalian tribbles homolog 3 impairs insulin action in skeletal muscle: Role in glucose-induced insulin resistance[J]. AJP:Endocrinology and Metabolism,2010,298(3):565-576.
[28] Bosse K,Schmutzler R. Integration of biochemical and physiologic effects of insulin on glucose metabolism[J]. Experimental and Clinical Endocrinology Diabetes,2001,109(Suppl 2):122-134.
Effects of Chitooligosaccharide Guanidine on Insulin Resistance and Related Protein
Wang Yuanyuan1,Liu Xiaofei1,Zou Yalu1,Zhang Hai1,Zheng Qifang1,Zhao Liyan1,Wu Yuntang2
(1. School of Materials Science and Engineering,Tianjin University,Tianjin 300072,China;2. School of Public Health,Tianjin Medical University,Tianjin 300072,China)
The effects of chitooligosaccharide guanidine (COSG) on insulin resistance and its relatedmechanisms still remain unclear. Therefore, in this study, a type 2 diabetic (T2DM) rat model was established using a high-fat and high-sugar diet combined with streptozotocin, followed by intragastric administration of COSG for 8 weeks, to investigate the effects of COSG on insulin resistance and the related signaling pathways in T2DM rats. Results demonstrated that COSG significantly reduced the levels of total cholesterol (TC), triglycerides (TGs), and low-density lipoprotein (LDL) and increased the levels of high-density lipoprotein (HDL) in the serum of T2DM rats. Furthermore, COSG downregulated the levels of fasting blood glucose (FBG) and fasting insulin (FINS) and decreased the homeostatic model assessment for insulin resistance (HOMA-IR) index in T2DM rats. Further analysis of related proteins showed that COSG inhibited the phosphorylation of p38 mitogen-activated protein kinase (p38 MAPK), increased the tyrosine phosphorylation of insulin receptor substrate-1 (IRS-1) proteins, increased the phosphorylation of protein kinase B (Akt), and promoted the transfer of GLUT4 to the cell membrane, thereby promoting the uptake of glucose by cells. Results also showed that COSG can reduce the levels of phosphoenolpyruvate carboxykinase (PEPCK) and muscle glycogen, thereby inhibiting gluconeogenesis. Therefore, COSG has the effect of improving insulin resistance. In conclusion, COSG can improve insulin resistance in T2DM rats, a finding that has a good application prospect.
chitooligosaccharide guanidine;type 2 diabetes(T2DM);insulin resistance;glucose transporter 4(GLUT4);insulin signaling protein
Supported by the National Natural Science Foundation of China(No.51473120).
TK448.21;R961
A
0493-2137(2020)05-0459-08
10.11784/tdxbz201903050
2019-03-22;
2019-04-11.
王园园(1994— ),女,硕士研究生,yywang1106@163.com.
刘晓非,liuxf@tju.edu.cn.
国家自然科学基金资助项目(51473120).
(责任编辑:田 军)

