鱼类抗菌肽的研究进展
胡媛媛,姚 波
重庆科技学院化学化工学院;工业发酵微生物重庆市重点实验室(重庆科技学院),重庆 401331
近年来,由于医药、食品和农业等领域中抗生素的过度使用和误用,致使细菌耐药性和食品药物残留等问题日益突出。据统计,若2014 到2050年间不采取任何措施来解决抗生素滥用和细菌耐药性发展的趋势,估计有3 亿人会因抗药性而过早死亡,导致60~100 万亿美元的经济损失[1]。由于耐药病原体的数量逐渐增多,迫切需要新的抗菌药代替现有抗生素。抗菌肽(antimicrobial peptides,AMPs)作为防御微生物的有效武器,因其广谱的抗菌活性、独特的作用机制和罕见的抗生素抗性变体(antibiotic-resistant variants)特性而备受关注(见图1)。AMPs 是细菌、昆虫、植物和脊椎动物等几乎所有生物体先天免疫的一部分,除了抗炎和免疫调节特性外,对细菌、真菌、寄生虫、原虫和病毒等具有广谱抗菌活性,且对癌细胞具有细胞毒性。近些年,AMPs 在治疗皮肤感染、血管生成、炎症反应、细胞信号转导、创面愈合、局部和全身适应症方面的研究取得了实质性进展[2-4]。
AMPs 最先发现于1939 年,研究人员从芽孢杆菌(Bacillus brevis)中提取了克拉霉素(短杆菌肽Gramcidin),然后在1981 年分离出天蚕素(Cecropin)和Magainin[2]。脊椎动物抗菌肽最早于20 世纪80 年代中期在两栖动物、人和家兔中发现,鱼类AMPs 虽在同一时期被发现,但却直到1996 年才首次检测到其具有抗菌活性[5]。
AMPs 通常被认为是先天免疫的重要组成部分,是抵御多种病原体的第一道防线。AMPs 的二级结构是它攻击病原菌的关键因素,其二级结构可大致分为4 类,其中有α-螺旋,含2 个或多个二硫键的β-直链,存在单个二硫键和或肽链环化β-折叠,伸展的肽链。AMPs 都是阳离子型或两亲性的,大多数AMPs 都能破坏细菌细胞膜,使内容物泄漏,出现空泡化。AMPs 通过破坏细胞膜迅速杀死入侵的病原体,使病原体很难产生耐药性。AMPs 能够与细菌DNA、RNA 结合来抑制蛋白质合成,并导致细菌死亡。某些AMPs 可以通过抑制细胞的呼吸作用和与细菌的热休克蛋白结合发挥抗菌活性[3]。
鱼类经常受到各种病原体的挑战,这些病原体不仅对鱼类的健康有害,且增加了它们对传统抗生素产生耐药性的风险。由于鱼类更依赖先天免疫,所以鱼类AMPs 可以作为潜在的防御武器对抗新出现的毁灭性感染性疾病[6]。本文对鱼类AMPs 的分类、结构特征、抗菌谱及作用机制、分子设计等研究进展进行综述,以期为更好地将其用于渔业生产和防病治病,开发绿色环保养殖技术,促进养殖渔业健康可持续发展。
1 鱼类AMPs 分类
AMPs 是一大类具有独特结构的生物分子,通常含有12 到50 个氨基酸残基,由于分子中包含2个或者更多的带正电的氨基酸残基,如精氨酸、赖氨酸,或者在酸性环境中的组氨酸,且疏水结构域一般超过50%,可以基于其氨基酸组成和结构进行分类[7],根据已知鱼类AMPs 的分类、结构特征、表达部位等信息见表1,按照不同类型AMPs 抗菌谱整理成表2。
1.1 Piscidin 类
Piscidin 含18~26 个氨基酸,呈α-螺旋,具有高度保守的氨基末端,富含组氨酸和苯丙氨酸。首次于杂交条纹鲈鱼[hybrid striped bass(Morone saxatilis×M.chrysops)]的肥大细胞中分离得到,Piscidin 具抗真菌、抗寄生虫和抗病毒活性[8-9]。此外,在同一物种中还发现了多种Piscidin 亚型,主要在鳃、皮肤和肠中表达,也在头、肾和脾中表达[5,10]。
1.2 Defensin 类
Defensin 由18~45 个氨基酸组成,含6~8 个保守的半胱氨酸,对细菌、真菌和许多包膜病毒和非包膜病毒都有一定的抗菌活性,根据半胱氨酸形成二硫键的配对和定位不同将其分为α-,β-,θ-Defensin 3 类[11]。目前已发现该抗菌肽的4 个基因和5 个亚型,主要在头、肝、眼、性腺、肌肉和皮肤等部位表达[5,12]。
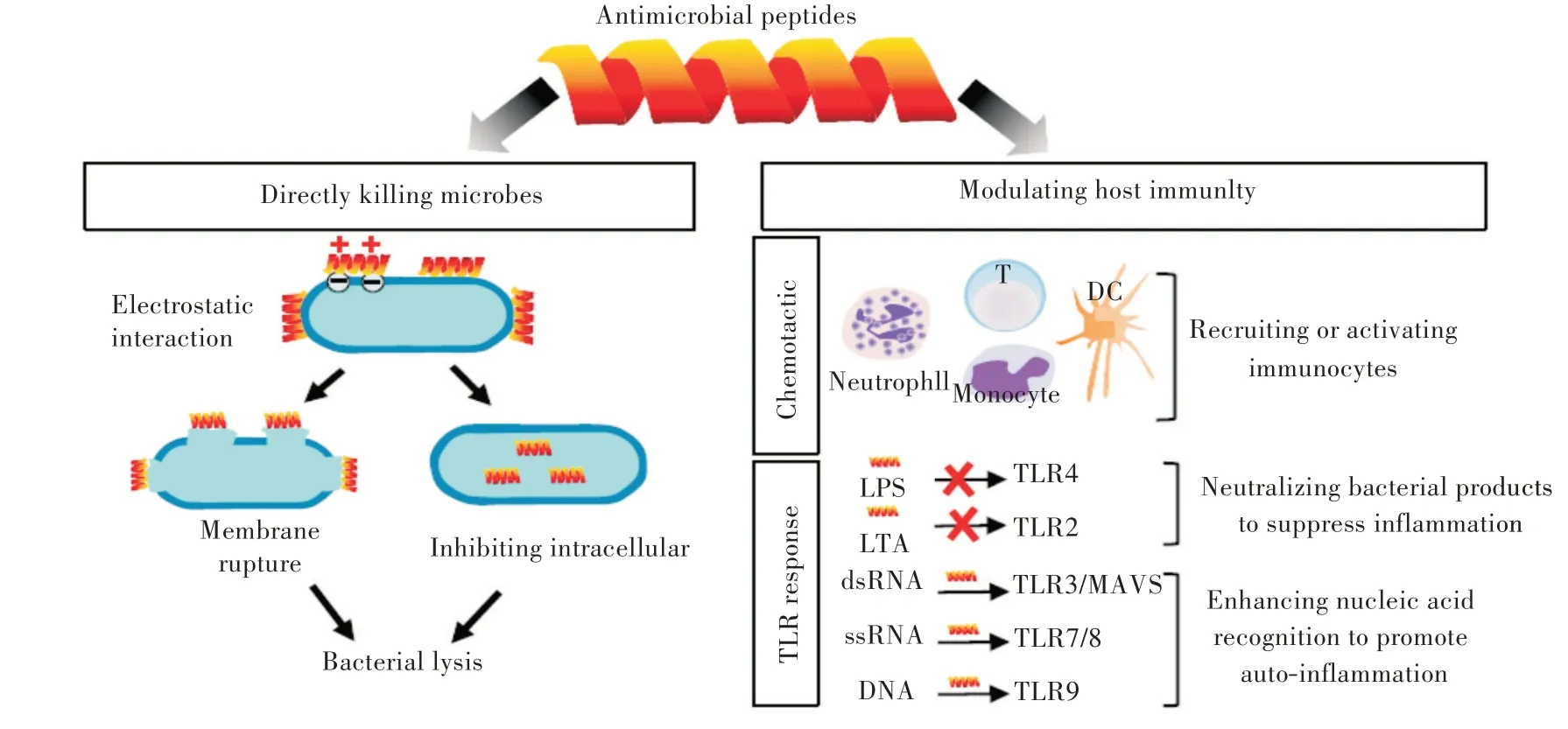
图1 抗菌肽作用机制模式图[3]Fig.1 Action mechanism diagram of antimicrobial peptides[3]
1.3 Hepcidin 类
Hepcidin 的前肽含有85 个氨基酸残基,由3 个部分组成:信号肽(24 个氨基酸)、前肽(40 个氨基酸)和成熟肽(21 个氨基酸),该基因有2 个内含子和3 个外显子[13],主要在肝脏中表达。Hepcidin 作用广泛,对革兰氏阴性细菌和革兰氏阳性细菌均有活性,具有抗病毒、抗寄生虫、免疫调节、抑制真菌和酵母生长等作用[13-14]。同时,Hepcidin 作为铁调节激素,还控制巨噬细胞和肝细胞的铁释放,限制铁释放到血浆中的量[15]。
1.4 Cathelicidin 类
Cathelicidin 含12~80 个氨基酸不等,其中由23~37 个氨基酸组成的肽呈线性肽链,折叠形成两亲性的α-螺旋;12~18 个氨基酸的肽链形成具有二硫键的β-发夹结构;39~80 个氨基酸组成的肽链显示重复的脯氨酸基序,形成扩展的多脯氨酸型结构[16]。Cathelicidin 对细菌、原生动物、真菌和病毒都有一定的抑制作用,在鳃、头肾、肠道、皮肤和脾等部位表达[16-18]。
Cathelicidin 首次在脊椎动物中发现是从大西洋海鳗(Myxine glutinosa)的肠道中分离出了3 种有效抗菌肽(HFIAP-1,-2 和-3),然后在被细菌感染的虹鳟(Oncorhynchus mykiss)中也发现了Cathelicidin 的表达[18]。
1.5 Pardaxin 类
Pardaxin 含33 个氨基酸残基,是从红海比目鱼(Pardachirus marmoratus)的毒液中分离出来的多肽神经毒素,具有螺旋-铰链-螺旋结构。可通过裂解细菌壁来抑制细菌生长,此外,还能抑制肿瘤细胞系的增殖,诱导细胞凋亡[19-20]。
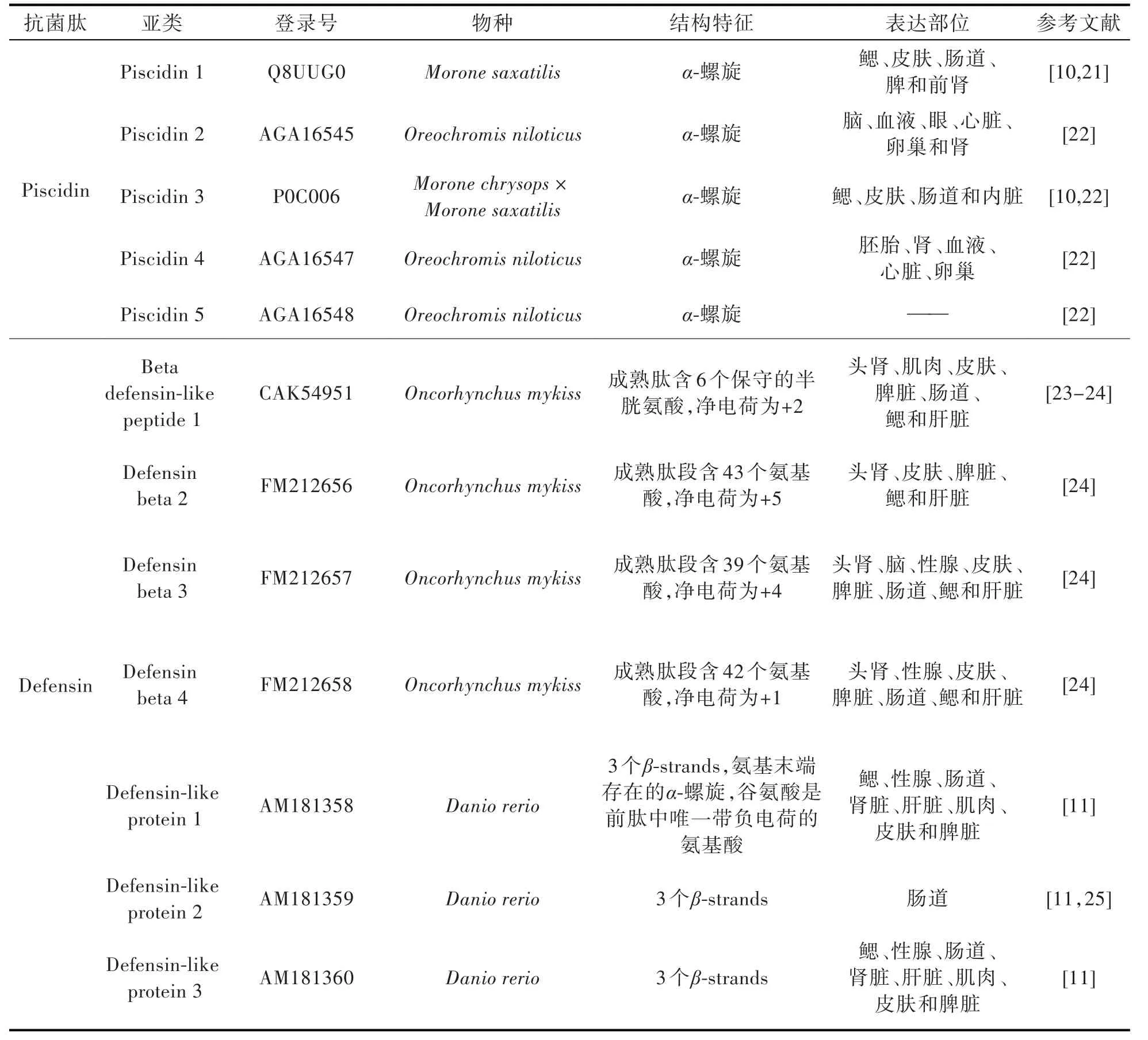
表1 已知来源于鱼类的抗菌肽Tab.1 List of known antimicrobial peptides from fish
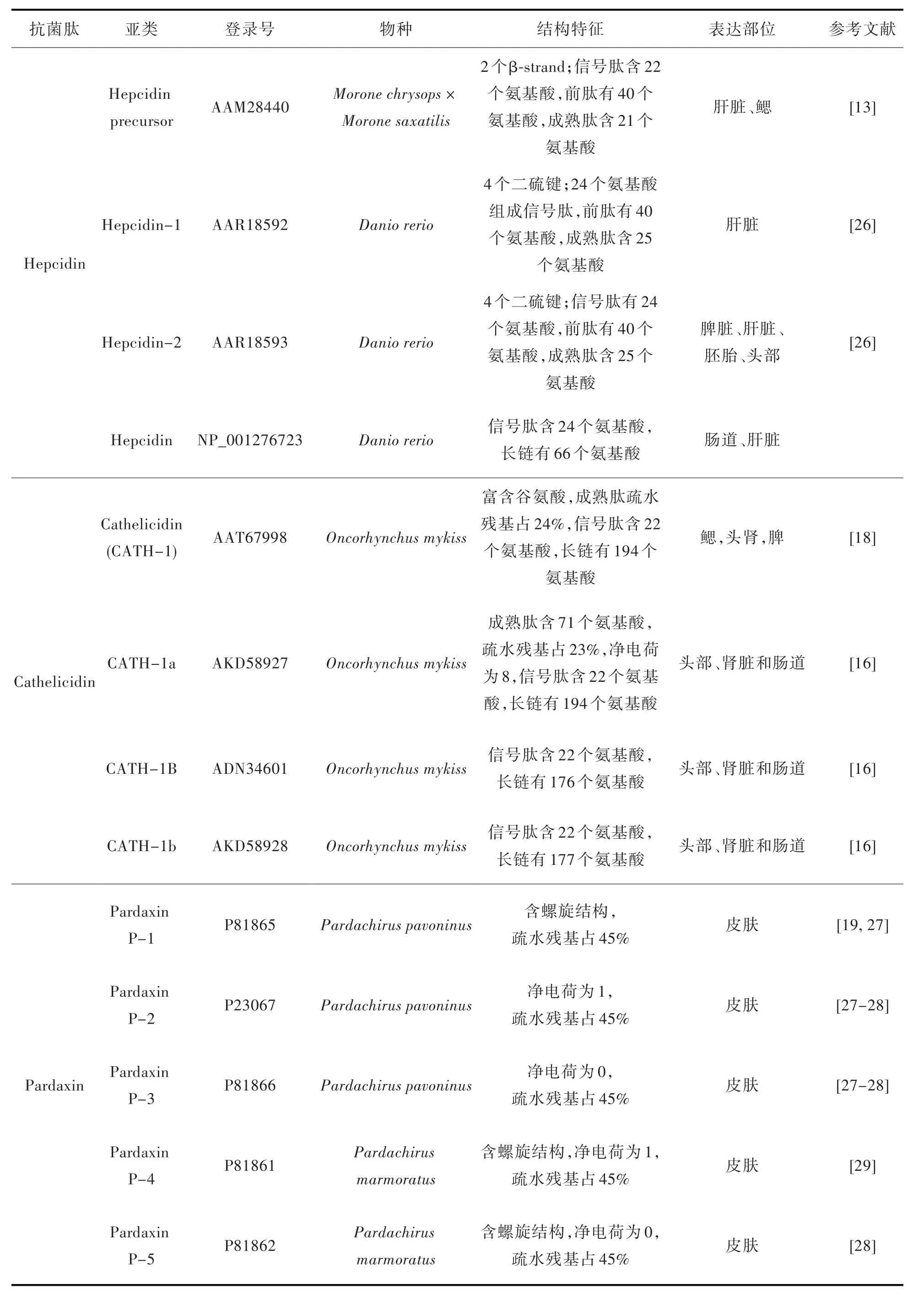
续表1

表2 抗菌肽的抗菌谱Tab.2 Antibacterial spectra of AMPs
2 影响AMPs 活性的因素
2.1 电 荷
AMPs 的阳离子性质使其能够通过静电吸引与微生物相结合,或者在吞噬细胞摄取微生物后增强其杀灭作用。当AMPs 在微生物表面积累达到临界浓度时,其疏水面在微生物细胞质膜内渗透和组装形成离子通道或水孔,导致微生物低渗透裂解死亡[36]。
Lee 等[37]测试AMPs 抗菌活性的实验中,天蚕素样肽C 端含有疏水性螺旋,对革兰氏阴性菌有很高的抗菌活性。Papiliocin 对革兰氏阴性菌的抗菌活性与天蚕素A 相似。然而,Papiliocin 在N-端螺旋中的净电荷为+6,而天蚕素A 为+5。因此,作者推测Papiliocin 含阳离子度更高是Papiliocin 对革兰氏阳性菌的抗菌活性高于天蚕素A 的潜在原因。魏晓晓等[38]设计将牛血红蛋白源AMPs 的第1、2 位的Val和Asp 都替换为Arg 后合成多肽,发现合成肽的静电荷比原AMPs 净电荷数多2,其抑菌活性比原AMPs 的高,对红细胞的渗透脆性影响很小,有较高的安全性。
2.2 疏水性
适当的疏水性可使肽对带电膜和中性膜的亲和力增加[39]。Chen 等[40]通过用疏水性较弱的丙氨酸取代亮氨基或用亮氨酸残基取代丙氨酸残基,系统性地降低或增加疏水性,发现处于疏水性临界值时抗菌活性最强。在临界值的一定范围内增强疏水性可提高抗菌能力,但超过或者低于该范围都会使抗菌活性显著降低。郝刚[41]在BF2-A 第10 位精氨酸上接入序列RLLR 并用亮氨酸取代第8 位上的缬氨酸,设计合成了一个新肽BF2-X。与BF2-A 相比,BF2-X 的螺旋度与正电荷增加,疏水性比例提高,C-端两亲性增强。在抗菌活性测试中,BF2-X 对大肠杆菌和金葡菌的抗菌活性是BF2-A 的两倍,且杀菌比BF2-A 更为快速。
2.3 二级结构
AMPs 具有丰富的二级结构,包括由2~3 个二硫键形成稳定的β-折叠、两亲性α-螺旋结构、环化肽和带有1~2 个氨基酸残基的延伸肽链,通过调整肽的结构可适当地提高抗菌活性[2](见图2)。Wang 等[42]为研究AMPs polybia-MPI 结构与活性的关系,设计并合成了由L-Pro 分别取代Leu7,Ala8和Asp9的三种类似物。Leu7和Asp9的L-Pro 取代物α-螺旋构象的含量降低,Ala8 的L-Pro 取代物彻底破坏了α-螺旋构象。L-Pro 取代物抗肿瘤活性显着降低,表明polybia-MPI 的α-螺旋构象对抗肿瘤活性十分重要。
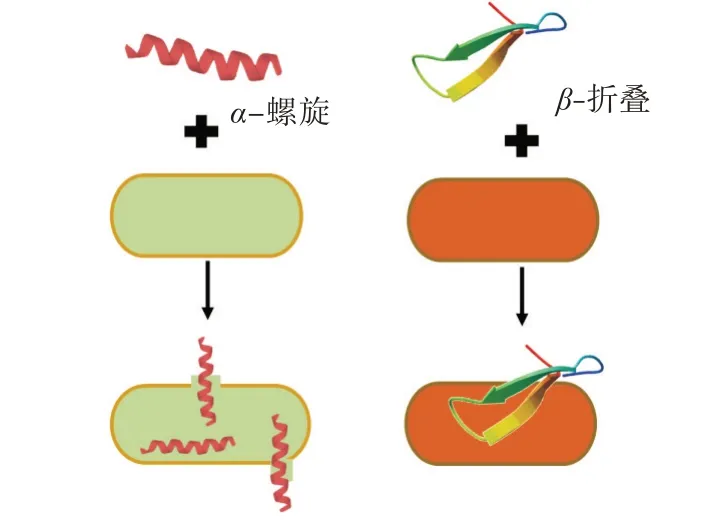
图2 抗菌肽二级结构破坏细菌模式图Fig.2 Schematic diagrams of disruption of secondary structure of AMPs to bacteria
2.4 二硫键
二硫键是比较稳定的共价键,其形成和还原是局部的、两态的,在结构上有明显变化。二硫化物是稳定的共价中间体,其结构可以表征和分离[43]。Bai 等[44]对防御素活性与结构研究中发现,天然二硫键在进化中是保守的,虽然对防御素抗菌作用影响不大,但是有助于肽结构稳定性和趋化活性。同时,在其他抗微生物肽中也有类似发现,如Tachyplesin 和polyphemusins 等。Lee 等[45]采用酶解和质谱分析相结合的方法确定了Coprisin的二硫键对,发现消除Coprisin 中任何一对二硫键,其抗菌活性都将消失,但抗真菌活性存在。通过圆二色谱(CD)分析表明,Coprisin 的2 个二硫键Cys20-Cys39 和Cys24-Cys41 稳定Coprisin 的α-螺旋区,从而影响其抗菌活性和稳定性。
3 AMPs 分子的定向改造
3.1 扩大抗菌谱
在扩大AMPs 抗菌谱的研究中,构建杂合AMPs 是目前应用比较广泛的技术(见图3)。Wang 等[46]利用基因拼接技术将Attacin 和Thanatin构建成杂合肽Attacin-Thanatin,插入质粒pET-32a(+)中,并在大肠杆菌Rosetta 中诱导表达。生物活性检测表明,该肽能有效抑制大肠杆菌、沙门氏菌和金黄色葡萄球菌等的生长,且杂合肽对测试细菌的抗菌活性略高于单一的AttacinAMPs,对猪红细胞几乎没有毒性。张宏刚等[47]采用重叠延伸技术合成抗菌肽Melitti 和Mytilin-B 的功能序列,得到杂合AMPs Mel-MytB(MEM)。对其表达产物进行测定,杂合肽具有广谱抗菌活性,对革兰氏阴性菌和阳性菌都有较强的抑菌活性,同时具有热稳定性和酸稳定性的特点。
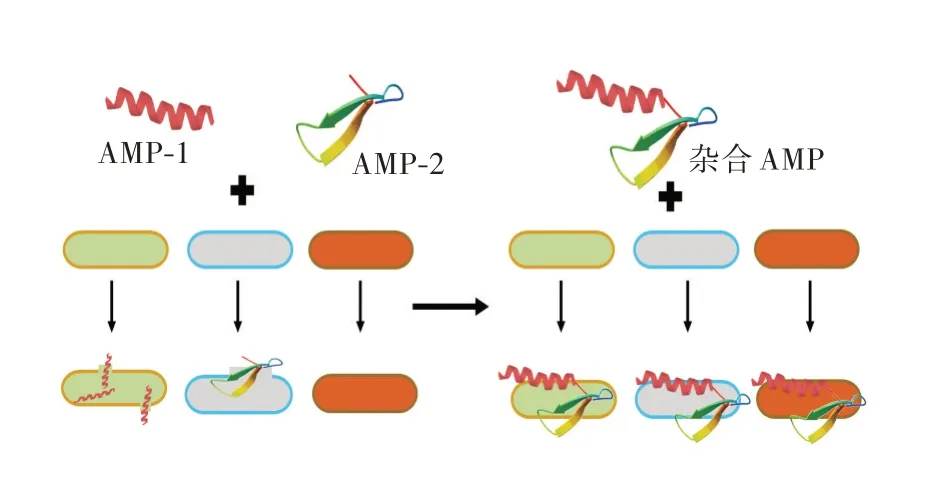
图3 AMPs 杂合扩大抗菌谱模式图Fig.3 Schematic diagrams of broadening of antimicrobial spectra of AMPs by hybrid
AMPs 数据库筛选与计算机分子设计为扩大AMPs 的抗菌谱提供了新的思路。中东呼吸综合征(MERS-CoV)在目前尚无有效的治疗手段,Mustafa 等[48]通过对MERS-CoV 的刺突蛋白进行计算机对接研究,根据特定的理化性质从AMPs 数据库(APD3)中检索筛选出合适的AMPs;利用Piper 技术,通过蛋白质-肽对接过程中形成的簇数来测量肽的结合模式。从而得到可能与MERS-CoV 的刺突蛋白结合的AMPs 分子,这些AMPs 可能在发挥抑制作用方面至关重要。通过对208 个聚类大小的分析,得到7 个具有良好结合分数的假定肽。
3.2 提高稳定性
在分离、纯化等过程中,分子量小且表达产物稳定性不高的AMPs 易受蛋白酶的影响而降解,多肽固有的代谢降解不稳定性是将肽类药物推向市场的一大难题[49]。残基取代这一改造方法可显著地提高AMPs 的稳定性。在Adam 等[50]的研究中,EFK17 是取自LL-37 具有抑菌活性的肽段。在其蛋白酶切割位点用d-对映体或色氨酸取代,且在末端酰胺化和乙酰化得到EFK17 的变体。在酶反应条件下,LL-7 及EFK17 只有不到20%的肽段未被消化,而被d-对映体取代的EFK17 同源物未显示任何明显的蛋白水解迹象。截断也是提高多肽水解稳定性的一种途径。
3.3 提高抗菌活性
AMPs 的抗菌活性与其抑制或杀灭病原微生物的能力紧密相关,宋雪莹等[51]截取Lactoferricin B AMPs 前15 个氨基酸,截取多肽与Lactoferricin B有相同的抗菌活性,经一系列设计连接,合成牛乳铁蛋白素-天蚕素(Lactoferricin B-Cecropin)。抑菌活性试验表明设计的杂合肽Lactoferricin B-Cecropin 具有更明显的抗菌活性,且在抑菌浓度范围内几乎无溶血作用。Kim 等[52]合成的杂合AMPs HP-ma 的抑菌活性是HP 和Magainin 的2-32 倍,HP-MA 对囊泡裂解比HP 和Magainin 更有效。荧光各向异性法检测结果表明HP-MA 比Magainin 具有更大的膜裂解活性。
AMPs 在细菌感染等潜在临床治疗中仍存在许多缺点,将其与商业抗生素结合使用或许是有效的解决途径之一。Arenas 等[53]采用化学合成了4 种AMPs,分别为Pin2[G]、Pin2、P18K 和FA1。4种AMPs 对单一的微生物具有很好的抑制效果,肽FA1 对铜绿假单胞菌抑菌效力最大,Pin2[G]抗金黄色葡萄球菌活性最好。为得到抗菌效果最佳的AMPs,将AMPs 与8 种商用抗生素(阿莫西林、阿奇霉素、头孢曲松、庆大霉素、左氧氟沙星、磺胺甲恶唑、甲氧苄啶和万古霉素)组合。根据分级抑菌浓度指数,FA1 与左氧氟沙星和磺胺甲恶唑的组合具有最佳的抗菌效果;FA1 或Pin2[G]与其他抗生素的组合表明,这些组合的总抑制作用大于AMPs或抗生素单独作用的总和。
3.4 降低毒性
在开发AMPs 类药物过程中,AMPs 具备天然的优良特性,但也存在一定的缺点,除了抗菌活性低外,部分AMPs 对细胞还有毒性的影响。Van Dijk 等[54]研究了Cathelicidin 类AMPs 铰链区的氨基酸被取代后对细胞毒性的影响,发现鸡红细胞在含40 μmol/L 的CATH-2 条件下有26%的细胞被裂解。在相同浓度下,甘氨酸取代脯氨酸后的肽引起的溶血减少至10%,而被亮氨酸取代的肽没有导致溶血现象。
Nagarajan 等[55]使用最大共同子图法(maximum common subgraph approach)设计了AMPs,通过优化现有子图形的叠加来生成新的图形,以便在新设计中表示最多的数据库子图形。设计得到的最优肽为Ω76,重复使用亚致死剂量Ω76 处理的小鼠未显示出慢性毒性的迹象;且在小鼠中对碳青霉烯(Carbapenem)和替加环素耐药的鲍曼不动杆菌(tigecycline-resistant Acinetobacter baumannii)表现出较高效力;与亚致死粘菌素剂量同时使用的亚致死W76 剂量,无附加毒性。这些结果表明Ω76 具有潜在的补充或替代粘菌素的作用,特别是在肾毒性方面。
4 展 望
AMPs 是非常具有潜力的能代替抗生素的蛋白类物质,但在作为临床药物的开发过程中存在许多问题亟需解决,首先AMPs 类药物产量低,生产成本高;其次是分子机制和作用机理尚不明确,限制了其作为药物在临床的安全使用;第三,兼具高抗菌活性、广抗菌谱和低毒性等优点的新型AMPs 还有待进一步研究。未来在以下方面着力有望加速AMPs 在生产实践中的应用。
4.1 开发表面固定化技术
研究表明[56],固定化抗体技术通过以一种正确的空间取向将抗体固定到固相表面,在完全保留抗体构象和活性的同时最大化抗体的结合能力,展现出良好的应用前景。AMPs 具有广谱活性、快速杀菌、生物相容性好和耐药能力强等优点,是一种极具应用前景的固定化材料。开展AMPs 表面固定化技术研究,将其固定在生物膜表面,可以较传统技术延长其作用时间和维持有效的作用浓度,也有利于可聚合阳离子(Abominable polycation)的生物相容性问题。同时,固定化肽可以以多种方式影响细菌细胞,从基因组重编程(genome reprogramming)到细菌死亡。提高对固定化AMPs 抗菌效果及作用机制的研究,对优化固定化AMP 具有指导意义,并为AMPs 抗耐药性的发展提供新的思路。
4.2 研究AMPs 的缓控释新剂型
缓释制剂能在长时间内持续放药达到长效作用,控释制剂能在预定的时间内使药物按照预定的速度释放,血药浓度可长时间维持在有效浓度范围之内。目前,AMPs 类药物存在用药稳定性的问题,因而无法掌握药物剂量的使用。将AMPs 药物与缓控释技术相结合,可使抗菌药物持续释放,以此调节宿主的免疫反应,并大大降低手术和受伤后获得性感染的发生率。同时,这种方法可能潜在地减少对抗生素耐药性的发展。近年来,使用纳米包封技术治疗性抗感染创面敷料的研究体系逐渐形成,研究人员基于诱导AMPs 基因表达和纳米纤维包封技术的研究,提高了宿主免疫反应,可从许多方面攻击病原体而不是像传统抗生素那样的单一,从而限制了抗性细菌的选择。
但是迄今为止,很少有研究考察由纳米材料形成的免疫调节化合物的包封性在诱导AMPs 生产中的作用。展望未来,需要多学科团队利用体外和体内模型进行临床前研究,研究多种免疫调节剂联合应用于抗菌药物生产,重要的是还需要进一步的研究来优化化合物的包封和释放。
4.3 机器学习设计全新的AMPs 分子
随着计算机和大数据科学的发展,以机器学习为代表的人工智能技术在分子设计和分子改造中的应用越来越广泛,并日益突出其相对于传统分子设计方法的准确高效的优势。机器学习的核心在于系统计算法,用计算的方法来模拟人类的学习行为——从历史经验中获取规律(或模型),并将其应用到新的类似场景中,其优点可以概括为大数据、大模型、大计算。在大数据方面,运用基因组、宏基因组、蛋白质组、代谢组学和抗菌谱研究数据,开展AMPs 基因、蛋白质分子与抗菌谱关联分析,从海量数据中获取候选分子关键信息;在大模型方面,基于细菌、病毒和肿瘤细胞生物膜的结构特征,建立膜-AMPs,AMPs-受体蛋白互作模型,开展分子动力学研究;在大计算方面,可以综合考虑多物种的AMPs、受体分子和生理环境(pH 值、渗透压、离子强度等)因素,模拟在体作用机制。
可以预见,随着大规模分子筛选、人工智能及合成生物学等新技术的不断进步,AMPs 应用于临床,在更大范围和更深广度上代替抗生素的时间不会遥远,人类也会得到更安全更环保的优质水产品。

