光活化农药作用机理的研究进展
张筑宏,吴接呈,骆焱平
海南大学植物保护学院,海南 海口 570228
光敏剂(photosensitizers,PS)在可见光区和近紫外光区能有效吸收光子,对细胞、病毒、生物体具有杀伤作用,或能够诱发对此条件敏感的生物分子的化学修饰作用的一类物质。由于光敏剂本身无或有较低的生物毒性,故可利用其在可见光谱区下毒性增强的特点间接杀死细胞。光敏剂多用于肿瘤疾病的治疗,利用光照激活在癌细胞上特异性积累的光敏剂,产生活性氧杀死癌细胞,称为光动力治疗[1]。2018 年首个用于临床的光敏剂是TLD1433(含钌的多吡啶化合物)[2]。在光照和分子氧存在下,如果光敏剂用来杀死害虫、杂草或病原菌,通常称为光活化农药(photoactivated pesticides)[3]。1978 年Berenbaum[4]报道了呋喃香豆素类化合物——花椒毒素(xanthotoxin)对亚热带黏虫(Spodopteraeridania)幼虫的光活化毒性,表现出生长抑制作用,至此陆续从数千种植物中发现了植物源光敏化合物,其中不少化合物对农业昆虫有光毒杀作用,从而引起农药科研工作者对光活化农药的重视。
1 光活化农药的作用机理
光活化农药是一类具有杀虫、抑菌、除草效果的光敏剂,而光敏剂是一种光敏分子,其一旦受到一定波长的可见光或近紫外光照射,便会吸收光子能量,引起电子跃迁,从基态单重态转变为激发单重态。激发单重态非常不稳定,可通过发射光子失去能量从而返回基态,或发生系间窜跃,成为较稳定的激发三重态,激发三重态除了以辐射形式发射光子并释放能量跃迁回基态外,也可将激发三重态的能量转移到另一个处于基态的三重态分子上。
在光敏反应中,光活化农药吸收光子能量受到激发,转变为激发态的光敏化合物,在不同的反应环境下,激发态光敏化合物能发生2 种不同的光敏氧化反应,即Ⅰ型和Ⅱ型反应[5](见图1)。在Ⅰ型反应中,激发态光敏化合物(单重态或三重态)能从邻近还原剂NADH(nicotinamide adenine dinucleotide)或NADPH(nicotinamide adenine dinucleotide phosphate)中获得电子,转化为自由基阴离子,或是通过传递氢原子产生自由基[5-6]。产生的自由基和自由基阴离子可进一步与氧反应,转移电子,产生活性氧(reactive oxygen species,ROS),其主要是一些超氧阴离子。尽管这些超氧阴离子不会直接损害生物系统,但其可以产生过氧化氢(H2O2),造成机体很强的氧化损伤。在Ⅱ型反应中,光敏化合物同Ⅰ型反应一样首先以光为激发因子,转变成激发单重态,并系间窜越成激发三重态。激发三重态的光敏剂分子将能量转移至基态的三线态氧,生成单线态氧(1O2),并与底物反应生成氧化产物,而激发态光敏分子则恢复到基态。1O2以生物膜为靶标,引起生物膜不饱和脂肪酸、甾醇、游离氨基酸和蛋白质中氨基酸残基的氧化,造成生物膜和细胞器结构与功能的破坏[7]。这种利用光活化能量催化氧分子形成1O2进攻生物大分子的作用方式称为光动力学反应。此外,Ⅱ型反应同Ⅰ型反应一样,也能产生ROS,ROS 通过破坏脂质、蛋白质和核酸等生物大分子而诱导细胞毒性,并通过凋亡和非凋亡途径导致细胞死亡。Ⅰ型和Ⅱ型反应可同时发生,何种反应占主导取决于光敏剂的类型、浓度和氧的浓度,以及所涉及的靶标细胞的基因型和抗氧化能力[8]。
Ⅰ型和Ⅱ型反应均是光敏剂在有氧气存在的条件下,与氧反应生成氧化产物,故而曾经一度认为氧气是光活化毒杀过程中必不可少的条件。但随着对光敏氧化机理认识的逐步深入,后来的研究结果证明即使在无分子氧存在的条件下,光活化农药也能发挥其毒杀作用,称为III 型反应[6]。即T1光敏剂在无氧气的情况下与生物分子直接反应。例如,3,4-吡喃酮和含4,5-呋喃双键的呋喃香豆素类化合物在紫外光(ultraviolet A,UVA)照射下,在光反应位点与胸腺嘧啶的5、6 位置上的双键通过[2+2]环加成反应,生成DNA 单加合物,而形成的单加合物继续吸收第二个UVA 光子,进一步与DNA 互补链上的胸腺嘧啶反应,产生链间交联并阻止DNA 的复制[9]。这种光活化反应依赖于吡喃酮和呋喃环双键的存在,形成的双加合物仅仅在某些线性构型中发生,并且与核苷酸序列有关[3]。此外,大多数Ⅰ型反应的光活化农药受光激活后,可与细胞器和细胞核反应,嵌入DNA双链形成共价加合物,干扰RNA 转录与DNA 复制,产生遗传性毒性,并伴随氢原子和电子转移生成自由基和自由基离子。将这种不需氧参与形成具有毒性的中间产物的反应,称为光活化诱发毒性反应。
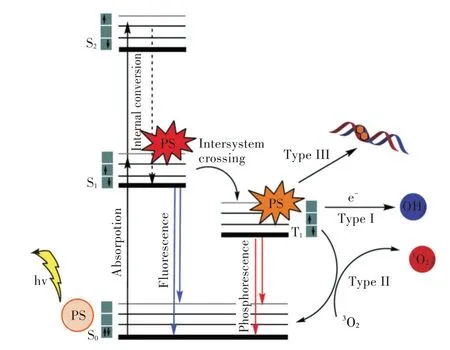
图1 光敏剂涉及的反应[6]Fig.1 Processes involved in photosensitizer
2 光活化农药的结构类型
2.1 5-氨基乙酰丙酸
5-氨 基 乙 酰 丙 酸(5-aminolevulinic acid,δ-ALA)是四氢吡咯的前缀化合物,也是生物体合成叶绿素、血红素、维生素B12 等必不可少的物质[10],广泛存在于动物、植物及微生物细胞中。δ-ALA 在生物体内可以通过血红素、叶绿素等生物合成途径积累足够数量的内源性光敏剂四吡咯化合物,并在光照下诱导产生1O2,对细胞造成氧化损伤。由于δ-ALA 的光敏特性,在自然界中易降解、无残留,对人畜无毒性,故其作为一种环境友好型的光活化农药备受关注。在农业生产中,由于低浓度的δ-ALA 通过提高硝酸还原酶的活性来调节叶绿素的合成,并提高光的效率、促进植株呼吸等基础生理活性,故δ-ALA 可作为植物生长调节剂促进作物生长,进而提高作物产量与品质[11]。此外,添加外源δ-ALA 可有效清除植株体内的活性氧,降低膜脂过氧化损伤程度,从而缓解盐胁迫对植株生长的抑制,提高植物对环境的适应性[12]。
δ-ALA 在生物膜中扩散能力差,只有使用高剂量的δ-ALA,才能使其达到足以进行光活化毒杀的水平防治农业害虫。为此许多文献报道了δ-ALA衍生物的研究工作。如通过添加2,2'-联吡啶作为诱导剂诱导δ-ALA 转化成四氢吡咯2(图2),可增强对害虫的光动力活性。Rebeiz 等[13]将40 mmol/L δ-ALA 和30 mmol/L 2,2'-联吡啶溶液在14 h 光照/10 h 黑暗下处理粉纹夜蛾幼虫,发现黑暗条件下化合物3(原叶琳IX)在虫体内大量富集,87 h 后对粉纹夜蛾幼虫毒杀效果达到80%。Kloek 等[14]对5-氨基乙酰丙酸的羧酸和氨基进行修饰,合成出几种潜在的光敏化合物4(图2)。Kolossov 等[15]通过对羧酸(即R1)用甲基、乙基、丁基修饰,合成具有光敏杀虫和除草活性化合物。
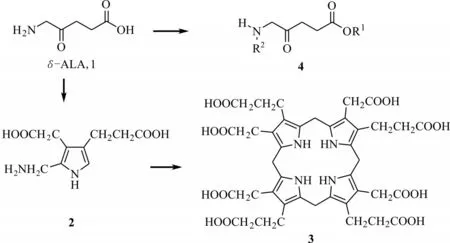
图2 δ-ALA 及其衍生物的合成途径Fig.2 Synthesis of δ-ALA and its derivatives
2.2 卟啉类化合物
卟啉是一类通过次甲基将4 个吡咯环相连形成的共轭骨架大环化合物,卟啉类化合物多为天然产物,在自然界中卟啉化合物构成了血红蛋白、叶绿素及细胞色素等生物大分子的核心部分,并参与生物体内重要的生物合成[16]。由于卟啉类化合物含大π共轭骨架,其在紫外可见光区对光子有强吸收,能够产生高量子产率(≥0.7),且长寿命的激发三重态,并产生1O2对生物体造成光敏损伤,而无光照时卟啉类化合物无毒性[17-18]。卟啉类化合物大多来源天然产物,也可进行结构修饰,合成卟啉类衍生物。Tosk 等[19]以血卟啉为基本骨架合成出血卟啉衍生物,发现在光照下,化合物5(图3)对致倦库蚊幼虫的毒杀活性显著。陈志龙等[20-22]对卟啉进行修饰与改造,合成了卟啉类似物6、7、8(图3),这类化合物不仅能够抑制癌细胞增殖,对果蝇也有优良的毒杀活性。
卟啉类化合物叶绿素a 的降解产物脱镁叶绿酸a、二氢卟吩及紫红素-18 等衍生物均有较好的光活化特性。吴铁一等[23]利用激光光解时间分辨吸收技术和自旋捕获EPR 技术对叶绿素衍生物9(焦脱镁叶绿酸-a)的光活化机制进行了研究,发现该化合物在实验检测的波长范围内都有较强的吸收,且三重激发态的量子产率高,并通过与基态氧发生能量转移生成的1O2造成有效损伤,故焦脱镁叶绿酸-a 可作为一种较好的光活化农药加以使用(图4)。沈生荣等[24]研究了焦脱镁叶绿酸-a 对粉蚊夜蛾的Tn-5B1-4 细胞有显著的光活化毒性,发现其对鳞翅目害虫具有显著胃毒作用。陈志龙等[25]以蚕砂为原料提取叶绿素a,经降解处理,制备叶绿素衍生物10(紫红素-18),表现出较好的光活化杀虫特性。此外,以蚕砂叶绿素为原料,在浓碱溶液中加热水解后酸化,合成的叶绿素降解产物11(二氢卟吩e6)对尖孢镰刀菌(Fusarium oxysporum)菌丝径向生长和分生孢子萌发具有光敏抑制作用[26]。
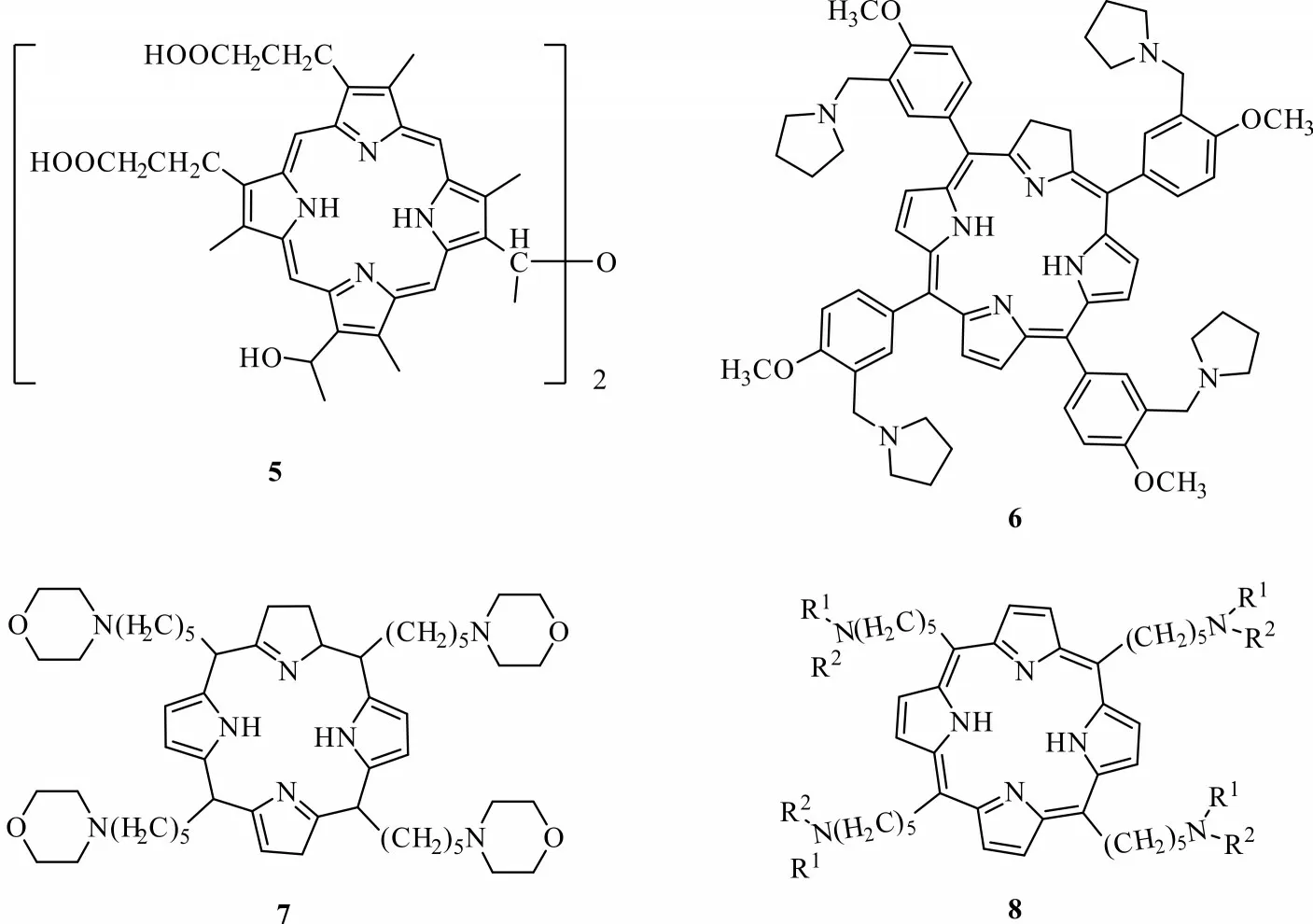
图3 卟啉类衍生物的结构Fig.3 Structures of porphyrin derivatives
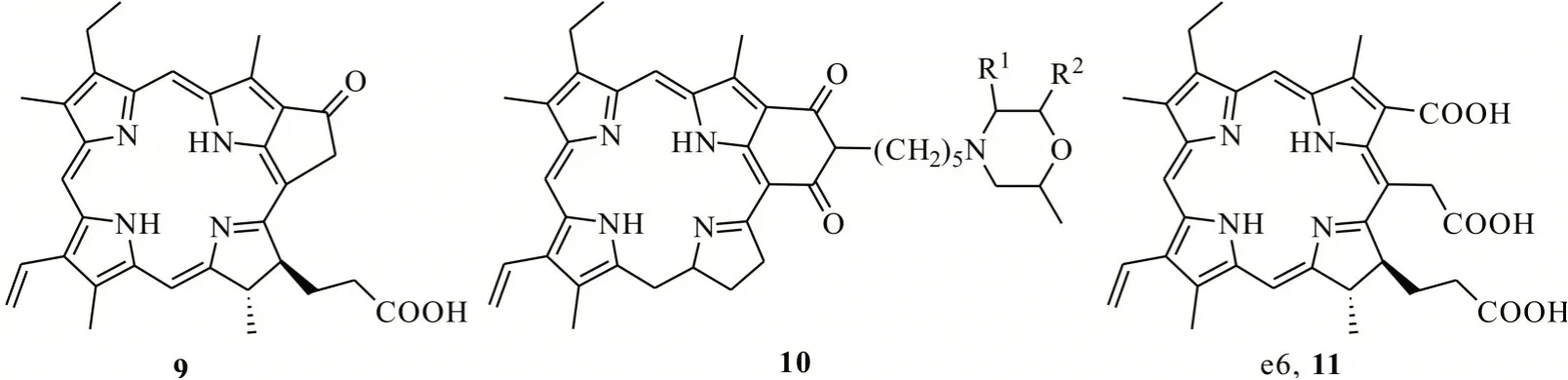
图4 叶绿素衍生物的结构Fig.4 Structures of chlorophyll derivatives
2.3 噻吩、噻唑、噁唑、噻嗪类化合物
2.3.1 噻吩类 噻吩类化合物大量存在于菊科植物中,对多种传病蚊虫、线虫、螨类具有很好的光敏杀虫活性,代表性光活化农药是α-三联噻吩(α-T),光活化比在18.0~555.6 之间[3]。基于α-T优良的光敏特性,国内外研究者以α-T 为先导化合物,对其结构进行修饰,引入具有良好生物活性的官能团或多元杂环,合成α-三联噻吩类衍生物,以此提高其光敏毒杀活性和广谱性。Burkart 等[27]将菊酯类二卤乙烯基连接到噻吩的2 位,合成出5-芳基-2-卤乙烯基噻吩衍生化合物12(图5),在紫外光照射下,在100 mg/L 质量浓度下,2-(2,2-二溴乙烯基)-4-甲基-5-苯基噻吩粉剂能够100%杀死二斑叶螨。Burkart 等[28]进一步合成了R 为羟基,R1为甲基,R2、R3为苯基时的噻吩衍生化合物13,研究发现在质量浓度50 mg/L 条件下,化合物13 在紫外光照射后48 h,能100%杀死对有机磷农药产生抗性的二斑叶螨。
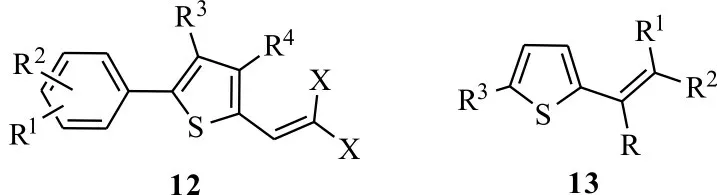
图5 噻吩类化合物的结构Fig.5 Structures of thiophene compounds
Morand 等[29]对α-三联噻吩的2 位和2'位进行修饰,合成出α-三联噻吩衍生化合物14,当R1为甲基,R2为氢时的衍生化合物对伊蚊幼虫24 h 的急性光活化毒性LC90为0.209 mg/L(图6)。徐汉虹课题组将氨基甲酸酯类的杀虫活性结构引入到噻吩中,设计出氨基甲酸多联噻吩酯类化合物15,该类化合物由于兼具氨基甲酸酯的高效杀虫特性和三联噻吩的光敏特性,使得此类结构对致库倦蚊4 龄幼虫的杀虫活性进一步增强,并延缓抗药性产生[30]。该课题组在α-三联噻吩中间插入炔键,合成了α-三联噻吩类似化合物16,随后用苯基和芳基替换两端的噻吩,合成了系列化合物17、18,并发现化合物16、17、18 中芳环含供电子基时,对小菜蛾3 龄幼虫具有很好的光敏毒性[31]。该课题组在化合物18 的基础上,将天然的除虫菊酯结构偶联到α-三联噻吩类似物中,得到菊酯类化合物19,并对斜纹夜蛾细胞SL 具有很强的光活化毒性,与天然的除虫菊酯活性相比,其对细胞的毒性差异不显著[32]。罗志刚等[33]以α-三联噻吩为先导化合物,分别合成两类含3,5-二芳基异噁唑的化合物21 和含3,5-二芳基吡唑啉的化合物22,其中化合物21(R=OCH3)光照前后对斜纹夜蛾卵巢细胞毒性差异为64.06倍,而吡唑啉类衍生化合物22 整体显示出较高的细胞毒杀活性,其中化合物22(R=CH3)光照细胞毒杀活性为83.9%。袁李青等[34]以2,6-二氯-4-三氟甲基苯胺和溴代噻吩等为起始化合物,合成出12 种未报道过的噻吩芳基吡唑类化合物23,通过测定了化合物的光活化杀虫活性,发现目标化合物均具有一定的光活化杀虫活性,其中化合物23(R3=Bu)的光照组与黑暗组LC50值差异表现最为明显,表现出明显的光活化性质。另外,一些噻吩类衍生物如2,5-二苯基噻吩在紫外光照射下对稗草和马唐有很强的抑制作用[35]。江定心等[36]合成了一系列4 炔基硅烷类化合物,其中化合物20 对4龄伊蚊幼虫具有很强的光化学毒性,光化学毒性比原来增强了69.58 倍。
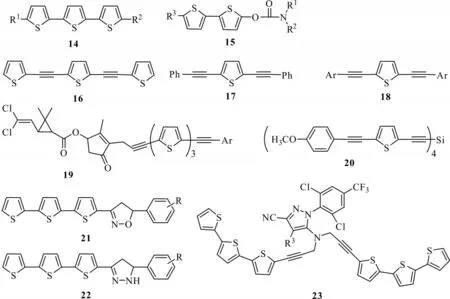
图6 α-三联噻吩类衍生物结构Fig.6 Structures of α-trithiophene derivatives
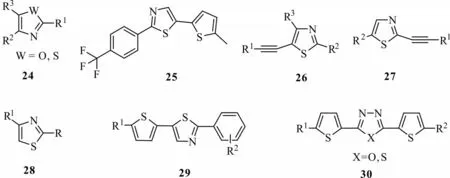
图7 噻唑、噁唑类衍生物结构Fig.7 Structures of thiazole and oxazole derivatives
2.3.2 噻唑、噁唑类 作为噻吩的电子等排体噻唑、噁唑类化合物,被设计合成并显示较好的光活化活性。Lutomski 等[37]设计合成的化合物24(图7)在光照下显示杀虫、杀螨、杀线虫的活性,而在100 mg/L 质量浓度下,化合物25 在UV 照射下,对二斑叶螨有明显毒杀作用。在前期研究的基础上,Lutomski 等[38]将炔键插入噻唑结构中,合成噻唑衍生化合物26、27,这两类结构具有光动力杀螨和杀虫活性,特别是化合物26,当R1=Ph、R2=4-ClC6H4、R3=H 时,在50 mg/L 质量浓度下,化合物26 经过48 h 光照后能100%杀死二斑叶螨,并能杀死20%的粉纹夜蛾,其活性比化合物25 有显著提高。Singh 等[39]合成的噻唑类化合物28 与Lutomski 等合成的化合物24 类似,不同之处是化合物28是噻唑与噻吩连接修饰的部分较多,此类结构对蚊子幼虫有显著的光化学毒性。Lutomski 等[40]进一步合成了噻吩偶联噻唑类化合物29,当R1=CO2Et、R2=4-CF3时,在200 mg/L 质量浓度下,化合物29 经UV 照射后,能有效杀灭70%的粉纹夜蛾。钱旭红课题组[41]合成了以噻二唑或噁二唑偶联三联噻吩类似物30,发现这类结构对2 龄南方粘虫有很好的光活化毒性,并对pBR322 质粒DNA 有光裂解效应。
2.3.3 吩噻嗪类化合物 吩噻嗪类化合物由于含有氮和硫原子,电子富集程度高,波长较长,可作为光敏剂使用[42]。如亚甲蓝(methylene blue,31)作为一种光敏药物在光照下能与病毒核酸的鸟嘌呤结合,引起病毒核酸链断裂并抑制核酸复制,从而灭活血浆病毒[43](图8)。农用活性方面鲜有报道,Heitz 等[44]报道了亚甲蓝对黄粉虫有光活杀毒性,Sobotta 等[45]报道了吩噻嗪类化合物32 和苯并吩噻嗪类化合物33 显示很好的抗菌、抗病毒、抗癌等光敏活性。
2.4 苯炔类
苯炔类化合物也是一类重要的光活化农药,如1-苯基-1,3,5-庚三炔34 表现出优越的光化学活性,对蚊子、苍蝇等幼虫有很强的光活化毒性[46]。徐汉虹课题组[47]发现从猪毛蒿(Artemisia saparia)精油中提取的活性成分茵陈二炔(1-苯基-2,4-己二炔)对斜纹夜蛾3 龄幼虫有光活化毒杀活性。该课题组将氨基甲酸酯类活性基团与炔烃相连,设计出光活化杀虫剂氨基甲酸多炔苯酯化合物35,该化合物可以提高对致倦库蚊的杀虫活性,并能延缓致倦库蚊对此类杀虫剂的抗药性[30]。此外,还合成了双苯炔苯类化合物36,但其光化学活性较α-三联噻吩差[31]。进一步将菊酯类农药活性基团连接到炔烃上,合成出氯丙炔菊酯的二炔衍生化合物37(图9),在500 μg/mL 质量浓度下处理斜纹夜蛾细胞,光照24 h 后,表现出良好的抑制活性,抑制率可达92.95%[48]。
2.5 苝醌类化合物
苝醌衍生物是以4,9-二羟基-3,10 苝醌为骨架的一类化合物,广泛分布于真菌及动植物体内,其光敏特性研究起始于食草动物取食金丝桃属植物后,在光照下表现出发热甚至死亡现象。自然界中许多种属的真菌均能产生苝醌类次生代谢产物,其中多种苝醌类化合物具有良好的光敏特性,如竹红菌甲素(hypocrellin A,38)、竹红菌乙素(hypocrellin B,39)、弗来菌素(phleichrome,40)、枝孢素(cladodrome,41)、痂囊腔菌素(elsinochrome,42)、尾孢素(cercosporin,43)(图10)。而植物次生代谢产物金丝桃蒽酮(hypericin,44)、昆虫次生代谢产物喇叭虫素(stentorin,45)和蚜红素(aphins,46)及 菌 生 素A(hypomycin A,47)、菌 生 素B(hypomycin B,48)也具有一定的光敏特性。其中竹红菌素类作为光活化农药研究较多,张志义等[49]研发了一种含竹红菌甲素的杀虫剂,它不仅对棉铃虫有很好的防效,而且对棉花不易产生药害,对天敌有保护作用。张红雨等[50]研制了一种含多种苝醌衍生物的光敏杀菌剂,可抑制多种病原真菌菌丝生长,且毒性低,可用于蔬菜、瓜果的病害防治。赵井泉等[51]研发的一种含竹红菌乙素的杀虫剂,对棉铃虫也有一定防效。尽管苝醌类化合物在自然界中广泛分布,但其量有限;尽管可以通过化学合成,但工艺复杂,成本过高,故很大程度上限制了苝醌类光活化农药的应用研究。目前大多通过发酵等生物合成方式获取苝醌类化合物,主要在农药复配中使用。一方面能增强农药药效,另一方面发挥光照下光活化毒性效果。
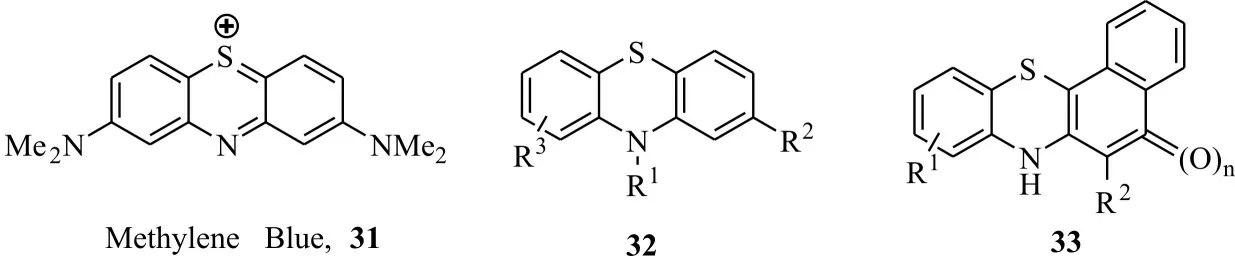
图8 吩噻嗪类衍生化合物Fig.8 Phenothiazine derivatives

图9 苯炔类衍生物结构Fig.9 Structures of phenyne derivatives
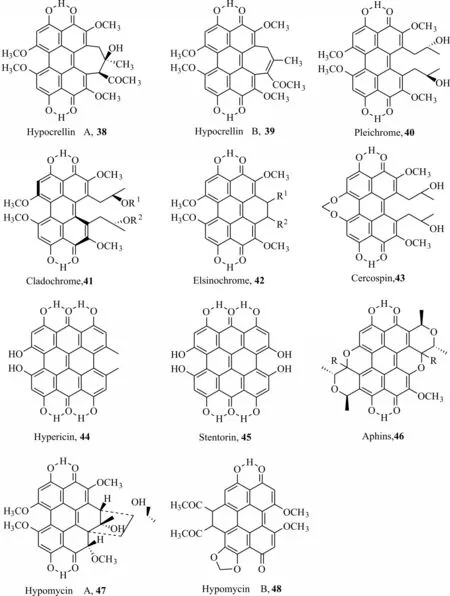
图10 苝醌类衍生物的结构Fig.10 Structures of perylene quinones derivatives
2.6 黄素类化合物
石炭酸灌木是一种生长在沙漠中的高大树木,会分泌出一种有毒的油,杀死它附近生长的所有植被[44],从该家属植物中分离出有很好光化学活性的姜黄素49(图11)。姜黄素广泛分布于姜科姜黄属植物如姜黄、莪术、郁金等根茎中的天然酚类物质,具有抗炎、抗氧化、抗菌及抑制癌细胞生长等多种药理作用,多用于医疗保健[52]。研究发现姜黄素是一种潜在的光敏剂,其在波长470 nm LED蓝色光源下,可激活姜黄素发挥其光敏活性[53]。基于姜黄素良好的光化学活性,不少研究者将其作为重要的先导化合物。刘志昌等[54]将姜黄素中1,3-二酮修饰成嘧啶结构,合成了姜黄素取代嘧啶类衍生物50,在农用或兽用中作为杀菌或杀虫剂。黄齐茂等[55]利用姜黄素结构中的酚羟基通过共价键连接溴代烷烃桥连卟啉,合成了新型姜黄素桥连卟啉光敏剂51,且该光敏剂与DNA 结合能力较强。
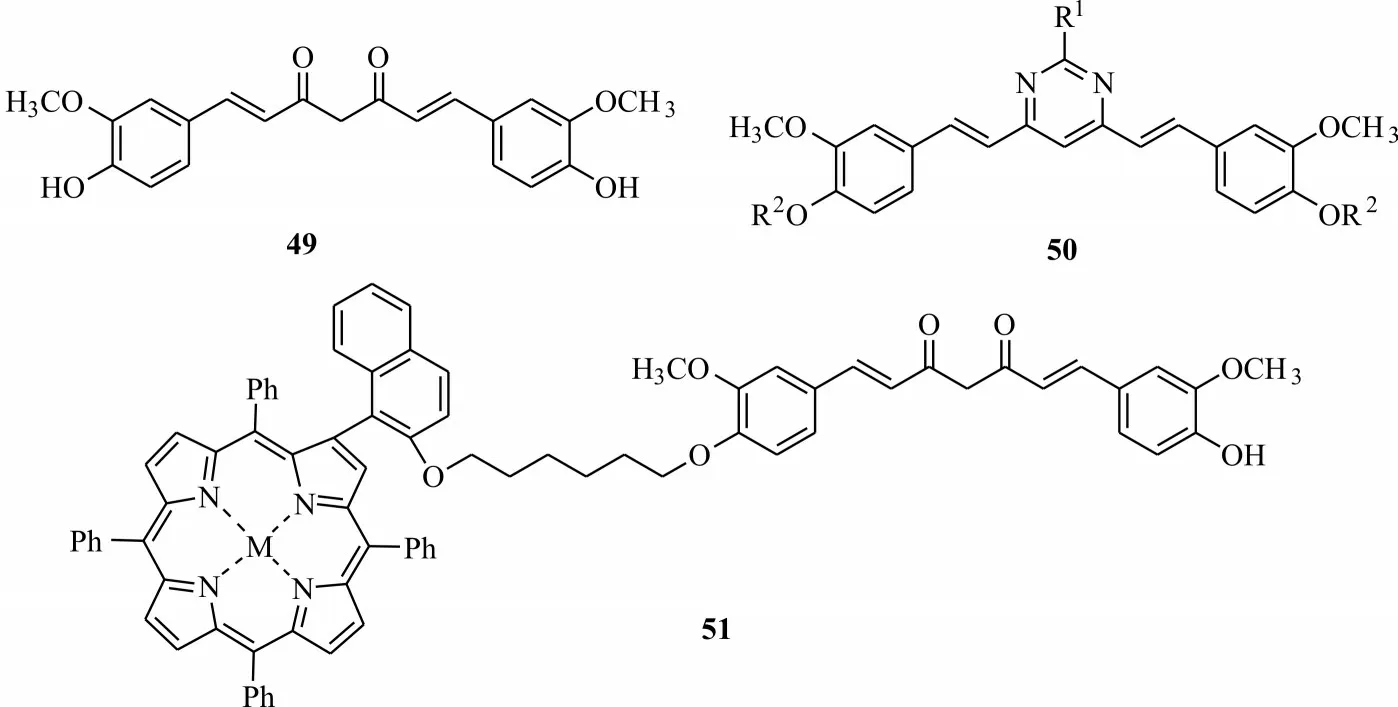
图11 姜黄素类衍生物结构Fig.11 Structures of curcumin derivatives
2.7 呋喃并香豆素类化合物
呋喃香豆素类化合物广泛存于自然界中,是芸香科和伞形科的特征性次生代谢产物,目前分离获得200 多种呋喃香豆素类化合物。Kuske 发现从佛手柑果实中分离出的佛手柑内酯具有光活化特性,并首次发现了呋喃香豆素具有光敏活性[56]。随后,发现了许多呋喃并香豆素具有光活化毒性,如化合物52、53,呋喃并色酮类化合物54等(图12)。尽管呋喃并香豆素类化合物可用于光动力治疗,但其光敏特性会损害人体皮肤,甚至引起局部皮肤疾病。一些研究通过对呋喃香豆素的两个双键进行修饰合成呋喃并香豆素类衍生物,避免其同时与DNA 双链上的碱基发生反应形成双交链物,从而避免人体产生癌变、皮肤疾病等副作用。呋喃并香豆素类化合物在光活化农药上的研究源于Berenbaum 报道花椒毒素52 对亚热带黏虫幼虫的光活化毒性,但后续研究发现植物源呋喃并香豆素类光活化农药对昆虫的光毒作用不如对哺乳动物显著。由于天然呋喃并香豆素类化合物的农用活性不理想,可通过增加其结构中的π共轭体系,合成呋喃并香豆素类衍生物,增强此类化合物对光的吸收,增强光敏活性。
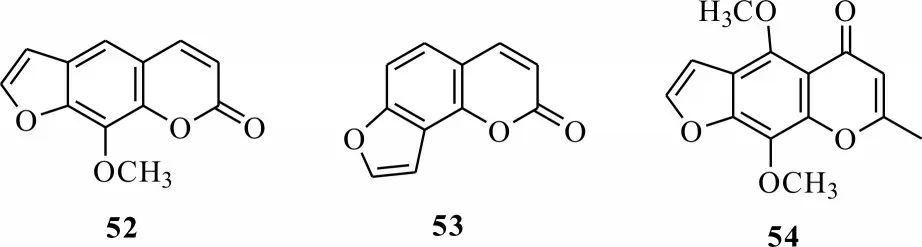
图12 几种香豆素类化合物Fig.12 Several coumarin compounds
2.8 染料杀虫剂
对光敏剂杀虫活性的发现最早是从一些染料光敏性质开始的,其中杀虫活性最好的是卤代呫吨类染料,此类化合物属于合成类光敏毒素,包含伊红-Y(eosin-Y,55)[57]、伊红(eosin,56)[58]、赤藓红(erythrosine B,57)[59]和玫瑰红(rose bengal,58)[60](见图3)。最早发现该类物质对家蝇有很好的光化学毒性,随后对黄粉虫、象鼻虫的光化学活性测试表明,该类物质在光照下杀虫活性增强。
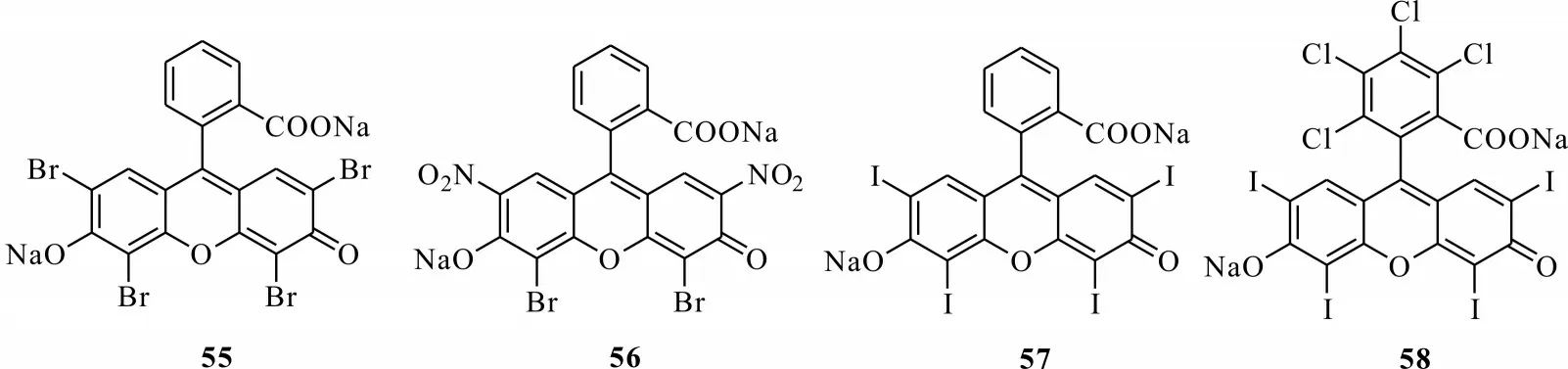
图13 几种卤代呫吨类合成染料Fig.13 Synthetic dyes of several halogenated xanthene
3 展 望
光作为农田生态系统中最基本的环境因子对农药药效有重要影响。由于部分农药见光易降解,导致药效降低;但随之出现农药难降解、长时间残留等环境污染问题,使得农药研发由光稳定型向光活化型方向转变。光活化农药以光为激发因子发挥其光敏活性,其本身不直接参与毒性反应,仅作为传递光子能量的介质,发挥活性作用。该过程也是活性成分本身光降解的过程,故其环境兼容性好,避免了在环境中的持久残留。此外,由于光活化农药依靠光激发下产生1O2或自由基,可直接破坏生物膜和生物大分子结构,使其具有高效的毒杀作用,而Ⅰ型和Ⅱ型的独特作用方式使活性氧和自由基产生的作用位点多,故昆虫不易产生抗性,同时也不易与化学合成农药产生交互抗性。尽管光活化农药具有传统农药无法比拟的优点,但大多数光活化农药的活性成分只能被紫外光激发,在阴雨天不能很好发挥活性,易受天气限制。国内外研究者通过化学结构修饰,合成了噻吩、苯炔、萘并吡喃类衍生物,并发现了一些光敏毒性较好的光活化农药。此外,对光敏剂作用机制研究更深入的是在医学领域,而在农林领域主要是对蚊蝇等卫生害虫做研究,故今后应增强对其他有害生物的毒杀作用研究,并加强在细胞水平及亚细胞水平上作用机制的系统研究,加快光活化农药从试验研究向田间应用的转换。

