鱼木高效可持续离体快速繁殖研究*
汤 聪 梁韩枝 黄嘉琦 谭嘉川 胡 秀
(1.广州建筑园林股份有限公司,广东 广州 510030;2.仲恺农业工程学院,广东 广州 510225)
鱼木(Crateva formosensis)是山柑科(Capparaceae)鱼木属(Crateva)多年生落叶乔木。该属在全世界有8 个种、4 个变种,其中有5 种分布于中国[1]。鱼木的花序大、花丝长而纤细、开花繁茂,是优良的木本观花植物。鱼木还是一种药用植物。从鱼木树皮提取的羽杉醇具有抗炎、抗菌、抗肿瘤、利尿、降血压以及降低胆固醇含量的作用,果皮具有抗真菌作用[2-3]。鱼木的座果率和种子萌发率都很低,自然更新较为困难[4-6],人工繁殖的效率也很低,加上由于药用开发而进行的过度采伐,目前已经被列为“稀少植物”。离体培养快速繁殖对于自然繁殖周期超过一年的植物种类,具有明显优势。目前,在同属植物中沙梨木(Crateva nurvala)、树头菜(Crateva unilocularis)等,以枝条、插穗为外植体,建立了无菌繁殖体系[7-8]。在同属植物中,现有外植体的取材受季节性限制很大,无菌处理繁复且困难,离体培养时增殖率偏低,无菌苗生根质量不理想,使得鱼木属植物商业化栽培仍然无法实现。就鱼木而言,国内外均未见有关离体培养的报道。本研究拟从外植体选择、诱导增殖、生根这几个方面入手,建立高效的鱼木离体快繁体系。在外植体选择方面,尝试选择来源丰富的侧根,在控制条件下诱导半木质化茎段,再取新枝的茎段为外植体,以此提高无菌处理效率[9];在诱导阶段,由于侧根扦插诱发的萌枝内源激素含量不及截干后的萌枝,在外源激素的选择上,除了使用同属植物离体诱导中常用的BA 和NAA 之外,拟添加对外源激素具有促进作用的TDZ 进行辅助;在增殖和生根阶段,拟采用适当提高外源激素浓度促进增殖,在生根前再进行壮苗获取适宜生根的半木质化无菌苗的策略。以下是详细报道。
1 材料与方法
1.1 材料
鱼木(Crateva formosensis),来源于广东省台山市,为根插繁殖获得的萌枝,高30~40 cm,枝条半木质化。根段的扦插选用来源丰富、对树体损伤较小的侧根进行;扦插时在温室进行,避免受到雨水污染;灌溉时采用无菌水,且仅湿润基质,避免喷洒萌发出的新枝;保持温室相对湿度为60%以下,避免滋生霉菌。
1.2 方法
1.2.1 初代培养 取根段萌发的半木质化茎段为外植体,75%(v/v)酒精消毒10-15 s,无菌水漂洗1 次,无菌滤纸吸干,0.1%(w/v)升汞浸泡8 min,无菌水漂洗7 次,无菌滤纸吸干,切成1.5 cm 左右并带一个节的茎段,接种于添加不同质量浓度的BA、NAA、TDZ 及其组合的培养基中(表1)。基本培养基为MS,添加蔗糖30 g/L、琼脂7 g/L,pH 调整为5.6-5.8。每瓶接种1 个,每个处理接种30 瓶。在温度为23-25 ℃、光照12 h/d、光照强度1 500~2 000 lx 条件下培养30 d 后,统计腋芽萌发率、增殖系数并观察生长情况。
1.2.2 继代增殖 取上述最优培养基上形成的长势良好的植株,切取大小相近的侧芽,接种于含不同质量浓度BA、NAA 与GA3及其组合的培养基上培养(表2)。每瓶接种3 个,每个处理10 瓶。继代间隔为30 d,继代3 次。分别在每次继代结束后观察记录其长势并统计其丛生芽增殖系数与玻璃化率。将长势一致的玻璃化苗移植于不含任何激素的MS 固体培养基中,每瓶接种3 个,共40 瓶。30 d 后观察记录其生长情况并统计其玻璃化率。
1.2.3 壮苗及循环继代 将玻璃化苗转接于不含任何激素的MS 空白培养基中进行壮苗培养,培养时间为40 d,每瓶接种3 个,共40 瓶。30 d 后观察记录其生长情况并统计其玻璃化率。
1.2.4 壮苗及生根 将带2-3 个节的健壮苗转接于空白培养基上进行壮苗,诱导半木质化苗,培养时间为30 d。将非木质化和半木质化的无菌苗,分别接种于添加不同质量浓度的IBA (0.5、1.0、1.5 mg·L-1)的1/2MS 与MS 培养上(表3)进行生根诱导培养,研究不同木质化程度和外源激素对生根率和生根系数的影响,培养时间为40 d。
1.2.5 炼苗和移栽 待幼苗4-5 cm 高时,打开培养瓶瓶盖,在室内放置3 d,使幼苗初步适应外界环境。再从培养基中取出幼苗,用无菌水洗去附着的培养基,移栽到泥炭土∶细沙(v : v =2 : 1)的土壤中。初次移栽时浇透水,以后每天采用喷雾的方法保持土壤湿润。30 d 后统计幼苗的成活率并记录其长势。
1.2.6 数据统计和分析方法 用DPS(version 7.05)软件,采用Duncan 新复极差法进行方差分析,显著性水平为0.05,结果用“平均值±标准误”表示。
腋芽诱导率/%=(萌芽数/接种数)×100;
芽增殖系数=新增芽数/接种数;
玻璃化率/%=(30 d 后的玻璃化幼苗数/30 d 后的总幼苗数)×100;
生根率/%=(生根的个体数/接种数)×100;
生根系数=侧根总数/接种数;
移栽成活率/%=(成活植株数/移栽数)×100;
2 结果与分析
2.1 初代培养
通过避免扦插时接受雨水污染,控制浇水用水的来源及环境湿度,根段扦插后的半木质化阶段无菌处理污染率小于5%。茎段培养5 d 后,各处理侧芽均开始萌动,培养30 d 后侧芽均可萌发,萌发率均为100%,但增殖系数有显著差异。未添加任何激素处理组,外植体及其萌发的侧芽逐渐黄化死亡,增殖率为0(表1)。各处理腋芽萌发为枝条(图1,A,B),部分处理新枝的腋芽也能萌发。剪切外植体萌发的枝条为节及剥取二次发生的腋芽(图1,B)可用于进一步继代。从增值系数上看,BA 质量浓度一定时,添加NAA 或TDZ 对芽的增殖系数无显著影响,但添加TDZ 诱导出的芽体粗壮,新枝的腋芽能二次萌发(图1,B),增殖芽质量好。当BA 质量浓度为0-2.0 mg·L-1时,芽增殖系数随着BA 质量浓度的升高而增加,但随BA 质量浓度的升高,植株叶片开始黄化,脱落。最高的芽增殖系数配方为:MS+BA 1.0mg·L-1+NAA 0.1 mg·L-1+TDZ 0.1 mg·L-1,可达6.35,但叶片皱缩不舒展,部分出现玻璃化的现象,虽然在MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1+TDZ 0.1 mg·L-1的培养基上培养外植体其芽增殖系数仅为4.11,但叶片翠绿舒展,长势良好,可以用于进一步的继代增殖。

表1 激素配比对鱼木初代诱导的影响Table 1 Effect of different phytohormone and their combination on shoots induction in primary culture
2.2 继代增殖
继代培养时,添加BA 与NAA 的处理组其芽增殖系数显著高于单独添加BA 的处理组(表2)。在MS+BA 0.5 mg·L-1+NAA 0.01 mg·L-1的培养基上培养的芽增殖系数最高,可达12.09,但玻璃化程度也较高。同时添加BA 和NAA 时,随着BA 与NAA 的比例增大,芽增殖系数与玻璃化程度呈增长趋势。添加GA3对芽增殖系数无显著效应,但可以促进节间伸长。综合增殖系数、芽体生长状态以及后续培养目标,适宜后续持续增殖的培养基为MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1,适于后续壮苗生根的培养基为MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1+GA30.5 mg·L-1。

表2 激素配比对鱼木继代增殖的影响Table 2 Effect of different phytohormone and their conbination on multiple shoots
2.3 壮苗及循环继代
选取完全玻璃化的植株(图2,C1)于MS 不含任何植物激素的培养基内培养,在培养5-10 d 的时候,植株的叶片出现脱落的情况,但新长出的芽点为绿色(图2,C2)。在培养12-20 d 的时候,新芽的叶片舒展,植株的茎杆开始由原来的黄色变为黄绿色。培养40 d 后植株长势良好,叶片翠绿舒展,增殖系数为2.8(图2,C3)。将复壮后的无菌苗切为带一个芽的茎节,转接于增殖培养基上进行循环继代。
2.4 壮苗及生根培养
非木质化的无菌苗在生根培养基中逐渐黄化死亡(图1,F-b)。以半木质化的无菌苗为材料的各处理在培养7-12 d 开始生根,生根均十分迅速。在培养40 d 后观察可知,当IBA 质量浓度在0.5-1.5 mg·L-1的范围时,生根率和生根系数与IBA 质量浓度呈正相关性,IBA 质量浓度越高则生根率与生根系数越高。在1/2 MS+ IBA1.5 mg·L-1的处理中,生根率与生根系数最高,分别可达92%与6.33(表3)。当IBA 质量浓度相同时,在1/2MS 培养基上形成的根短小而密集(图1,G),而在MS 培养基上形成的根相对粗长,但生根系数较低(图1,F-a, b),表明鱼木的生根率和生根系数受IBA 质量浓度和培养基中大量元素的双重影响,综合生根系数及根生长状况,适宜的生根培养基为1/2 MS+ IBA1.5 mg·L-1。
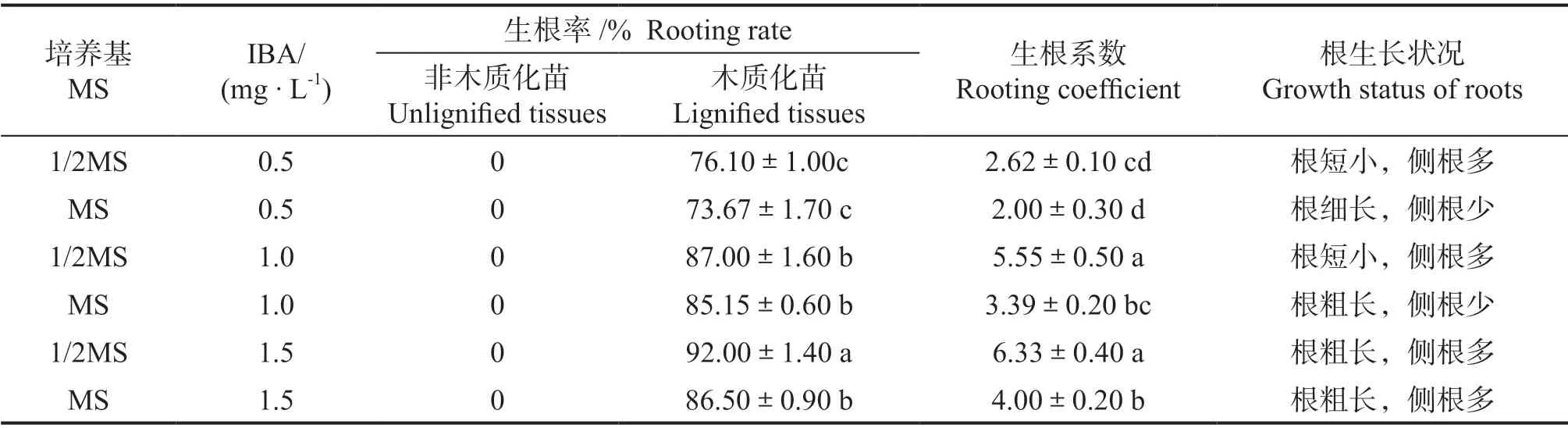
表3 IBA 浓度及基本培养基对鱼木无菌苗生根的影响Table 3 The effect of different medium supplementing with different concentration of IBA on rooting of C. formosensis excised stems
2.5 炼苗和移栽
打开培养瓶的瓶盖,放置于温室进行炼苗。3 d 后,用自来水冲洗根部附着的琼脂,把小苗移栽于花盆中。盆栽基质配比为 : 泥炭土 : 细沙=2 : 1(体积比)。保持土壤湿润,空气相对湿度为90%以上。一周后可逐渐降低空气相对湿度。30 d 后移栽成活率为100%,小苗长势良好(图1,G)。

图1. 鱼木无性系组培育苗过程Fig.1 Tissue culture and seeding raising of Crateva formosensis

图2 鱼木植株壮苗及循环继代过程Fig.2 The process of plant growing and recycling
3 结论与讨论
3.1 外植体的无菌处理是建立离体培养体系的第一步,也是非常关键的一步。对选用茎段为外植体的木本植物而言,无菌体系的建立尤其困难。幼嫩的茎段带菌少、无菌处理容易,但是该类茎段内源激素和营养贮备都明显不足,侧芽难以萌发;木质化的茎段萌发正常但带菌多且难以去除。因而,大多数研究都采用半木质化的茎段为外植体,既能确保侧芽萌发、又能获得一些无菌苗。尽管如此,在无菌处理时半木质化外植体污染的比例仍然很高。对鱼木属的植物而言,在自然条件下以枝条的茎段为外植体时,10—11 月取材污染最小,但在培养过程会有较多的渗出物和褐化现象;1—8 月取材不会有渗出物和褐化现象,但5—8 月的污染率很高,8 月取材污染率为100%,1—3 月为休眠期,因而较为理想的取材时间是3—5 月新枝初展的季节。Neetika[10]选取30 年生的成年大树,于5—7 月取材,以枝条顶端以下第6-9节为外植体。印度的Sharma[11]为了获得较好的无菌处理效果和诱导率,不得不将外植体的取样时间限制在特定的季节(10—11 月),取材部位限定在萌枝上的第6-10 节,并且对萌枝的成熟度也进行了限定,仅萌枝的生长时间只能为40-50 d。此外,很多研究着力于去筛选合适的无菌处理剂及处理浓度、处理时间,或采用尽可能多的无菌处理剂和处理方法进行组合处理,但这不是无菌处理的关键。无菌体系建立的关键是获取带菌少的外植体。本研究采用人工方法促发带菌少的新枝,待半木质化后取材接种,无需繁复的无菌处理步骤,即可获得100%的无菌率,且外植体腋芽均可顺利萌发。采用侧根扦插人工促发的条件包括:避免接受雨水污染、采用无菌水灌溉、灌溉时避免喷洒新枝、保持空气相对湿度低于70%。控制新枝被污染的方法是尽可能的降低新枝的湿度,避免环境中的微生物在枝条上过度繁殖和附着。
3.2 TDZ 最初作为除草剂使用,后来被发现具有促进细胞增殖的作用。在木本植物的离体诱导上具有很好的效果。但TDZ 本身并不是一种细胞分裂素,TDZ 是通过加强占主导作用的激素而起作用的,效用决定于细胞分类素和生长素的比例关系。与BA 相比较,TDZ 的用量比较低,通常在0.01-0.1 mg/L。在已有的鱼木属植物的离体繁殖中,TDZ 曾单独用于叶柄不定芽的诱导,本研究结果将TDZ 配合BA 和NAA 使用,诱导侧芽萌发为枝条,与之类似。与未使用TDZ 的研究相比, 本研究使用了较低的BA 浓度(0.5 vs 2.0-4.0),在增殖阶段也使用了较低的BA 浓度(0.5 vs 2.0)。这一差异显示在BA 占主导地位的情况下,TDZ 具有很强的促进细胞分裂的作用。对比增殖阶段的BA 用量发现,本研究使用了较低的浓度获得了较高的增殖率,显示TDZ 的效用在继代过程中有传递现象。
3.3 空白培养基的作用主要是释放前一阶段无菌苗体内累积的外源激素,在本研究中主要用于降低在继代过程中由于外源BA 累积,以使复壮后的无菌苗可进一步继代或用生根。在继代培养中随着次数的增加,外源激素在无菌苗中不断累积,其作用效果趋向于占主导作用的激素的效果。本研究中随着BA 在植物体内的累积,随着继代次数增加无菌苗出现了不同程度的玻璃化。玻璃化现象在Panwar 等在同属的沙梨木的离体培养中也被观察到,表明鱼木属植物在离体培养时较容易产生玻璃化现象[12-13]。但玻璃化并不影响增殖,也比较容易恢复正常。将玻璃化苗转接于不含激素的空白培养基培养40 d 左右可恢复为正常苗,从而可继续继代或进入生根阶段。
3.4 Neetika[10]与Sharma[5]相似,认为采用成年大树新生枝条为外植体,通过降低增殖阶段的外源激素,并在此培养基上进行循环继代即可一步成苗,并认为以此可以缩短增殖的时间,提高增殖率。然而从Neetika 研究中可以看到,由于在增殖阶段降低了细胞分裂素的使用,在相同的继代时间内,增殖率较Sharma[11]的有所下降。此外,在采用无菌苗的叶片和节进一步在相同培养基上进行诱导,芽诱导率从初代诱导的 80%上升至100%,芽的长度则将下降。Neetika 研究显示在循环继代多次以后,必然要增加促进芽伸长的继代环节。因此,从较长时间段来看,Neetika 的增殖率并不比Sharma[5]的高。植物离体快速繁殖,从大的方面可以分为愈伤组织发生途径和器官发生途径。二者之间除了是否经历脱分化以外,最大的区别在于,愈伤组织发生途径的增殖是通过细胞增殖,器官发生途径是通过芽的增殖或无菌苗节间的伸长来完成。也因此,由于细胞增殖的速度快,愈伤组织发生途径的增殖速度要远高于器官发生途径。同理,从较长时间内来计算,将作为增殖单位的芽控制在比较小的体积的增殖方案,增殖率较高。本研究也采用了与Neetika 相似的增殖策略,将作为增殖单位的芽控制在比较小的体积,30 d 平均增殖10 倍左右。当继代两出现玻璃化时,通过在空白培养基上培养对无菌苗体内的累积的外源激素进行释放,再进行反复继代。当需要生根移栽时,选择健壮的无菌苗在MS + BA 0.1 mg·L-1+ NAA 0.1 mg·L-1的培养基上壮苗为半木质化苗再转入生根培养基。
3.5 在大多数木本植物中,离体培养的无菌苗的生根都很困难。几乎所有研究都着力在基本培养基的类型、生根激素的种类选择和浓度配比上进行优化。这些优化确实能够提高生根率和生根系数,然而对一些生根困难的种类仍然无法达到理想效果。在鱼木属中,目前获得的最高的生根率是Benniamin[14]在Crataeva magna 中,以MS 为基本培养基添加9.84 -2.0 μmol IBA 和 0.54-0.1 umol NAA 获得了70 % 的生根率,平均每株的生根率为3 条。Sharma[11],以MS 5.37-1.0 μmol NAA 或不添加 NAA,在添加2.22-4.44 μmol BA 的培养基上获得的苗生根率只有30% ,但是从添加低浓度的BA 培养基(0.22-0.44 μmol) 上获得的苗生根率可以达到 70% 。我们在预实验中发现,生根的植株都是半木质化或木质化的无菌苗。事实上很多木本植物在扦插繁殖时,对插条的要求必须是半木质化的枝条。因此,生根诱导的影响因素除了基本培养基的类型、生根激素的种类选择和浓度配比以外,准备生根用的无菌苗本身的状态必须是半木质化的。本研究获得了很好的生根率,一方面可能是使用了半木质化的无菌苗,另一方面可能是生根前半木质化的苗是采用空白培养基继代壮苗后获得,细胞分裂素含量较低。本研究的结果也表明,未木质化的无菌苗在所用培养基上逐渐黄化死亡,只有半木质化的无菌苗才能生根。本研究通过对生根用苗进行壮苗处理获得半木质化苗,优化基本培养基类型和IBA 的使用浓度,获得了可商业化应用的生根技术方案,为鱼木的离体培养的商业化栽培成为可能。
3.6 采用鱼木根段扦插后萌发的半木质化新枝为外植体,可有效获得带菌少的外植体,同时来源丰富、不受季节限制、无菌处理简单,增殖率高且可进行持续增殖,生根率和生根质量高,最适的初代培养基为MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1+TDZ 0.1 mg·L-1,适宜后续持续增殖的培养基为MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1,适于后续壮苗生根的培养基为MS+BA 0.5 mg·L-1+NAA 0.1 mg·L-1+GA30.5 mg·L-1。适宜的生根培养基为1/2 MS+ IBA 1.5 mg·L-1。通过上述操作,可有效满足鱼木规模化生产用苗。

