鸭蛋卵清蛋白的结构、组成分析及其功能活性研究
王 倩,贺 萍,林如歌,曾凡珂,刘 琪,赖富饶,*,张晓元,吴 晖,,*
(1.华南理工大学食品科学与工程学院,广东广州 510640;2.韶关市华工高新技术产业研究院,广东韶关 512027)
新鲜鸭蛋中蛋清约占全蛋重量的57%,蛋白质含量为10%~13%,脂肪含量约为0.25%,碳水化合物约为1.8%、无机盐0.7%。另外还含有尼克酸、核黄素、生物素等多种营养物质[1]。鸭蛋蛋清中的蛋白质可分为40多种,主要为糖蛋白,其中卵清蛋白占54%、卵转铁蛋白占12%,类卵黏蛋白占11%,卵黏蛋白占3.5%,溶菌酶占3.5%。鸭蛋的营养价值与鸡蛋相当,含有人体必需氨基酸,属于全价蛋白[2],卞立红[3]对市售各种蛋类蛋品质进行分析发现,鸭蛋蛋清在鸭蛋中相对重量为52.76%、在放置15 d后蛋白含量仍然有6.7 g/100 g,具有较好的营养价值。周有祥[1]的研究表明鸭蛋蛋的蛋白质水平与鸡蛋相当,矿物质水平较高,而粗脂肪含量更低,鲜鸭蛋可以作为鸡蛋的有益补充,秦婧[4]报道了卵清蛋白具有抗氧化、降血压、免疫调节、血管紧张抑制等生物生理功能,鸭蛋卵清蛋白含量高,营养价值好,还具有抗氧化等生物活性,具有较好的研究价值。
文献中报道的卵清蛋白主要纯化方法如盐沉淀法、等电点沉淀法、聚乙二醇分离、液相色谱法、分子排除液相色谱、超滤、吸附等,硫酸铵沉淀蛋白质的方法因其步骤简单高效的优点仍被广泛应用。傅冰[5]将鸡蛋清原液用pH9.00的Tris-HCl缓冲液稀释,后用60%饱和度的硫酸铵沉淀分离卵清蛋白,操作简便纯度高。闻崇炜[6]利用不同pH下聚乙二醇(Polyethylene glycol,PEG)对蛋清中卵清蛋白、卵转铁蛋白、溶菌酶三种蛋白的的沉淀效率,采用连续分离法分离出三种蛋白。Patrick[7]、Settu[8]、Omana[9]报道了利用卵清蛋白和溶菌酶、卵转铁蛋白在不同的水溶性两相系统中分配系数的差异,从而达到纯化目标蛋白的方法。Dileep[10]采用阴离子交换色谱法从蛋清中连续分离出了卵清蛋白、卵转铁蛋白、溶菌酶等组分,采用盐析法价格低廉且操作简便,在文献中多有报道。
目前,关于禽蛋卵清蛋白的研究主要集中在蛋白的理化性质改良、卵清蛋白的致敏、禽蛋贮运保鲜、酶解制备生物活性肽等方面。Tang[11]研究了磷酸化对卵清蛋白的表面特性和乳化性的影响,发现磷酸化程度的增加使得卵清蛋白的粒径减小,从而提高了其乳化能力。Flavia等[12]利用热处理卵清蛋白,制备出一种作为多不饱和脂肪酸的纳米载体的自组装纳米颗粒。郭立华[13]研究了卵清蛋白与Fe3+进行螯合形成一种新型复合物,可以充当补铁制剂。Siriporn等[14]采用阴离子交换色谱法对鸵鸟蛋清中的主要成分卵清蛋白(OOW)进行了纯化,再进行40 ℃碱性水解8 h后的产物其ACE抑制活性最佳,IC50值为63.97 μg/mL。虽然关于鸡蛋卵清蛋白和鸭蛋蛋清蛋白的报道很多,但是对于鸭蛋卵清蛋白本身的结构研究和活性研究并不多见。本文主要比较了三种提取鸭蛋卵清蛋白的方法,并分析了鸭蛋卵清蛋白的二级结构和营养学评价,最后对其免疫活性、抗氧化活性进行了探究,以期为鸭蛋卵清蛋白的应用提供理论基础。
1 材料与方法
1.1 材料与仪器
新鲜鸭蛋 采购于五山农贸市场;OVA标准品(纯度≥95%)、大豆分离蛋白(SPI)(BR级)、Trolox、荧光素钠、2,2′-偶氮(二异丁基脒)二盐酸盐(AAPH) 上海源叶生物科技有限公司;RAW264.7细胞 为本实验室保存;硫酸铵、PEG 4000 分析纯,国药集团化学试剂有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)、2,2′-联氮双(3-乙基苯并噻唑啉)二胺盐(ABTS) Sigma公司。
KDN-102F半自动定氮仪 上海纤检仪器公司;Infinite M1000 Pro酶标仪 瑞士Tecan公司;Avatar-370型傅立叶变换红外光谱仪 美国Nicolet公司;J-815型CD仪 日本JASCO公司;Heracell 150i二氧化碳培养箱 美国Thermo fisher scientific;日立L-8900氨基酸分析仪 日本日立。
1.2 实验方法
1.2.1 卵清蛋白提取方法的探究 参照秦婧[4]、岳喜庆[15]、宋宏新等[16]的方法略做修改。首先取300 g鸭蛋蛋清将其均分为三组,命名为A、B、C,分别进行如下处理。
A组、B组均用5倍水稀释后,分别调节其pH为9.00、4.50,之后置于磁力搅拌器中以20 r/min的速度搅拌30 min后,缓慢加入硫酸铵至溶液饱和度60%,搅拌30 min,4 ℃冰箱静置6 h,8000 r/min离心10 min后取沉淀,放入Mw为3000 Da的透析袋中透析,冻干后称重计算得率后置于-20 ℃冰箱中保存备用。
C组用2倍水稀释后,调节pH到7.50,8000×g离心20 min,在上清液中缓慢加入50%的PEG 4000贮存液至其质量分数为12%,8000×g离心20 min,去上清液,pH调至5.50,8000×g离心20 min收集上清,冻干后称重计算得率后置于-20 ℃冰箱中保存备用。
1.2.2 蛋白含量的测定及得率的计算 参照GB/T 5009.5-2016《食品安全国家标准食品中蛋白质的测定》中的凯式定氮法[17]。
得率(%)=提取后蛋白质量/(蛋清质量×0.54×0.1)×100
1.2.3 蛋白分子量和纯度测定 SDS-PAGE电泳法[18]。取10 μL样品,加入2 μL的上样缓冲液,煮沸后进行点胶,分离胶12%、浓缩胶5%,电压80 V/120 V。用染色液考马斯亮蓝R-250振荡染色2 h,然后过夜脱色。
1.2.4 蛋白的氨基酸组成和营养成分分析 取一定量的蛋白,加入5 mL 6 mol/L的 HCl,在105 ℃水解 24 h。将水解样品定容到50 mL,取3 mL在60 ℃干燥后溶解在1 mL的样品缓冲液中,过0.22 μm滤膜后装入液相小瓶中采用全自动氨基酸分析仪测定。
1.2.5 蛋白的FT-IR分析 将2 mg鸭蛋卵清蛋白与200 mg KBr充分混匀,压片,置于红外光谱仪的变温附件中于 4000~500 cm-1范围内扫描。
1.2.6 圆二色谱分析 将鸭蛋卵清蛋白配制成500 μg/mL溶液,过0.45 μm滤膜,取200 μL进行检测。扫描波长为190~260 nm,谱带宽度为1.0 nm,扫描速率100 nm/min,连续扫描3次取平均值。
1.2.7 扫描电镜 取1 mg蛋白固定在托盘上后,用喷金仪对样品进行喷金,接着在电镜下进行扫描拍照,观察蛋白表面形貌。
1.2.8 蛋白的免疫活性评价 参考Wu[19]的方法。将细胞浓度为1×106个/mL的RAW 264.7细胞细胞悬液接种于96孔板中(100 μL/孔),置于CO2培养箱培养24 h后,吸去培养基,加入100 μL不同浓度(1000、500、250、125和62.5 μg/mL)的鸭蛋卵清蛋白溶液,阳性对照组为20 μg/mL的LPS,空白组为DMEM培养基,再培养24 h后收集细胞上清液,用试剂盒分别检测细胞上清液中NO和细胞因子TNF-α和IL-6的表达量。
1.2.9 蛋白的抗氧化活性评价
1.2.9.1 DPPH·清除能力 参考You等[20]的方法。取样品稀释液2 mL,加入2 mL 0.2 mmol/L DPPH乙醇溶液混匀,室温避光反应30 min后用溶剂作空白对照在517 nm波长测定吸光度,以Trolox作为阳性对照。
DPPH·清除率(%)=[1-(OD样品-OD空白)/OD空白]×100
1.2.9.2 ABTS·清除能力 参考Zhang[21]等的方法,略作修改。取200 μL样品稀释液液加入2 mL ABTS+·反应液混合均匀,室温下避光反应30 min后,在734 nm下测定其吸光值。以Trolox作为阳性对照。
ABTS+·清除率(%)=[1-(OD样品-OD空白)/OD空白]×100。
1.2.9.3 ORAC 法测定样品抗氧化能力 参考王光[22]的方法略作修改,在96孔板中加入25 μL样品(浓度分别为1000、500、250、125、62.5 μg/mL)、403.2 nmol/L荧光素钠25 μL,37 ℃条件下预热5 min后迅速在各孔中加150 μL 17.07 mmol/L的AAPH启动反应,在37 ℃条件在485 nm/338 nm下进行连续测定2 h,每5 min读取一次各微孔荧光值。以Trolox作为阳性对照,同时设定只加荧光素钠的荧光自然衰减组对照、加蒸馏水的空白对照组。
ORAC值=[(AUCsample-AUC+AAPH)/(AUCTrolox-AUC+AAPH)]×(molarity of Trolox/concentration of sample)。
1.3 数据处理
所有试验均做3组平行,结果以平均值±标准方差(mean±SD)表示。采用Origin 8.5、SPSS 17.0进行结果统计。实验数据采用ANOVA进行Ducan’s差异分析,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 卵清蛋白的蛋白含量分析
采用半自动凯式定氮仪测定A、B、C三种方案提取出的卵清蛋白中总氮的含量,其结果分别为84.59%±3.61%、86.75%±4.12%、62.91%±2.04%,采用方案A、B即硫酸铵沉淀法的蛋白含量与李健[23]的卵清蛋白中总氮含量86%接近,但是采用方案C即PEG 4000提取法得到的样品中蛋白含量仅为62.91%,根据闻崇炜[6]的报道,推测其原因可能是用PEG 4000沉淀卵清蛋白时有PEG 4000残留,从而导致总氮含量偏低。干燥后称重,A、B、C三种方法提取蛋白得率分别为85.32%±2.98%、86.17%±2.69%、97.11%±3.05%。
2.2 卵清蛋白分子量和纯度测定
由图1可知,A、B、C三种方法提取得到的卵清蛋白的电泳图谱与OVA标准品SDS-PAGE图谱分布相同,条带均集中于45.0、66.2 kDa,且无其他杂带,说明制备的鸭蛋卵清蛋白的纯度与实验所用的标准品近似,达到了90%以上。此电泳图分布与闻崇炜[8]报道的聚乙二醇提取卵清蛋白,秦婧[4]、李健[23]报道的盐析法分离卵清蛋白的图谱分布一致,表明本研究制备的卵清蛋白纯度较好。且由2.1可知,采用pH4.50、硫酸铵饱和度60%进行提取的方案B的总氮含量高、蛋白得率高,电泳图与OVA标准品最接近,后续采用该方法进行鸭蛋中卵清蛋白的提取。
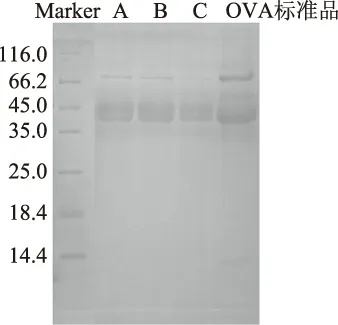
图1 样品SDS-PAGE图谱
2.3 蛋白的氨基酸组成和营养成分分析
大豆分离蛋白(SPI)是一种商用化的蛋白,其氨基酸种类有近20种,含有人体所必需的8种氨基酸,且组成比例接近FAO/WHO推荐模式,营养丰富,是植物蛋白中为数不多的可替代动物蛋白的品种之一,常用于标准蛋白进行营养评分比较,吴丽英等[24]比较了玛咖蛋白与SPI、酪蛋白的营养评分。鸭蛋卵清蛋白的氨基酸组成见表1,与大豆分离蛋白(SPI)相比,本实验提取的鸭蛋卵清蛋白的必需氨基酸总含量超过了SPI,其中蛋氨酸(Met)、缬氨酸(Val)、苯丙氨酸(Phe)、丝氨酸(Ser)、半胱氨酸(Cys)的含量均高于SPI,有研究表明,含硫氨基酸(Met、Cys)可以促进机体生长,促进肠道黏膜的生长发育,促进肠道对营养物质的吸收[25]。鸭蛋中卵清蛋白的含硫氨基酸含量显著高于SPI,为SPI的6.7倍,且E/N、E/T比值均高于SPI,这表明鸭蛋卵清蛋白营养评分高于SPI。大豆蛋白的第一限制性氨基酸是含硫氨基酸,而这正是鸭蛋卵清蛋白所富含的。鸭蛋中卵清蛋白的第一限制性氨基酸为亮氨酸。与陶志云[26]研究的高邮鸭蛋和金定鸭蛋中蛋清的氨基酸数据进行比较,两种鸭蛋蛋清中必需氨基酸占总氨基酸总量(E/T)分别为43.79%、43.68%、必需氨基酸与非必需氨基酸的比值(E/N)分别为0.77、0.75,此结果略低于与本实验E/T为0.44、E/N为0.81,推测原因是鸭蛋蛋清中卵清蛋白为主要蛋白质,因此提取出的鸭蛋卵清蛋白在营养评分上与鸭蛋蛋清评分相同。

表1 鸭蛋卵清蛋白的氨基酸组成(g/100 g蛋白质)
对比FDA/WHO发布的2~5岁儿童限制性氨基酸推荐值,可以发现在限制性氨基酸中,苏氨酸(Thr)、赖氨酸(Lys)、组氨酸(His)3种氨基酸的含量接近于推荐值,而其余5种必需氨基酸均高于推荐值,异亮氨酸(Ile)、亮氨酸(Leu)、蛋氨酸(Met)、缬氨酸(Val)、苯丙氨酸(Phe)的含量分别是推荐值的1.25倍、2.44倍、3.08倍、2.72倍、4.95倍,因此可将鸭蛋卵清蛋白作为部分儿童的辅食,增强儿童营养健康。
2.4 蛋白的二级结构分析
2.4.1 鸭蛋卵清蛋白的FT-IR分析 鸭蛋卵清蛋白的FT-IR光谱见图2,在1539和1391 cm-1的吸收峰分别是肽链官能团-HN-C=O的反式构型和顺式构型的吸收峰,且1539 cm-1吸收峰强度较高,说明反式构型存在的比例大。有文献报道反式构型的能量比顺式构型低,稳定性强[27],在天然蛋白中比例更大,这表明提取出来的卵清蛋白在提取过程中没有遭到破坏,保持了它本身的天然构象。
蛋白红外光谱的酰胺Ⅰ带位于1600~1700 cm-1,由于蛋白质的三种二级结构(α-螺旋,β-折叠和无规卷曲)的酰胺I振动区域在1645~1680 cm-1范围内彼此交垒,很难进行定量的解析。且极易受到水分子的干扰,定量解析各种二级结构的含量比较困难。因此,对其酰胺Ⅲ带进行进一步的分析[27],蛋白红外光谱的酰胺Ⅲ带位于1220~1330 cm-1,其中,α-螺旋为1290~1340 cm-1,β-折叠为1220~1248 cm-1,β-转角为1265~1290 cm-1,无规卷曲为1245~1270 cm-1。从图2可以看出,鸭蛋卵清蛋白在酰胺Ⅲ带1237 cm-1有吸收,为β-折叠结构,里面可能还含有无规卷曲结构。在1320 cm-1有一个小吸收峰,分析其属于α-螺旋结构,因此初步判断鸭蛋卵清蛋白至少含有β-折叠、无规卷曲结构、α-螺旋三种二级结构。
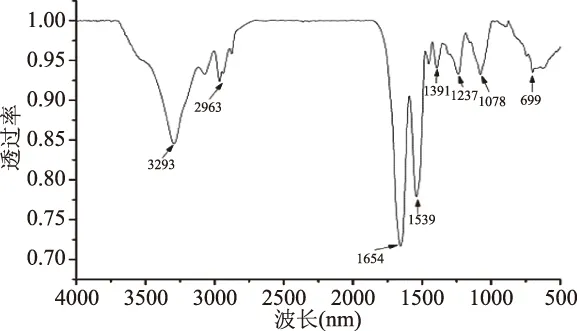
图2 鸭蛋卵清蛋白样品的红外光谱分析
2.4.2 鸭蛋卵清蛋白的圆二色谱分析 蛋白质由于其氨基酸的α-C不对称性和主链构象的不对称而具有光学活性。蛋白质稀溶液在近紫外区和远紫外区谱带位置和吸收强弱可以反应出蛋白质的二级结构和三级结构。卵清蛋白在远紫外区(190~260 nm)的圆二色谱光谱图如图3所示。根据吴丽英[24]的报道,CD谱包含了丰富的二级结构信息。最大吸收峰在220 nm处,在222、208 nm处出现了负峰,为α-螺旋的特征峰,在195~198 nm处正峰为无规则卷曲特征峰。将数据导入CD pro软件,预测二级结构比例,鸭蛋卵清蛋白中四种二级结构分布为:α-螺旋、15.06%,β-折叠、24.69%,β-转角、25.63%,无规则卷曲、33.83%。此预测结果与FT-IR所得蛋白二级结构基本一致。

图3 鸭蛋卵清蛋白样品的圆二色谱分析
2.4.3 扫描电镜分析 扫描电镜可以看出蛋白质的分子微观结构。从图4对鸭蛋卵清蛋白分子微观形态的观察可知,卵清蛋白具有较大的片状结构,表面均匀光滑。此结构与前人文献中报导的豌豆清清蛋白[28]、核桃分离蛋白[29]的表面结构相似,属于清蛋白典型微观结构。

图4 鸭蛋卵清蛋白样品的扫描电镜分析
2.5 蛋白的免疫活性评价
当机体受到外来物质入侵时,巨噬细胞可以通过分泌细胞因子来清除外来物质,也可以通过趋化因子受体将更多的细胞趋化至炎症部位,通过分泌炎症因子来参与炎症反应[30-32]。不同浓度的鸭蛋卵清蛋白对NO产量的影响见图5A。鸭蛋卵清蛋白在不同浓度下促进细胞产生NO的能力均显著优于空白组(P<0.05),且分泌量呈浓度递增趋势,当浓度达到1000 μg/mL时,NO分泌量达到13.84 μmol/L,而LPS阳性对照组的分泌量为20.94 μmol/L,与麦胚谷蛋白[19]相比,其在200 μg/mL时NO的分泌量为14.82 μmol/L,而LPS组的分泌量约为36 μmol/L,NO分泌量随浓度变化趋势与本实验一致,表明鸭蛋卵清蛋白具有促进NO分泌的能力。推测NO分泌量略低于麦胚谷蛋白的原因可能是RAW 264.7细胞经多次传代培养后活力降低,并且有文献报道免疫活性与疏水性有关[33],本实验中鸭蛋卵清蛋白中疏水性氨基酸含量(38.26 g/100 g)也较低,因而出现NO分泌量较低的结果。
巨噬细胞受到外来的刺激时可产生IL-6和TNF-α等促炎因子来发挥炎症反应[34],由图5B、5C可知,RAW 264.7细胞上清液中TNF-α、IL-6浓度具有相同的变化趋势,分泌量随浓度增加而显著上升(P<0.05),且与空白组具有显著差异(P<0.05),表明鸭蛋卵清蛋白刺激下,巨噬细胞能显著分泌细胞因子,参与炎症反应。当样品浓度达到1000 μg/mL时,TNF-α分泌量达到(1008.17±26.93) pg/mL,IL-6分泌量为(421.33±5.22) pg/mL,与LPS阳性对照组TNF-α分泌量(1648.60±37.81) pg/mL、IL-6分泌量(914.23±4.61) pg/mL均差异显著(P<0.05),表明鸭蛋卵清蛋白引起的炎症反应没有LPS剧烈。Zhang[30]研究的玛卡糖蛋白在500 μg/mL时TNF-α分泌量约为1500 pg/mL,而He[31]研究的东革阿里多糖在1000 μg/mL时TNF-α分泌量约为1200 pg/mL,与本实验的TNF-α分泌量相当,表明鸭蛋卵清蛋白与这些样品一样具有一定的免疫调节活性。实验提取的鸭蛋卵清蛋白能促进小鼠巨噬细胞中NO、促炎因子TNF-α、IL-6的分泌,且显著高于空白组(P<0.05),表明鸭蛋卵清蛋白具有激活巨噬细胞来调节细胞免疫反应的潜能。
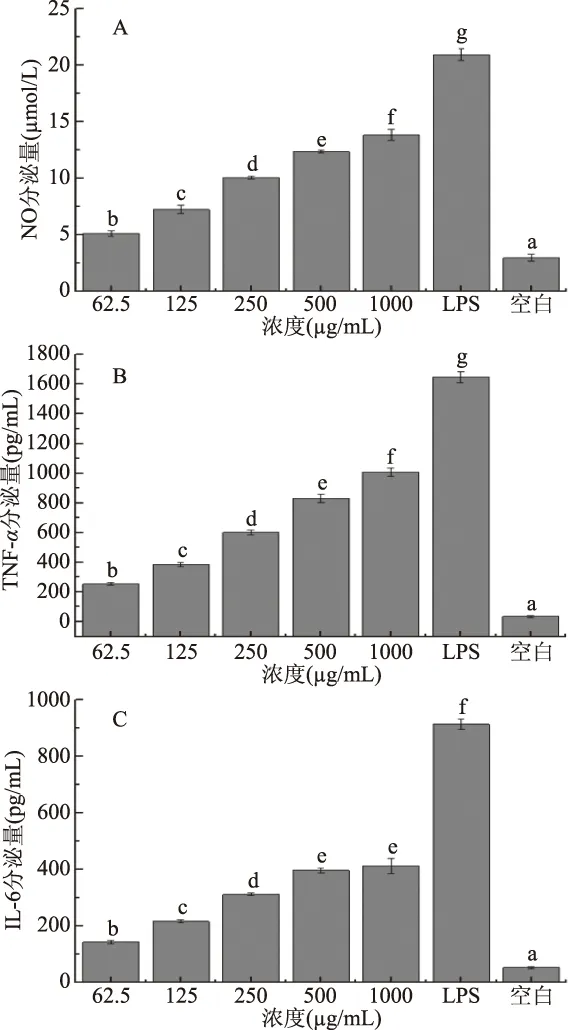
图5 鸭蛋卵清蛋白对RAW 264.7产细胞因子的影响
2.6 蛋白的抗氧化活性评价
样品清除DPPH·和ABTS+·的结果见表2。由表2可知,DPPH·和ABTS+·清除率均存在着剂量效应,当样品浓度到2000 μg/mL时,DPPH·清除率为26.12%±2.20%,低于阳性对照,可能是因为DPPH·清除能力与蛋白的疏水性以及其在介质中的分散性间的平衡有关[35],本实验提取的鸭蛋卵清蛋白的疏水性氨基酸含量相对较低(38.26 g/100 g),而显示出较弱的DPPH·清除能力。而样品浓度达到2000 μg/mL时ABTS+·清除率达到57.05%±4.88%,高于阳性对照组Trolox,表明鸭蛋卵清蛋白在水溶性体系中的具有更好的清除自由基能力。
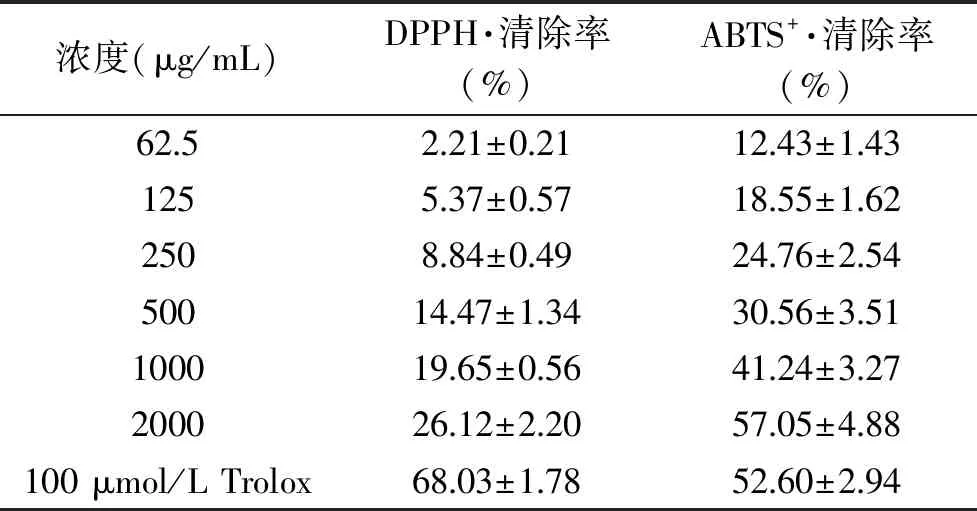
表2 鸭蛋卵清蛋白的抗氧化活性
ORAC分析是体外测定抗氧化能力的一种重要的评价手段。按照公式计算,鸭蛋卵清蛋白的ORAC值为(0.3148±0.0121) μmol/L TE/mg。You[20]报道的鸡蛋溶菌酶酶解产物的ORAC值在0.387~2.774 μmol/L TE/mg之间,略微高于本研究的结果,推测其原因可能是酶解之后一些疏水性强的小肽被释放出来,从而可以更好地淬灭氧自由基,显示出较高的ORAC值。
综合表2和图6的结果可知,样品具有较好的ABTS+·清除能力和较高的ORAC值,但是DPPH·清除率很低,分析其原因可能是鸭蛋卵清蛋白中的疏水性氨基酸含量只占总量的38.26%,其更容易与水溶性体系ABTS+·反应,而与脂溶性体系DPPH·的反应较慢[20],表明鸭蛋卵清蛋白可在亲水性体系中发挥较好的抗氧化活性。
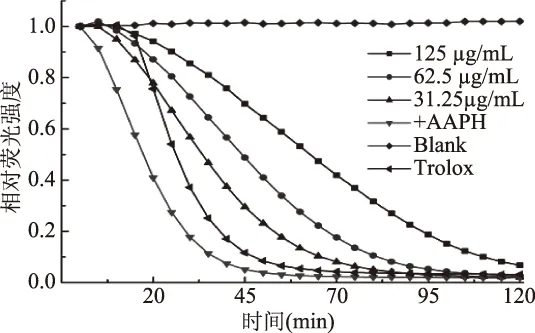
图6 不同浓度样品的化学抗氧化能力指数(ORAC)
3 结论与讨论
本文研究了鸭蛋中的卵清蛋白提取的三种方法,用凯式定氮法测量总氮,SDS-PAGE检验了蛋白的纯度,与标准品进行比对后,发现采用pH4.50、硫酸铵浓度60%的沉淀法获取的鸭蛋卵清蛋白图谱与标准品最接近,无其他杂带,且与秦婧[4]、李健[23]等的图谱一致,表明提取出的鸭蛋卵清蛋白纯度较好,采用pH9.00进行提取的方案A的SDS-PAGE条带与pH4.50进行提取的方案B的SDS-PAGE条带近似,说明采用不同的pH对于卵清蛋白的提取影响不大,但是pH9.00方案的蛋白得率和纯度略微低于pH4.50方案,推测原因是卵清蛋白的等电点为4.50,而蛋清蛋白的pH为9左右,因为在pH4.50时会有更多的卵清蛋白沉淀下来,因而得率较高。
对制备的鸭蛋卵清蛋白的氨基酸组成分析可知,其E/N、E/T比值均高于SPI,与陶志云[26]对两种鸭蛋蛋清中E/T比值(43.79%、43.68%)、E/N比值(0.77、0.75)相比,与本实验E/T为0.44、E/N为0.81结果近似,表明鸭蛋卵清蛋白与鸭蛋蛋清蛋白一样具有较好的营养值,推测其原因是鸭蛋蛋清中卵清蛋白为主要蛋白质,因此提取出的鸭蛋卵清蛋白在营养评分上与鸭蛋蛋清评分相同。
对鸭蛋卵清蛋白进行活性分析,发现鸭蛋卵清蛋白能显著提高小鼠巨噬细胞上清液中NO、TNF-α、IL-6的分泌量(P<0.05),且低于LPS组,表明鸭蛋卵清蛋白可以通过激活巨噬细胞来调节免疫反应,在抗氧化模型中,鸭蛋卵清蛋白的ORAC值为0.3148±0.0121 μmol/L Trolox TE/mg,而2000 μg/mL的样品的ABTS+·清除率57.05%±4.88%,高于Trolox组,但DPPH·清除率26.12%±2.20%,低于Trolox组。推测出现这种实验结果的原因可能是鸭蛋卵清蛋白中疏水性氨基酸含量为38.26 g/100 g,而DPPH体系为脂溶性体系,ABTS+·体系为水溶性体系,因而会在溶解度更高的ABTS+·体系中清除率更高,后续实验也将对鸭蛋卵清蛋白酶解成小分子肽段,进一步提高其抗氧化活性和免疫调节活性。

