体外模拟消化对苹果多酚及其抗氧化活性的影响
朱秀灵,叶精勤,盛伊健,孔雯瑾,陈廷然,傅锡鹏,戴清源
(安徽工程大学 生物与化学工程学院,安徽 芜湖,241000)
植物多酚是植物次级代谢产物的主要成分也是膳食中主要的抗氧化剂[1],在胃肠消化过程中,由于食物基质、pH、温度、吸收抑制剂、吸收促进剂、酶、宿主及其他相关因素的影响,其物理化学性质、稳定性和抗氧化活性均可发生变化[1]。由于体外消化模型不仅价格便宜、操作简单、条件可控、采样容易、结果可重复、不存在道德限制[2],而且对生物利用度的评价结果与人体或动物模型相吻合[1],因此,体外消化模型已被广泛用于预测酚类化合物在胃肠消化过程中的稳定性、抗氧化活性及其生物利用度[3-8]。
苹果是我国也是世界上种植最广泛、消费量最大的水果之一[1, 9],通常以鲜果或其加工品如苹果干、苹果酱、苹果汁及苹果酒等形式在市场上供应。苹果富含膳食纤维和酚类化合物,大量食用,可降低患慢性疾病(如肺癌、哮喘和心血管疾病)的风险[1, 9-11]。苹果中含量最高的酚类化合物是槲皮素(以糖基化形式存在)、儿茶素和表儿茶素,它们是涩味和苦味的重要成分[9]。此外,苹果还含有以酯化形式存在的咖啡酸、奎宁酸(绿原酸)和对香豆酸。苹果皮富含二氢查耳酮类物质如叶绿素及其葡萄糖苷形式存在的根皮苷[9]。由于苹果品种不同、多酚类物质存在部位、提取方法及检测手段的不同,苹果多酚类物质的主要酚类成分及其含量也不尽相同,在机体消化过程中,再加上食品基质的影响,更加难于确定给定剂量的苹果原料在体外消化过程中多酚类物质的变化情况及其与抗氧化活性之间的相关性。
为此,本研究首先提取苹果中的多酚类物质,以富集多酚成分的提取物为研究对象,通过体外消化模型,探讨多酚提取物在不同消化阶段主要酚类物质及其抗氧化活性的变化情况和相关性。研究结果为多酚类物质的生物利用度及生物活性评价提供了参考。
1 材料与方法
1.1 实验材料
新鲜红富士苹果,购于当地大润发超市;胃蛋白酶、胆汁提取物、福林酚试剂,BR级,购于上海瑞永生物科技有限公司;胰蛋白酶,BR级,购于北京索莱宝科技有限公司;原花青素、儿茶素、表儿茶素、绿原酸、咖啡酸、槲皮素、根皮素等标准品,购于上海阿拉丁生化科技股份有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),梯希爱(上海)化成工业发展有限公司;2,2′-联氮双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2′-Azinobis(3-ethylbenzothiazoline-6-sulfonic acid ammonium salt,ABTS)、2,4,6-三(2-吡啶基)三嗪(2,4,6-Tri (2-pyridyl)-s-triazien,TPTZ)、奎诺二甲基丙烯酸酯(6-hydroxy- 2, 5, 7, 8-tetramethylchromane-2-carboxylic acid,Trolox),2,2-偶氮二(2-甲基丙基咪)二盐酸盐 (2,2′-Azobis (2-methylpropionamidine) dihydrochloride,AAPH)、荧光素,上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
L3S型可见分光光度计,上海仪电分析仪器有限公司;JK-400CDB型高功率数控超声波清洗器,合肥市金尼克机械制造有限公司;ZFD-A5140型鼓风干燥箱,上海智城分析仪器制造有限公司;TGL-16G型台式离心机,上海安亭科学仪器厂;FD8-3型冷冻干燥机,美国Sim International Group公司;Prominence LC-20A型高效液相色谱仪,日本岛津;SI-114型电子天平,美国DENVER INSTRUMENT公司;M5型酶标仪,美国Molecular Devices公司。
1.3 实验方法
1.3.1 苹果原料处理
将一定量的新鲜苹果经清洗、干燥后切成条状,于沸水中热烫2~3 min,捞出沥干,平铺于干燥箱托盘上,于85 ℃热风干燥至恒重,粉碎,过100目筛,即得到苹果粉。称取20 g苹果粉于500 mL锥形瓶中,按料液比1∶20(g∶mL)加入体积分数50%乙醇,进行超声提取(超声功率400 W、超声温度控制在50 ℃以下,超声时间30 min)[12],抽滤,收集滤液,将滤液经真空浓缩、冻干,即得到苹果多酚提取物,-20 ℃存放备用。
1.3.2 体外消化
苹果多酚提取物体外消化,参照文献[1]、[8]、[13-16]报道方法,并修改如下:
(1)模拟胃消化 准确称量40 mg胃蛋白酶,用0.1 mol/L HCl溶液定容到10 mL,配制成4 mg/mL胃蛋白酶溶液。称取90 mg NaCl用蒸馏水溶解并定容到10 mL,即得到9 mg/mL NaCl溶液。称量苹果多酚提取物2.5 g,加蒸馏水溶解并定容到10 mL。取3 mL多酚溶液,加入6 mL 9 mg/mL NaCl溶液和6 mL 4 mg/mL胃蛋白酶溶液,用0.1 mol/L HCl调节pH至2.0,取2.00 mL作为胃消化0 h样品。其余溶液置于37 ℃恒温振荡箱中培养1 h,取2.00 mL溶液作为胃消化1 h样品,剩余部分的胃消化液采用1 mol/L NaHCO3调节pH至7.0,用于肠消化。
(2)模拟肠消化 准确称量20 mg胰蛋白酶和120 mg胆酸盐,用0.1 mol/L NaHCO3溶液分别定容至10 mL,得到2 mg/mL胰液和12 mg/mL胆汁。将胰液和胆汁溶液按体积比1∶1混合均匀,制得胰液-胆汁混合液。用移液管分别移取5份每份2.00 mL胃消化1 h的样液(预先调节pH至7.0)至5个10.0 mL具塞试管中,分别加入4.0 mL胰液-胆汁混合液,并采用0.1 mol/L NaHCO3调节pH至7.0,置于37 ℃恒温振荡培养箱中培养,在0、1.0、2.0、3.0和4.0 h各取出1管,作为肠消化0、1.0、2.0、3.0和4.0 h的样品,为了确保酚类化合物的稳定及抑制胰蛋白酶活性,采用6 mol/L HCl调节样品pH至2.0。
以不含多酚提取物的溶液作为空白对照,按照多酚提取物体外消化的方法进行操作,按时取样。将不同消化阶段的消化液分别离心(4 500 r/min,10 min),弃沉淀,上清液于-20 ℃存放备用。
1.3.3 总酚含量测定
总酚含量(total phenolic content,TPC)的测定采用福林酚法,参照文献[1]、[17-18]并修改如下:以没食子酸为标准品,以溶解多酚提取物的溶剂或者经过胃消化或肠消化的空白溶液溶解没食子酸标准品,配成质量浓度为0~100 mg/L标准溶液,分别量取1.0 mL不同质量浓度的标准溶液置于不同的试管中,再分别加入5.0 mL 10%福林酚试剂,摇匀反应6 min,然后加入4.0 mL 7.5% Na2CO3溶液,用相应的溶剂定容,摇匀,避光常温静置60 min,于766 nm处测定吸光度。以质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。采用同样的方法,分别测定不同消化阶段样品溶液的吸光度值。根据标准曲线,计算样品中总酚含量,结果以每克多酚提取物(以干基计)所含的没食子酸(GAE)的毫克数表示。
1.3.4 HPLC检测主要酚类物质
量取消化前后的样品溶液各1 mL,4 500 r/min离心10 min,弃沉淀,上清液加入3倍体积的甲醇,手动搅拌5 min,离心(4 500 r/min,10 min),弃沉淀,将上清液过0.22 μm滤膜,采用日本岛津Prominence LC-20A高效液相色谱仪检测上清液中多酚成分。色谱条件:Omsi Sype C18柱(250 mm× 4.6 mm,5 μm),保护柱(ChrmSEP 1 cm×3 mm)。流动相A相为0.1%磷酸、B相为体积分数100%甲醇。梯度洗脱为5%B(0 min),25%B(0~5 min),34%B(5~14 min),37%B(14~25 min),40%B(25~30 min),49%B(30~34 min),50%B(34~35 min),51%B(35~58 min),55%B(58~60 min),80%B(60~62 min),保持在80%B(62~65 min),降至5%B(65~67 min),维持在5%B(67~72 min)。流量为0.8 mL/min;进样量20 μL;检测波长为280 nm。以绿原酸、表儿茶素、儿茶素、咖啡酸、原花青素、根皮素、槲皮素为标准品,混标进样,以峰面积为纵坐标,以浓度为横坐标,绘制标准曲线得到各标准品的线性方程,根据线性方程,计算得出不同消化阶段消化液中的主要酚类物质含量,结果以每毫升消化液所含的对应标准品的毫克数表示。
1.3.5 抗氧化活性
1.3.5.1 DPPH自由基清除能力
参照文献[19]并修改如下:准确称取2.4 mg DPPH,用无水乙醇溶解并定容至50 mL,得到浓度为48 mg/L DPPH贮备液,-20 ℃避光保存。向测试管1中加入2.00 mL 48 mg/L DPPH溶液和1.00 mL待测样品,摇匀,避光反应30 min,用可见分光光度计测定517 nm处的吸光度(即为待测样品的吸光度AS)。向测试管2中加入2.00 mL DPPH溶液和1.00 mL无水乙醇,摇匀,避光反应30 min,测定517 nm处的吸光度(即为初始溶液的吸光度A0)。向待测样品管中加入待测样品1.0 mL和2.00 mL无水乙醇,摇匀,避光反应30 min,测定517 nm处的吸光度值(即为参比溶液的吸光度Ar)。样品对DPPH自由基清除率(IDPPH,%)按公式(1)计算:
(1)
式中:IDPPH,DPPH自由基清除率,%;A0,初始溶液的吸光度;Ar,参比溶液的吸光度;As,待测溶液的吸光度。
1.3.5.2 ABTS自由基清除能力
参照文献[20-22]方法,称取96.0 mg ABTS,用去离子水溶解并定容至25 mL,配制成7 mmol/L ABTS溶液;称取16.6 mg过硫酸钾,用去离子水溶解并定容至25 mL,配制成2.45 mmol/L溶液;按体积比2∶1将ABTS溶液和过硫酸钾溶液混合,黑暗中静置12~16 h,以形成稳定的ABTS自由基阳离子(ABTS+·),此溶液即为ABTS+·储备液。使用前用去离子水将ABTS+·储备液稀释使其在734 nm波长处的吸光度值为(0.700 ± 0.02)。然后量取2.9 mL ABTS+·稀释液与0.1 mL胃肠消化不同时间样液混合,于黑暗处30 ℃反应10 min,在734 nm波长处测定其吸光度。以去离子水为空白对照。则样品对ABTS自由基清除率(IABTS,%)按公式(2)计算:
(2)
式中:IABTS,ABTS自由基清除率,%;AB,空白对照溶液的吸光度;AS,待测样品溶液的吸光度。
1.3.5.3 铁离子还原能力(ferric reducing antioxidant power,FRAP)
参照文献[23-24]方法,首先配制溶液:乙酸钠缓冲溶液(300 mmol/L,pH 3.6)的配制:称取1.55 g三水合乙酸钠,用适量去离子水溶解并转移到500 mL容量瓶中,加入8 mL乙酸,然后再补加去离子水至刻度,混匀;10 mmol/L TPTZ溶液:称取156 mg TPTZ,用40 mmol/L HCl溶解并定容至50 mL,混匀;20 mmol/L FeCl3·6H2O溶液的配制:称取270 mg FeCl3·6H2O,加入去离子水溶解并定容至50 mL,混匀;FRAP试剂的配制:将乙酸钠缓冲溶液、TPTZ溶液和FeCl3·6H2O溶液,按照体积比10∶1∶1混匀配制而成。然后,将2 850 μL FRAP试剂(预热至37 ℃)和150 μL胃肠消化不同时间样液混合,室温暗处反应30 min,于593 nm处测定吸光度。以去离子水作为空白对照,以Trolox为参照,结果以每毫克多酚提取物(以干基计)所对应的Trolox当量表示(μmol Trolox/mg)。
1.3.5.4 氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)
将胃肠消化不同时间样品溶液(各1 mL),离心(4 500 r/min,10 min),弃沉淀,上清液冷冻干燥,然后参照文献[25]方法测定氧自由基吸收能力。方法如下:采用75 mmol/L pH 7.4 磷酸盐缓冲溶液溶解荧光素并配制成120 μmol/L荧光素储备液,在4 ℃存放,使用前再稀释100倍。将冻干样品分别采用75 mmol/L pH 7.4 磷酸盐缓冲溶液溶解并配制成6 mg/mL溶液,各取20 μL样品溶液和120 μL 1.2 μmol/L 荧光素加入到黑色96孔酶标板中,混合均匀,于37 ℃保温15 min。然后每孔内快速加入60 μL 12 mmol/L AAPH溶液,酶标仪读取每孔的荧光值,每隔1 min读数1次,测定80 min。整个测试过程中酶标仪温度控制在37 ℃,激发波长和发射波长分别设定为485 nm和530 nm。以75 mmol/L pH 7.4 磷酸盐缓冲溶液作为空白对照,以Trolox为标准品。按公式(3)计算待测样品荧光强度曲线下方的面积(AUCSample)及空白对照荧光强度曲线下方的面积(AUCBlank),按公式(4)计算待测样品荧光强度曲线下方的净面积。以标准品Trolox浓度及其荧光衰减曲线下方的净面积建立回归方程,待测样品的ORAC值通过回归方程计算,结果以每毫克多酚提取物(以干基计)所对应的Trolox当量表示(μmol Trolox/mg)。
(3)
AUCNet=AUCSample-AUCBlank
(4)
式中:F0,时间为0 min时的荧光强度;Fi,时间为第imin 时的荧光强度;AUC,待测样品在时间imin内荧光衰减曲线下方的面积;AUCNet,待测样品在时间imin内荧光衰减曲线下方的净面积。
1.4 数据处理
试验均重复3次,结果以平均值±标准偏差(standard deviation,SD)表示。运用SPSS version 17.0 软件分析不同处理间的差异显著性。运用Excel 2007中的Correl函数计算总酚含量与以DPPH、ABTS、FRAP和ORAC法测定的抗氧化活性之间的相互关系。
2 结果与分析
2.1 体外模拟消化过程中总酚含量的变化
以没食子酸为标准品,采用福林酚法测定总酚含量,线性方程为Y=0.115 1X+0.002 5,R2=0.997 3,线性范围为0~100 mg/L。根据线性方程,计算不同消化阶段样品中的总酚含量,结果如表1所示。
由表1可知,消化前样品中的总酚含量最高,经过胃消化(胃消化0、0.5、1 h相比),总酚含量显著增加,与文献[15]报道一致,但在肠消化过程中,总酚含量先增加而后减少,且胃肠消化过程中总酚含量均低于消化前样品,说明胃肠消化导致多酚降解或者转化,与文献[1]报道一致。胃消化0.5 h时总酚含量显著高于胃消化0 h的含量,可能是因为胃消化酶作用及其强酸环境,使部分结合态酚分解释放出游离态酚,从而使可测定的总酚含量增加;此后,直至胃消化1 h,总酚含量略有下降,可能与胃消化酶活性被抑制使游离态酚释放量减少有关。在肠消化初始阶段(0 h),总酚含量突然降低,这是由于肠消化液的加入,对多酚起到稀释作用,此外,pH值上升,酸碱环境改变,导致可测的多酚含量降低。此后,直至肠消化2 h,总酚含量基本保持不变。在肠消化3 h时,总酚含量又突然增加,可能与肠消化酶作用有关,肠消化酶使底物中的结合态酚分解,释放游离态酚,因此总酚含量增加。此后,总酚含量开始减少,其原因可能是胰酶活性降低,结合态酚分解减慢,也可能是游离态酚转化为其他化合物,从而使游离态酚含量减少。在胃肠消化过程中,肠消化液中总酚含量低于胃消化液中的含量,说明胃肠消化降低了苹果多酚提取物中的总酚含量。
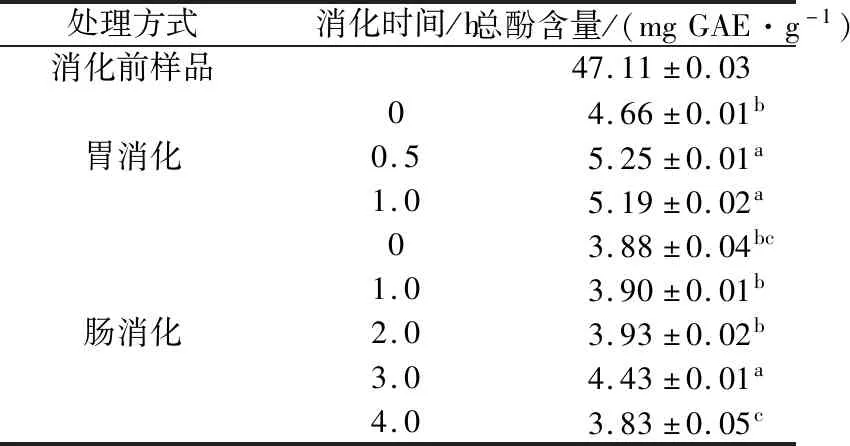
表1 体外不同消化阶段消化液中总酚含量Table 1 Total phenolic content at different digestion stages in vitro
注:不同字母表示在相同消化液中消化不同时间,差异显著(P<0.05)
2.2 体外模拟消化过程中抗氧化活性变化
2.2.1 DPPH自由基清除能力
体外模拟消化过程中DPPH自由基清除率的变化如图1所示。由图1可知,消化前样品对DPPH自由基清除率为(37.24±1.63)%,胃消化0 h和1 h、肠消化2 h和4 h时DPPH自由基清除率分别为(74.17±1.40)%,(68.57±1.25)%,(88.81±2.95)%和(80.84±2.22)%。当胃消化0 h和1 h时,苹果多酚对DPPH自由基清除率分别是消化前样品的1.99倍和1.84倍;在肠消化2 h和4 h时,DPPH自由基清除率分别是消化前样品的2.38倍和2.17倍。在肠消化2 h时DPPH自由基清除率最大。
与消化前样品相比,胃消化0 h时,DPPH自由基清除率显著增加,可能是由于胃消化液的强酸性环境,促使某些结合态酚分解释放出游离态酚,增强了对DPPH自由基的清除能力。在胃消化1 h时,DPPH自由基清除能力略有下降,可能是游离酚降解或转化为其他成分。在肠消化2 h时,DPPH自由基清除率最大,这是由于肠消化液中消化酶的作用,使得结合态酚分解释放出游离态酚。在肠消化4 h时,DPPH自由基清除率显著下降,可能是因为反应体系中易被氧化的多酚类物质发生降解或转化,从而使得DPPH自由基清除率降低。
因此,经过胃肠消化,苹果多酚提取物对DPPH自由基清除率显著提高,说明胃肠消化增强了苹果多酚提取物的抗氧化活性,这与JAYAWARDENA等[15]报道不一致,JAYAWARDENA等[15]发现胃肠消化不一定增强苹果汁对DPPH自由基的清除效果。
2.2.2 ABTS自由基清除能力
不同消化阶段苹果多酚提取物对ABTS自由基清除能力如图1所示。与消化前样品相比,胃消化和肠消化均显著提高苹果多酚提取物对ABTS自由基清除能力(P<0.05)。在胃消化阶段,ABTS自由基清除率逐渐增加但效果不显著(P>0.05);与胃消化相比,肠消化阶段ABTS自由基清除率显著增加,在肠消化2 h时,ABTS自由基清除率最高为(84.31±3.51)%,约是消化前样品的1.95倍,再随着肠消化时间延长,ABTS自由基清除率反而显著下降,这与QUAN等[26]报道一致。其原因可能是从胃消化到肠消化pH值的改变导致多酚类化合物的结构变化,从而降低对自由基的清除能力[26]。据报道,苹果多酚在较低的pH条件下显示出较强的抗氧化能力,在较高的pH条件下被氧化成醌,清除自由基能力下降[26]。此外,消化酶(蛋白质)可能通过氢键、共价键、疏水相互作用与多酚键合,从而影响多酚的抗氧化能力[22, 26]。
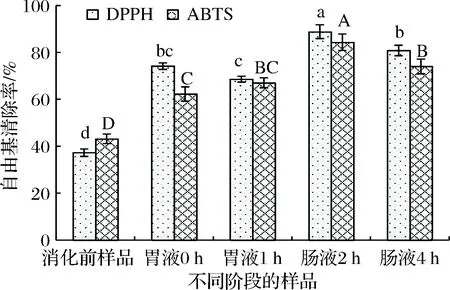
图1 体外模拟消化过程中DPPH和ABTS自由基清除率的变化Fig.1 Changes of DPPH and ABTS radical scavenging rates during in vitro simulated digestion注:不同大小写字母分别表示ABTS和DPPH自由基清除率差异显著(P < 0.05)(下同)
2.2.3 铁离子还原能力
如图2所示,与消化前样品相比,体外模拟胃消化能够显著提高苹果多酚提取物的铁离子还原能力(P< 0.05),在胃消化1 h时,FRAP达到最大值为(4.25±0.13) μmol Trolox/mg。但是当苹果多酚提取物由胃消化进入肠消化后,FRAP值呈显著性下降趋势,说明苹果多酚提取物对铁离子的还原能力随着肠消化时间延长显著下降,这一现象与BOUAYED等[1]报道一致。铁离子还原能力在肠消化阶段显著下降,可能与肠消化阶段多酚浓度低有关,也可能与pH值有关[1]。根据铁离子还原能力测定方法,可以得知pH 3.6是FRAP值测定的合适条件,胃消化液pH 2.0与pH 3.6较接近,而肠消化液pH 7.0与pH 3.6偏离较远,由此推测,pH值的改变可能是导致肠消化阶段FRAP值显著下降的原因之一[1]。
2.2.4 氧自由基吸收能力
胃肠消化过程中氧自由基吸收能力变化如图2所示。胃肠消化后溶液的ORAC值显著高于消化前样品(P< 0.05),在胃消化1 h时,ORAC值最大,最大值为(4.77±0.19) μmol Trolox/mg。由胃消化进入到肠消化时,ORAC值显著降低,可能是由于pH值改变及消化酶作用,导致酚类物质不稳定发生降解或转化,从而降低其抗氧化活性。但在肠消化阶段随着消化时间的延长,ORAC值下降并不明显(P>0.05)。

图2 体外模拟消化过程中FRAP值和ORAC值的变化Fig.2 Changes of FRAP and ORAC values during in vitro simulated digestion
2.3 总酚含量与抗氧化活性之间的相关性
利用Excel 2007中的correl函数,分别对消化前样品、胃消化0 h和1 h、肠消化2 h和4 h样品的总酚含量与DPPH自由基清除率、ABTS自由基清除率、ORAC值及FRAP值之间的相互关系进行计算,结果以绝对值表示见表2,其绝对值越接近于1,说明两者相关性越强,其绝对值越小,说明两者之间相关性小或不相关。
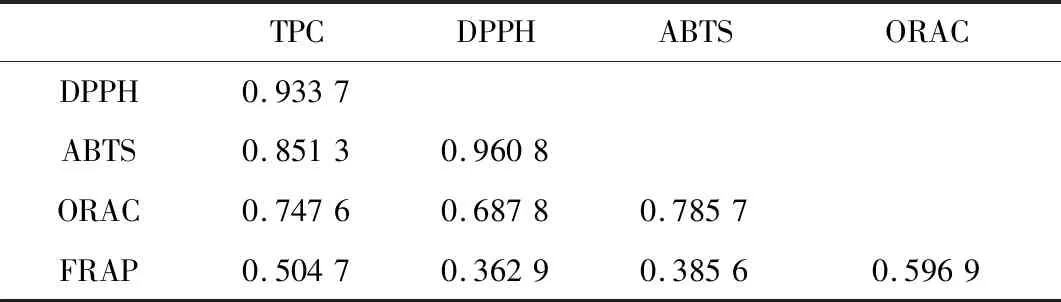
表2 总酚含量及抗氧化活性之间的相关性分析Table 2 Correlation analysis between total phenolic content and antioxidant activities
由表2可知,总酚含量与以DPPH、ABTS及ORAC法测定的抗氧化活性高度相关,其相关系数分别为0.933 7、0.851 3和0.747 6;总酚含量与FRAP值之间相关系数为0.504 7,说明两者之间相关性不高;DPPH与ABTS之间相关系数为0.960 8,表明两者高度相关(如图1所示);ORAC与DPPH、与ABTS之间的相关系数分别为0.687 8和0.785 7,说明相关性高;FRAP与TPC、DPPH、ABTS及ORAC之间的相关系数均低于0.60,说明FRAP值与总酚含量及其他方法测定的抗氧化活性之间相关性不高。PODSEDEK等[27]研究发现总酚含量与抗氧化活性(以ABTS和FRAP法测定)之间的相关系数大于0.97,说明总酚含量与抗氧化活性高度相关。本研究中总酚含量与ABTS法测定的抗氧化活性相关性较高,但与FRAP测定的抗氧化活性相关性不高,这与PODSEDEK等[27]报道不完全一致。JAYAWARDENA等[15]报道总酚含量与ORAC、FRAP、DPPH、ABTS之间的相关系数分别为0.975、0.893、0.821、0.752,DUDONNE等[20]报道总酚含量与ABTS、DPPH、FRAP、ORAC相关系数依次为0.966、0.939、0.906和0.831,而本研究发现总酚含量与不同方法测定的抗氧化活性按照相关系数由高到低依次为DPPH(0.933 7)、ABTS(0.851 3)、ORAC(0.747 6)及FRAP(0.504 7)。由此看出,总酚含量与抗氧化活性之间的相关性,除了与抗氧化活性的测定方法有关[15],还可能与酚类物质的来源、主要酚类成分、游离或结合状态等有关。
2.4 体外模拟消化过程中主要酚类物质的变化
图3-a为标准品绿原酸、儿茶素、表儿茶素、咖啡酸、原花青素,槲皮素和根皮素的高效液相色谱图,分别对应峰1~7,其保留时间分别为19.391、19.865、21.242、22.351、25.858、53.275、56.142 min。图3-b~图3-f分别为消化前样品、胃消化0 h、胃消化1 h、肠消化 2 h和4 h的样品的高效液相色谱图。
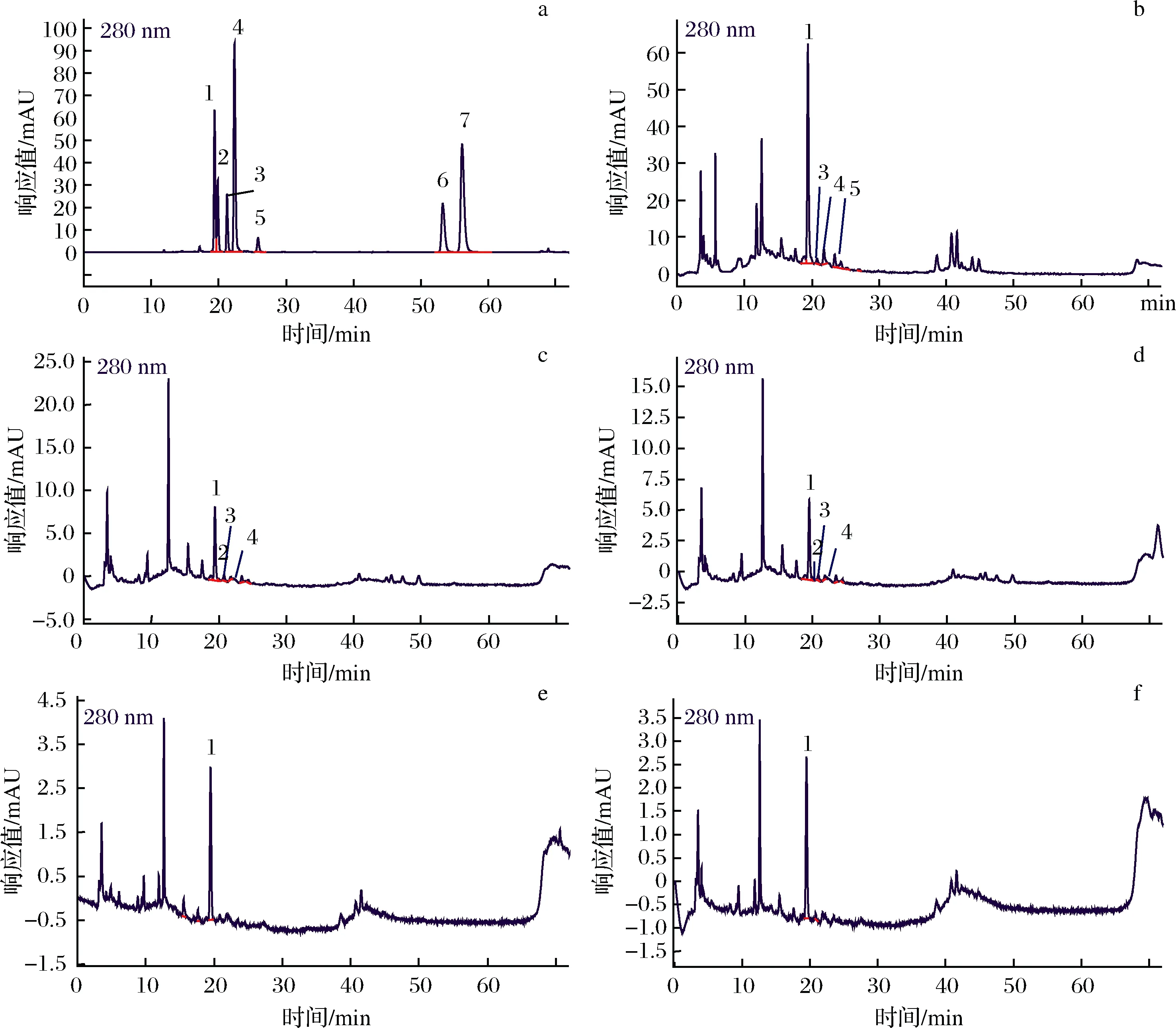
a-标准品;b-消化前样品;c-胃消化0 h;d-胃消化1 h;e-肠消化2 h;f-肠消化4 h峰1~7分别对应绿原酸、儿茶素、表儿茶素、咖啡酸、原花青素、槲皮素和根皮素图3 胃肠消化液及标准品的高效液相色谱图Fig.3 High performance liquid chromatogram of gastrointestinal digestive juice and standards
由图3可知,绿原酸是苹果多酚提取物中的主要成分,在胃肠消化液中均可检出,其峰面积及峰高均随着消化进程(消化前→胃消化→肠消化)显著性下降;儿茶素在消化前样品中未被检出,在胃消化的初始阶段(0 h)及胃消化1 h时,均检测到儿茶素色谱峰,可能是由于胃消化液pH值较低的强酸性环境使苹果多酚提取物中其他成分转化为儿茶素,但随着肠消化液pH值升高,儿茶素分子又转化为其他成分,所以在肠消化液中未检出儿茶素。表儿茶素和咖啡酸在消化前样品及胃消化液中均可检测到色谱峰,在肠消化液中未检测到,说明胃肠消化也影响其分子存在形式;原花青素仅在消化前样品中检测到色谱峰,说明原花青素不稳定,在胃肠消化中容易降解或转化。
根据标准品对应的保留时间,初步判断不同消化阶段样品中多酚成分;以标准品对应的峰面积为纵坐标、以浓度为横坐标,绘制标准曲线,得到各标准品的线性方程,根据消化液中多酚对应的峰面积,由线性方程计算消化液中主要酚类物质的含量(表3)。
由表3可知,消化前样品中绿原酸含量最高为(285.46±20.55) μg/mL,其次为原花青素(19.60±1.26) μg/mL、表儿茶素(17.92±5.02) μg/mL和咖啡酸(12.60±3.73) μg/mL。儿茶素、槲皮素及根皮素在消化前样品未检测到,说明苹果多酚提取物不含有儿茶素、槲皮素及根皮素,或因其含量较低未被检出。
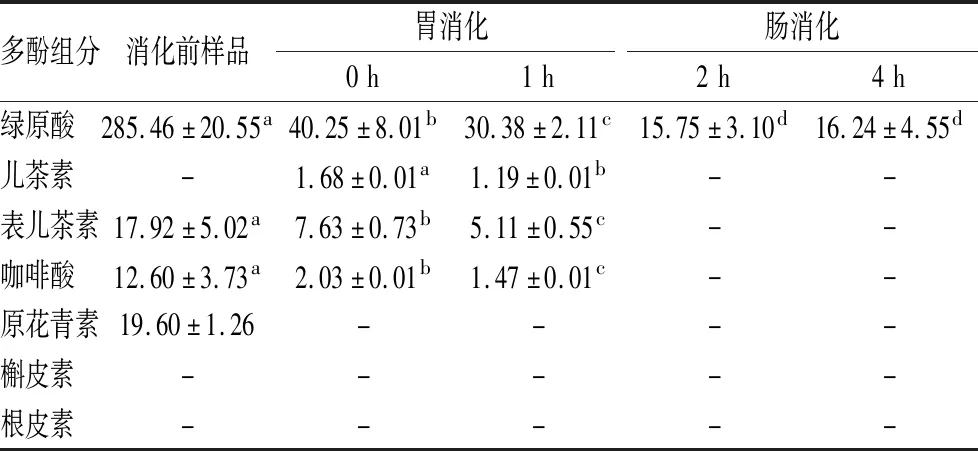
表3 不同消化阶段消化液中主要酚类物质含量 单位:μg/mLTable 3 The content of main phenolic components in digestive juice at different digestion stages
注:同一行中不同字母表示差异显著(P<0.05),-表示未检出
由表3还可以看出,苹果多酚提取物在胃肠消化过程中主要酚类物质的含量发生显著性变化,经胃肠消化后,仅能检测出绿原酸,其含量由消化前(285.46±20.55) μg/mL减少到(16.24±4.55) μg/mL。BOUAYED等[28]报道绿原酸是苹果多种含量最高的酚类物质(11.8~16.3 mg/100g),其次,因苹果品种不同,可能是表儿茶素(4.8~7.8 mg/100g)也可能是原花青素(5.0~7.1 mg/100g);在胃消化和肠消化过程中绿原酸含量急剧减少,表儿茶素和咖啡酸在胃消化液中含量均较低,在肠消化液中其含量更低甚至检不出含量,原花青素在肠消化液中未检出。由此看出,本研究中主要酚类物质含量高低及在胃肠消化过程中的变化趋势与BOUAYED等[28]报道相一致。
由图3和表3可知,苹果多酚提取物中主要酚类物质在胃肠消化过程中不稳定,会发生降解或转化。与肠消化相比,胃消化过程中强酸性环境在一定程度上抑制酚类物质的降解,这一现象与文献[29]报道一致。
由表1不同消化液中总酚含量及表3不同消化液中主要酚类物质的含量,可以看出,总酚含量高于主要酚类物质的含量之和,说明胃肠消化液中存在一定量的不同于研究中所使用的标准品的酚类物质,或许是这些标准品的降解或转化产物。由图1和图2可以看出胃肠消化后抗氧化能力显著高于消化前样品,说明苹果多酚提取物经过胃肠消化产生了抗氧化物质,这些抗氧化物质并不是这几种给定的标准品,胃肠消化后抗氧化能力的增强归因于胃肠消化后新生成的抗氧化成分。由此可知,胃肠消化使苹果多酚提取物中主要酚类物质发生降解或转化,同时产生新的抗氧化成分,这些新的抗氧化成分有待于进一步探讨。
3 结论
苹果多酚是膳食中抗氧化剂的主要成分,本研究采用体外消化模型探讨苹果多酚提取物在胃肠消化过程中总酚含量、主要酚类物质含量、DPPH和ABTS自由基清除能力、铁离子还原能力以及氧自由基吸收能力。结果表明,胃消化液中总酚含量随着消化时间延长而增加,肠消化液中总酚含量随着消化时间延长先增加后减少,但均低于消化前样品中的含量;胃消化液中可检测的主要酚类物质按照含量由高到低依次为绿原酸、表儿茶素、咖啡酸、儿茶素;肠消化液中可检测的主要酚类物质为绿原酸;胃肠消化使主要酚类物质发生降解或转化;胃肠消化增强了苹果多酚提取物对DPPH自由基和ABTS自由基清除能力、铁离子还原能力以及氧自由基吸收能力;相关性分析表明,总酚含量与以DPPH、ABTS、ORAC法测定的抗氧化活性之间高度相关,与以FRAP法测定的抗氧化活性相关性不高。
植物多酚是植物次级代谢产物中的一大类物质,具有8 000多种化合物[28],由于品种类型、存在部位、含量高低、提取方法、检测方法、操作技术等的不同,在分析检测时仅仅依据现有的几个标准品是远远不够的。此外,在胃肠消化时,由于酸碱稳定性、与消化酶的相互作用及食品基质的影响,酚类物质的存在形式及其生物活性可能发生很大变化。抗氧化活性检测方法包括DPPH、ORAC、FRAP、ABTS及细胞培养法,其方法和原理不同,所反应的抗氧化机理有着本质上的差异,仅靠一种方法评价多酚类物质的抗氧化活性是不全面的。因此,有关苹果多酚类物质的酚类组成、胃肠消化对其成分的影响及其抗氧化活性评价,还有待于深入研究。

