一种国产新型子宫填塞球囊导管的生物相容性研究
河南省医疗器械检验所 (河南省医疗器械检验检测工程技术研究中心,河南省医疗器械生物技术与应用工程研究中心)生物检测室,河南 郑州 450000
引言
产后出血(Postpartum Hemorrhage,PPH)是孕产妇死亡的主要原因[1-2]。PPH一般发生在产后2 h以内,是分娩期间最危险的并发症状之一,严重危及产妇的生命[3-4]。在按摩子宫及使用宫缩剂等方法不能有效加强宫缩、减少出血时,则需要进行宫腔填塞、B-Lynch法缝合、子宫动脉栓塞、结扎及全子宫摘除等手段进行止血[5-6]。然而,这些止血方法往往不能达到预期止血效果,或者会对孕产妇造成严重的不可逆损伤。在使用子宫填塞球囊导管进行压迫止血操作时,将导管的球囊部位放置在产妇子宫内,由于球囊具有较强的可塑性,向球囊内注入液体时可使其与子宫内腔紧密贴合,球囊体继续充盈产生的高静水压力可达到较好的止血作用[7-9]。而且该方法对操作者的技能要求不高,医生在B超帮助下即可在首次使用时顺利完成操作,短时间内达到理想的止血效果[10]。该方法既避免了侵入性治疗给孕产妇带来的痛苦,又能及时有效地观察和控制产妇的出血量。
自2006年美国FDA批准的Bakri子宫填塞球囊导管上市以来,国外陆续有多款用于宫腔止血的填塞球囊导管产品面世,如Belfort-Dildy产科填塞系统、BT-Cath子宫填塞球囊导管等[11-12]。子宫填塞球囊导管较好的临床效果,使得其逐渐成为各国产科界指南推荐的止血方式。依据《世界卫生组织关于产后出血预防和治疗的建议》[13]和我国《产后出血预防与处理指南(2014)》[14],在药物治疗无效的情况下,施行其他外科手段止血前推荐优先采用球囊填塞的方式。虽然国内市场有着巨大的产品需求,但该产品主要依靠进口,高昂的价格以及单一的规格使得其在临床应用和推广十分困难。随着我国医疗器械行业的蓬勃发展,子宫填塞球囊导管的技术壁垒不复存在,国产新型产品的推广应用将大大降低患者的医疗成本。
本研究介绍了一种国产新型子宫填塞球囊导管的设计,并对其生物相容性进行评价。生物相容性评价是考核子宫填塞球囊导管安全性的一个重要环节。在正常使用过程中,由于子宫填塞球囊导管需短期接触完整或已损伤的阴道和子宫腔,依据GB/T 16886.1-2011《医疗器械生物学评价第1部分:风险管理过程中的评价与试验》[15]判断,其生物相容性评价应包含细胞毒性、致敏性、皮肤刺激反应(包括皮内反应和阴道组织刺激反应)、溶血率和热原反应等项目。本文通过对该国产新型球囊导管的生物相容性研究,为该产品的安全性评价提供数据支持。
1 国产新型子宫填塞球囊导管
本文研究的国产新型子宫填塞球囊导管设计图,见图1。国产新型子宫填塞球囊导管较之进口同类产品,有3方面创新。

图1 子宫填塞球囊导管结构示意图
(1)设计创新。该国产新型子宫填塞球囊导管在结构上采用了双囊设计,分别是具有止血功能的子宫球囊和起固定作用的阴道球囊,该设计避免子宫填塞球囊导管在使用中脱落或者位移,更好地满足了临床需求。
(2)原材料创新。其球囊部位采用医疗级液体硅橡胶注塑成型,具有更高的球囊爆破容量,在产品的安全性能上有更好的保障;同时光洁柔韧、贴附性更好的球囊表面减少了对子宫腔壁的二次损伤,从而达到更好的压迫止血效果。管体部位采用医疗级固体硅橡胶挤出而成,导管柔韧性好,在导管放置与取出过程中可减少患者的痛苦。
(3)工艺创新。导管尖端采用硅橡胶倒头模成型,尖端柔韧圆润,在导管放置时可以更好地通过宫颈口到达宫腔;同时在放置期间,柔软的尖端可减少对子宫壁的损伤。而进口产品导管尖端采用硅胶模压成型,尖端硬度偏高,在置入过程中对宫腔壁有一定的挤压,导致患者的不适。
2 生物相容性研究
2.1 试验材料与仪器
子宫填塞球囊导管,小鼠成纤维细胞系L929,MEM培养基(Gibco公司),胎牛血清(Gibco公司)和弗氏完全佐剂(Sigma公司)等。
健康白化豚鼠(体质量300~500 g),健康家兔(体重>2.0 kg),饲养条件为温度21℃~26℃、相对湿度40%~70%。
TE2000-S荧光倒置显微镜,Thermo Forma4111 CO2培养箱,Various Flash全波长扫描多功能读数仪,Cary100紫外分光光度计,ZRY-3智能热原检测仪和电子秤等。
2.2 试验方法
2.2.1 体外细胞毒性试验
采用MTT比色法进行试验。无菌操作下,制备供试品球囊部分的MEM培养基(含10%的胎牛血清)浸提液,浸提比例为3 cm2/mL。阴性对照为高密度聚乙烯浸提液,阳性对照为5%二甲基亚砜(DMSO)培养液。置于37℃恒温震荡箱中24 h[16-17],取调整至1×105个细胞/mL的L929细胞悬液,加100 μL到培养板所有孔内。置于5% CO2培养箱37℃培养,24 h后弃去培养板内的培养液,按每组6孔,分别对应地加入浸提液、对照液和浸提介质100 μL,置CO2培养箱继续培养,24 h后观察细胞形态。弃去培养液,加1 g/L的MTT溶液至培养板,每孔50 μL,培养2 h后弃去MTT溶液,加入异丙醇溶液100 μL。培养板震荡后,在570 nm波长下测定吸光度(参考波长650 nm)。按式(1)得出细胞存活率[17]。

式中,OD570e为试验组光密度平均值,OD570b为空白组光密度平均值。
2.2.2 皮内反应试验
制备球囊部分的0.9%氯化钠注射液和植物油浸提液,浸提比例为3 cm2/mL,置于37℃恒温震荡箱中72 h[16]。同法放置的浸提介质作为阴性对照液。取健康家兔3只,除去脊柱两侧被毛,24 h后对皮肤暴露区域进行消毒。在脊柱左右两侧,分别皮内注射0.2 mL的氯化钠注射液浸提液和对照液,每组5个注射点,各点间距为2~3 cm。沿前述注射点下方,分别注射植物油浸提液和对照液。注射后观察记录24、48和72 h各注射部位状况。按GB/T 16886.10-2017标准[18]的规定,记录各注射点的红斑和水肿的评分结果,得出浸提液与其对照液的最终记分。
2.2.3 阴道刺激试验
取球囊部分,制备0.9%氯化钠注射液浸提液,浸提比例为3 cm2/mL,置于37℃恒温震荡箱中72 h[16]。同法放置的浸提介质作为阴性对照液。挑选6只阴道检查正常的家兔。用软导管(6 cm)从家兔阴道口注入浸提液1 mL。阴性对照组用对照液相同方法操作。连续5 d重复上述步骤。阴道标本固定后,整段取三处,分别标示a(外口)、b(中段)、c(内口)。石蜡切片,HE染色。通过阴道组织反应的显微镜记分系统进行评分,得出对阴道组织的刺激指数[18]。
2.2.4 皮肤致敏试验
采用与皮内反应试验相同方式制备2种介质的供试品浸提液。将30只豚鼠,分成与2种浸提介质对应的浸提液组与对照组,浸提液组10只,对照组5只。除去豚鼠背部区域被毛,24 h后在豚鼠的肩胛骨内侧(图2所示的试验部位A、B和C),分别皮内注射相应的试验液0.1 mL。部位A注射浸提介质与弗氏完全佐剂以50:50(V/V)比例制备的乳化剂;部位B注射浸提液,对照组为相应浸提介质;部位C注射浸提液与前述稳定性乳化剂以50:50(V/V)比例混合的乳化剂,对照组为佐剂与浸提介质制备的乳化剂[16,18]。6 d后用10%十二烷基硫酸钠溶液处理试验区域,24 h后用8 cm2的敷贴片封闭浸提液于诱导注射点上,并于48 h后除去。阴性对照组用浸提介质相同方法操作。14 d后将浸提液或浸提介质的敷贴片,封闭贴敷于豚鼠侧腹部,激发24 h后除去,24 h和48 h后在自然光下观察,并按照标准GB/T16886.10-2017[18]规定的Magnusson和Kligman分级,对皮肤的红斑和水肿情况进行双盲分级。

图2 皮内注射点部位
2.2.5 溶血试验
球囊部分制成0.5 cm×0.5 cm块状,取15 g备用[19]。制得新鲜抗凝兔血的稀释溶液。在供试品组的3只试管中,加入0.9%的氯化钠注射液10 mL和供试品5 g。在阴性与阳性对照组的试管中,分别加入10 mL的0.9%氯化钠注射液或纯化水。所有试管在37℃恒温箱中放置30 min,分别加入抗凝兔血的稀释溶液0.2 mL,混匀后保温60 min。移出管内液体,800 g离心5 min,取上清液用分光光度计在545 nm波长测吸光度值,计算出各组平均值。按式(2)得出溶血率[19-20]。

式中,OD545a为供试品组A光密度平均值;OD570b为阴性组B光密度平均值;OD570c为阳性组C光密度平均值。
2.2.6 热原试验
与阴道刺激试验同法制备浸提液[16,19]。按规定选取家兔,禁食10 h。30 min测量1次家兔体温,2次测量之差不能大于0.2℃,计算平均温度作为该只家兔的正常体温。将3只正常体温在38.0℃~39.6℃,且正常体温间差值不大于1℃的家兔,编号为1、2、3。在15 min内,将38℃的浸提液由耳缘静脉缓慢注入,采用剂量为10 mL/kg。每30 min记录一次体温数据,在6次测量后计算兔体温的升高温度[19,21]。
3 结果
3.1 体外细胞毒性试验
荧光倒置显微镜下观察(图3),阴性和空白对照组的细胞贴壁好,细胞呈三角形,或呈梭形,且分裂旺盛;浸提液组的细胞状态和形态良好;阳性对照组的细胞稀疏且多数已呈圆形。采用MTT法,得出细胞的存活率为86%(表1)。根据细胞毒性反应判定,在该试验条件下,结果大于70%,无细胞毒性。

图3 细胞毒性试验观察结果

表1 体外细胞毒性试验结果
3.2 皮内反应试验
在72 h内对每只家兔皮肤进行观察,供试品浸提液与其溶剂对照液的动物皮肤注射处均无明显异常情况。根据标准GB/T16886.10-2017判定,供试品的两种浸提液的最终记分均为0。
3.3 阴道刺激试验
病理检查结果显示(图4),浸提液组的黏膜上皮构层完好,固有层存在少量的炎症细胞浸润组织,有极轻度的水肿现象以及轻度的血管充血,浸提液组平均记分为1.87。对照组平均记分为1.67,得出刺激指数为0.20。结果表明,供试品浸提液无阴道组织刺激反应。
3.4 皮肤致敏试验
24 h和48 h观察期内,浸提液组与对照组激发处理部位的皮肤均无明显异常。根据Magnusson和Kligman分级标准,两种浸提介质制备的浸提液与其溶剂对照组的动物分级均为0级,表明在该试验条件下,试验样品无皮肤致敏性。

图4 阴道刺激试验病理图片
3.5 溶血试验
离心后观察试管,供试品组和阴性对照组红细胞沉底,溶液澄清透明;阳性对照组红细胞破裂,溶液呈鲜红色。根据溶血率计算公式,溶血率为0.3%,小于5%(表2)。
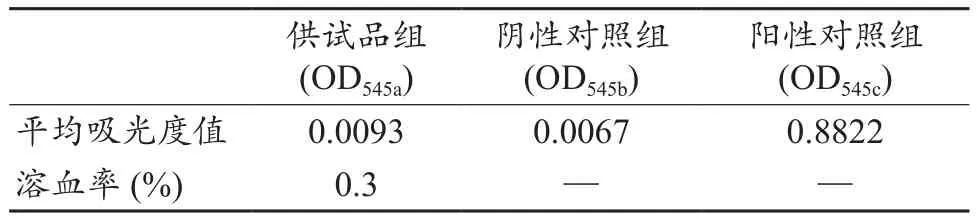
表2 溶血试验结果
3.6 热原试验
试验的3只家兔体温升高分别为0、0.1℃和0,均低于0.6℃,且体温升高总和为0.1℃,低于1.3℃(表3)。
4 讨论与总结
使用子宫填塞球囊导管可以较好地降低产后的出血率,监控出血量,降低产妇高危风险,并且预后效果好,与其他治疗手段比较效果显著,已逐渐在产科中推广。根据现行的《医疗器械分类目录》,界定用于治疗功能性子宫出血,且不涉及组织变性的产后止血球囊,应作为Ⅱ类医疗器械管理。但目前子宫填塞球囊导管尚无产品标准进行规范,也无技术审查指导原则可供参考。因此本文通过生物相容性进行评价研究,判断其可能潜在的风险,确保产品的生物安全性,同时为其安全性方面研究提供依据。
依据GB/T 16886.1-2011,考虑子宫填塞球囊导管在临床应用中直接与阴道黏膜、子宫内膜接触,因此选择细胞毒性、皮肤致敏性、皮内反应和阴道组织刺激反应等对其做生物相容性研究。在PPH治疗时,作用于破损的宫腔,与血液间接接触,增加溶血试验和热原试验评价其安全性。
采用MTT比色法进行的细胞毒性试验,可定量评价子宫填塞球囊导管的细胞相容性,试验结果表明,其无细胞毒性,细胞相容性良好。采用豚鼠最大剂量法进行皮肤致敏试验,检测子宫填塞球囊导管的皮肤致敏性,试验结果表明,在极性和非极性两种浸提介质下,均未出现致敏反应。分别采用皮内反应试验以及阴道刺激试验检测子宫填塞球囊导管对皮肤和阴道组织的刺激性,试验结果表明,在两种试验条件下均未出现刺激反应。采用标准GB/T 14233.2-2005规定的方法,验证其能否引起溶血现象和热原反应。体外溶血试验结果表明,样品的溶血率为0.3%,符合<5%的国家标准。采用家兔法进行热原试验,家兔体温升高的总和为0.1℃,小于1.3℃,符合国家标准。
综上所述,通过生物学评价试验的结果分析,以硅橡胶为原材料的国产新型子宫填塞球囊导管具有良好的生物相容性,为其在医疗领域中的安全应用提供了可靠保障。后续将对其理化性质和抗菌抗炎表面涂层等方面进行更深入的研究。

