miR-7低表达导致非小细胞肺癌细胞吉非替尼耐药的作用机制
王 妹,姜钧耀,杜雨軒,葛晓军
0 引 言
肺癌的发病率及死亡率均居世界前列[1-2]。其中,非小细胞肺癌(non-small cell lung cancer, NSCLC)的发病率占肺癌发病率的80%[3]。由于早期症状不明显,大部分患者检出后已是晚期,失去了手术治疗的最佳时机,且肺癌术后复发率较高。对于这类患者的治疗主要以放化疗为主[4]。然而部分患者对放化疗的疗效并不佳[5-6]。
吉非替尼是治疗NSCLC在内的一种靶向化疗药,其主要通过靶向作用于人类表皮生长因子受体(epidermal growth factor receptor, EGFR)从而阻断信号向下游的传导,抑制RAS-RAF-MEK-ERK通路的激活从而抑制细胞增殖与侵袭[7-8]。研究表明,吉非替尼通常具有良好的耐受性,并在NSCLC中具有抗肿瘤活性[9-12];2项大型II期吉非替尼单药治疗研究对已治疗的晚期NSCLC患者进行了进一步证实,吉非替尼对EGFR-TK抑制剂的治疗反应可能持续长达2~3年[13-14]。然而,早期对化疗敏感的患者最终都会产生耐药,药物的平均反应时间为6~8个月[15]。其耐药的机制仍然是目前研究的热点。
微小RNA(MicroRNA)与肿瘤的发生密切相关,长19至25个核苷酸,MicroRNA是一种结构独特的小型非编码RNA,是目前公认的基因表达调节剂[16]。据报道,MicroRNA可以通过沉默靶基因mRNA的表达而负向调控多种基因[17],每个MicroRNA可以调控多达数百个基因的表达[18-19]。MicroRNA在癌症的进展中发生明显变化,相对于mRNA,microRNA更有希望作为在各种疾病的诊断和治疗应用中的靶目标而被使用和开发。血浆microRNA已被用于癌症早期检测,如结肠直肠癌等[20-21]。MicroRNA在癌症诊断中也显示出高灵敏度和特异性,进一步证实了其作为生物标志物的潜力。本研究通过建立对吉非替尼耐药的亚克隆H1299、A549细胞,并进行了microRNA表达微阵列分析和功能研究,以探究NSCLC化疗耐药的分子机制。
1 材料与方法
1.1 细胞株及主要试剂 人非小细胞肺癌细胞株A549、H1299购自American Type Culture Collection,将A549、H1299细胞长期暴露于吉非替尼中建立出吉非替尼获得性耐药细胞系。
RPMI-1640、胎牛血清购自Life Technologies公司,吉非替尼购自AstraZeneca公司,RNase购自美国Epicentre公司,dNTP购自HyTest Ltd公司,RT缓冲液和RT引物购自Invitrogen Life Technologies公司, G-fectin购自Genolution Pharmaceutical公司,YM-100微型离心柱购自EMD Millipore公司。
1.2 细胞培养
1.2.1 细胞传代培养 非小细胞肺癌细胞A549、H1299细胞培养于75 cm2细胞培养瓶中,体积分数为10%胎牛血清、100 U/mL青霉素/链霉素的1640培养基中,于37 ℃、5% CO2条件下培养,24 h更换1次培养基,2~3 d传代一次,所有试验均使用对数生长期细胞进行,所有细胞系均采用聚合酶链反应(PCR)方法测试支原体污染为阴性。
1.2.2 吉非替尼耐药细胞的构建 将吉非替尼用培养基稀释为0.01 μg / mL,添加到细胞中,在含吉非替尼的培养基中保留2~4周,或直到细胞重新聚集为止。然后将吉非替尼浓度提高0.5~2倍。逐步增加剂量持续16~24个月,直到吉非替尼浓度达到≥10倍起始浓度,此后,将吉非替尼耐药细胞系维持在其达到的最高吉非替尼浓度以下。
1.3 方法
1.3.1 吉非替尼对细胞活性的影响检测 采用CCK-8试剂盒分析吉非替尼对A549、H1299细胞的活性影响:取对数期细胞进行细胞计数,以5×103密度接种于96孔板,加入180 μL不含吉非替尼的细胞培养基。 24 h后,向每个孔中加入20 μL 含有0.1、1、10、100、1000 μg/mL吉非替尼的培养基,48 h后加入含10%CCK-8的RPMI-1640培养基,并用全波长酶标仪检测吸光度,GraphPad prism7软件计算IC50。
1.3.2 细胞MiRNA表达谱分析 用TRIzol提取总RNA,并通过生物分析仪确定RNA完整性。通过YM-100微型离心柱过滤RNA样品(5 μg)得到miRNA(<300 nt)。聚(A)聚合酶用于小RNA的3′末端添加聚(A)尾,寡核苷酸标记用于进一步的荧光标记。2种类型的标记用于标记匹配的RNA样品。使用微循环泵在微流体生物芯片上完成杂交。杂交混合物包含100 μL的6X SSPE缓冲液(0.90 mol/L NaCl,60 mmol/L Na2HPO4、6 mmol/L EDTA,pH 6.8)和25%甲醛,温度为34 ℃。 AxonGenePix©4000B微阵列扫描仪用于捕获Cy3和Cy5特异性荧光杂交图像。 ArrayPro完成数字转换。
1.3.3 细胞内MiRNA的表达量检测 qPCR用于检测miRNA表达谱, 进行qPCR以验证从微阵列分析获得的差异性miRNA表达谱。使用TRIzol提取总RNA,并通过生物分析仪确定RNA完整性。总RNA作为模板,并加入AMV逆转录酶(RT),RNase,dNTP,RT缓冲液和RT引物。将混合物在16 ℃孵育30 min,42 ℃孵育40 min和85 ℃孵育5 min,以生成miRNA cDNA文库。 U6用作内参。随后根据标准方案使用ABIPRISM©7900系统进行PCR定量。其条件为95 ℃下变性10 min,然后在95 ℃下10s,在60 ℃下延伸1 min,共循环40次。
1.3.4 MiRNA-7转染 将细胞接种在6孔板中,加入含有10%FBS的无酚红RPMI-1640培养基。 使用G-fectin,10 nmol 过表达mir-7的质粒(5′-UGGAAGACUAGUGAUUUUGUUGU-3′)进行转染。 并设置的空载RNA序列(5′-AAC AGT CGC GTT TGC GAC TGG-3′)作为阴性对照。 转染3 d后,换为不含miR-7的培养基。在初次转染后的第5天,使用qPCR对miR-7的表达水平进行评估。qPCR的引物序列如下:正向5′-GGGCCCGCTCTAGACT CGAGATATTTGCATGTCGCTATGTG-3′,反向5′-CGCGGCCGCCTAATGGATCCAAAAAAGGCACAGTC
GAGGCTGATC-3′。
1.3.5 Mir-7的靶标预测 TargetScan(http://www.targetscan.org/)、Microcosm Targets(http:// www.ebi.ac.uk/enright-srv/microcosm/htdocs/targets/v5/)和microRNA.org(http:/ /www.microrna.org/microrna/home.do)用于计算miRNA靶标预测。
1.3.6 EGFR的表达检测 加入细胞裂解液提取细胞蛋白,以13 500×g离心10 min去除细胞碎片,BCA法测量蛋白浓度,加入SDS-PAGE蛋白缓冲液混匀放置100 ℃ 取30 μg增量后的蛋白上样,80 V电泳2 h,20 V转膜45 min进行半干转,应用5%脱脂牛奶/BSA封闭1 h。加入EGFR一抗,4 ℃孵育,次日用TBST清洗3遍,每遍10 min,加入对应二抗,再用TBST清洗3遍,每遍10 min,显色曝光。

2 结 果
2.1 肺癌细胞对吉非替尼的IC50检测 通过CCK-8法检测,A549、H1299细胞的IC50分别为2.05 μg/mL、1.87 μg/mL,A549、H1299吉非替尼获得性耐药细胞的IC50分别为6.81 μg/mL、6.89 μg/mL,吉非替尼获得性耐药肺癌细胞的IC50是非耐药细胞的3倍。见图1。通过CCK-8法检测细胞的IC50结果显示,在不含吉非替尼的培养基中维持3周后,A549、H1299耐药细胞的 IC50不变(6.75 μg/mL、6.73 μg/mL)。
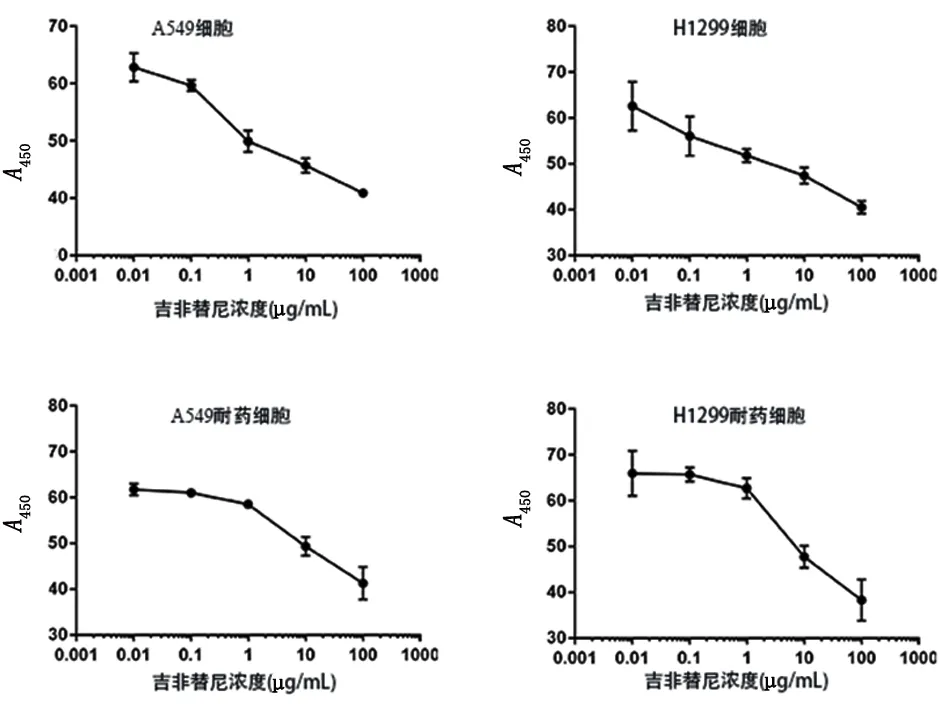
图 1 A549、H1299细胞与其获得性吉非替尼耐药细胞对吉非替尼的IC50值
Figure 1 A549 and H1299 control cell line and resistant cell line response to gefitinib treatment
2.2 耐药前后的细胞形态观察 与A549及H1299非耐药细胞比较,其耐药细胞生长较为缓慢,细胞形态扩大且扁平,耐药细胞类似于衰老细胞。耐药细胞暴露于高浓度的吉非替尼中细胞表现为急性丧失,伪足增加。见图2。

图 2 耐药细胞形态发生改变
Figure 2 the cell morphology of A549 and H1299 cells and their Gefitinibresistant cells line
2.3 耐药后细胞的MiRNA谱分析 在耐药细胞中检测到43种miRNA的表达谱发生了显着变化(1.98~15.0倍),其中有25种上调的miRNA和18种下调miRNA,选取差异较为明显的miRNA:mir-21、mir-124c、mir-181、mir-7、mir-146a、mir-145-p基因进行qPCR定量检测,结果表明mir-21、mir-124c、mir-181明显上调,mir-7、mir-146a、mir-145-p明显下调,与微阵列检测结果一致,其中mir-7变化最显著(P<0.05)。见表1,图3。
2.4 转染miR-7基因后的吉非替尼耐药细胞系的药物敏感性分析 耐药细胞中miR-7表达明显低于非耐药细胞。通过TargetScan,Microcosm Targets和microRNA.org目标预测软件对miR-7潜在靶标进行评估结果表明,EGFR是miR-7的靶基因之一。与未转染细胞mir-7表达量(0.84±0.10)比较,转染过表达mir-7的质粒后细胞(6.72±0.84)升高(P<0.05)。提取细胞蛋白,通过Western blot检测细胞内EGFR的表达水平发现,miR-7表达升高后,细胞内EGFR表达明显降低。表明miR-7是EGFR的负向调控因子,确定了EGFR与miR-7表达之间的相关性。见图4。通过CCK-8法比较耐药细胞及miR-7转染后细胞的IC50值的变化,结果表明,H1299耐药细胞IC50由7.23 μg/mL降低至2.46 μg/mL,A549耐药细胞IC50由6.85降低至2.23 μg/mL(P<0.05)。见图5。
表 1 吉非替尼耐药与非耐药H1299、A549肺癌细胞中microRNA的差异表达水平
Table 1 The differential expression levels of micro(mi)RNA in gefitinib resistant A549 and H1299 cells and parental cells
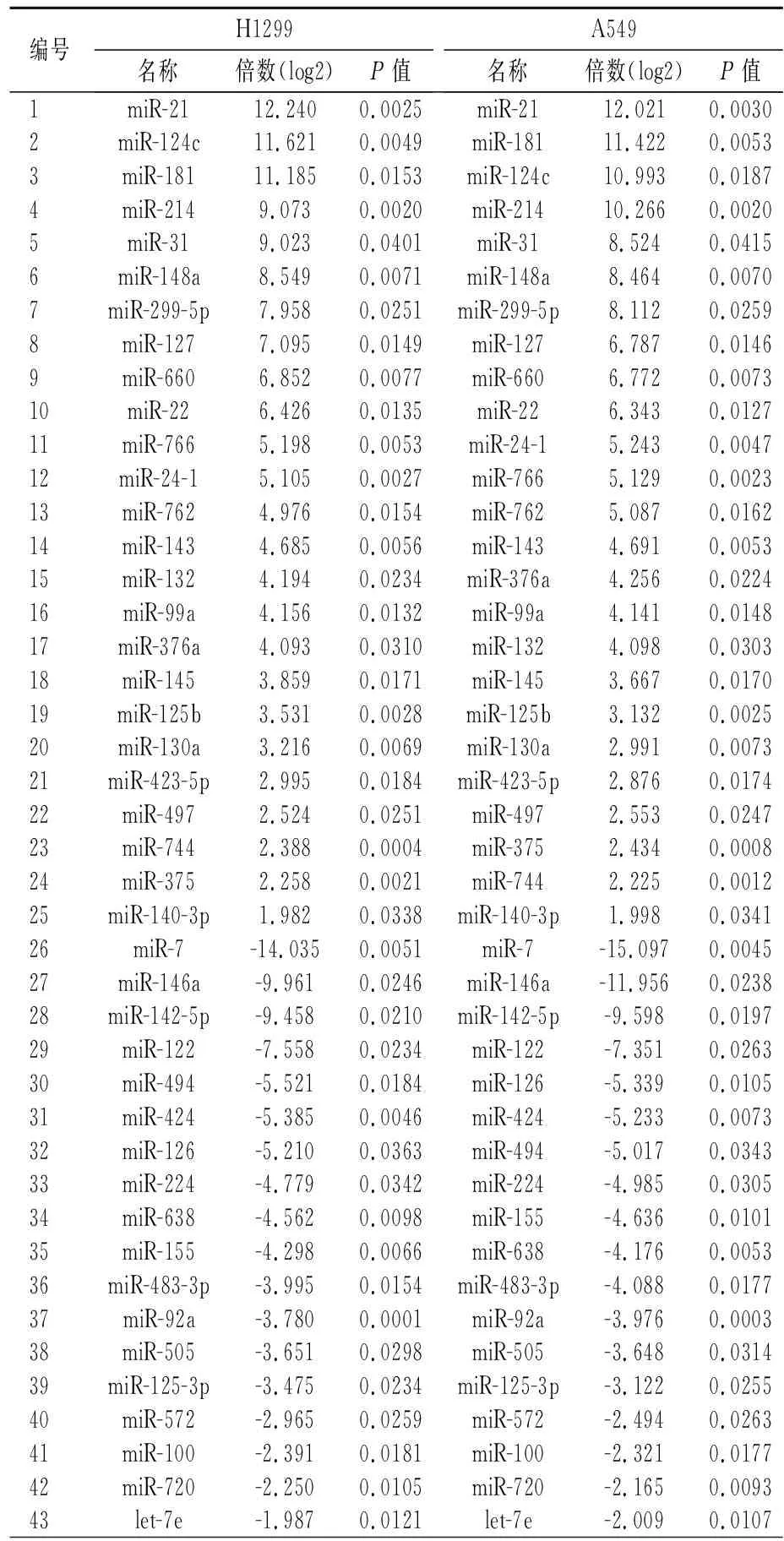
编号H1299名称倍数(log2)P值A549名称倍数(log2)P值1miR-2112.2400.0025miR-2112.0210.00302miR-124c11.6210.0049miR-18111.4220.00533miR-18111.1850.0153miR-124c10.9930.01874miR-2149.0730.0020miR-21410.2660.00205miR-319.0230.0401miR-318.5240.04156miR-148a8.5490.0071miR-148a8.4640.00707miR-299-5p7.9580.0251miR-299-5p8.1120.02598miR-1277.0950.0149miR-1276.7870.01469miR-6606.8520.0077miR-6606.7720.007310miR-226.4260.0135miR-226.3430.012711miR-7665.1980.0053miR-24-15.2430.004712miR-24-15.1050.0027miR-7665.1290.002313miR-7624.9760.0154miR-7625.0870.016214miR-1434.6850.0056miR-1434.6910.005315miR-1324.1940.0234miR-376a4.2560.022416miR-99a4.1560.0132miR-99a4.1410.014817miR-376a4.0930.0310miR-1324.0980.030318miR-1453.8590.0171miR-1453.6670.017019miR-125b3.5310.0028miR-125b3.1320.002520miR-130a3.2160.0069miR-130a2.9910.007321miR-423-5p2.9950.0184miR-423-5p2.8760.017422miR-4972.5240.0251miR-4972.5530.024723miR-7442.3880.0004miR-3752.4340.000824miR-3752.2580.0021miR-7442.2250.001225miR-140-3p1.9820.0338miR-140-3p1.9980.034126miR-7-14.0350.0051miR-7-15.0970.004527miR-146a-9.9610.0246miR-146a-11.9560.023828miR-142-5p-9.4580.0210miR-142-5p-9.5980.019729miR-122-7.5580.0234miR-122-7.3510.026330miR-494-5.5210.0184miR-126-5.3390.010531miR-424-5.3850.0046miR-424-5.2330.007332miR-126-5.2100.0363miR-494-5.0170.034333miR-224-4.7790.0342miR-224-4.9850.030534miR-638-4.5620.0098miR-155-4.6360.010135miR-155-4.2980.0066miR-638-4.1760.005336miR-483-3p-3.9950.0154miR-483-3p-4.0880.017737miR-92a-3.7800.0001miR-92a-3.9760.000338miR-505-3.6510.0298miR-505-3.6480.031439miR-125-3p-3.4750.0234miR-125-3p-3.1220.025540miR-572-2.9650.0259miR-572-2.4940.026341miR-100-2.3910.0181miR-100-2.3210.017742miR-720-2.2500.0105miR-720-2.1650.009343let-7e-1.9870.0121let-7e-2.0090.0107
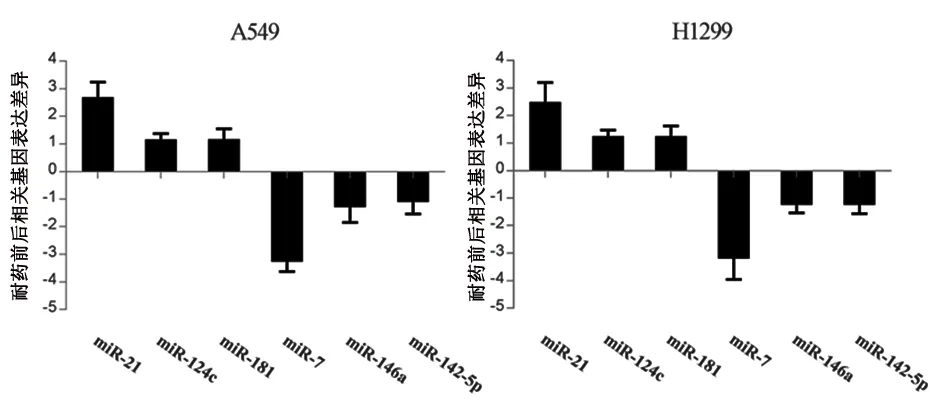
图 3 qPCR检测耐药细胞与非耐药细胞间miRNA的差异表达
Figure 3 q PCR used to detects the differential expression of miRNA between drug-resistant and the parental
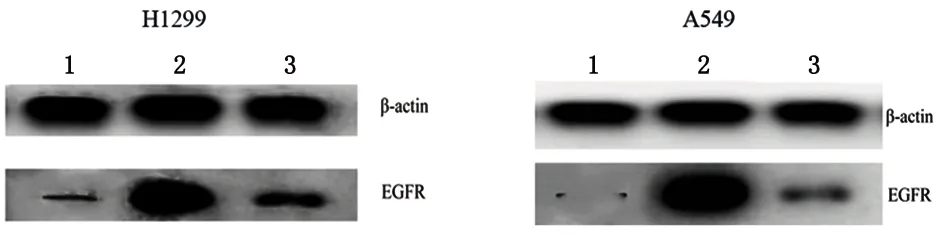
1:非耐药细胞;2:耐药细胞;3:耐药细胞转染miR-7质粒
图 4 Western blot检测H1299、A549 EGFR蛋白表达
Figure 4 Western blot analysis detectedthe expression of epidermal growth factor receptor (EGFR) protein in all kinds cells
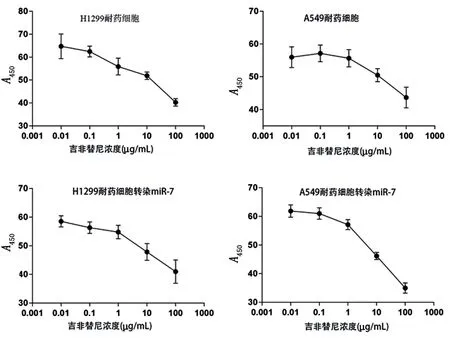
图 5 上调miR-7后耐药细胞的IC50
Figure 5 the IC50of gefitinib resistence cells witch transfected of miR-7 gene
3 讨 论
目前,化学疗法仍然是治疗NSCLC的主要治疗方法[21-22]。然而,化学疗法目前已经遇到了瓶颈,尽管部分患者对化疗药的初始反应良好,但大多数NSCLC患者仍会发生化疗耐药和复发[23-24]。因此,需要开发新型的靶向特异性分子以减轻耐药,对miRNA的研究使之成为可能。
已有报道关于miRNA在肺癌的药物耐药性中作用。此前的研究表明,miR-134/487b/655基因有助于转化生长因子-β1诱导的上皮-间质转化(epithelial-mesenchymal transition, EMT)且直接靶向作用于膜相关鸟苷酸激酶(membrane-associated guanylate kinaseinverted-2, MAGI2)WW和PDZ结构域从而影响吉非替尼的耐药性[25],而抑制MAGI2导致肺癌细胞磷酸酶和张力蛋白同源物丧失稳定性,这提示miR-134/miR-487b/miR-655簇可能是晚期肺腺癌患者的新型潜在治疗靶标。 Dong等[26]表明,与对顺铂敏感的细胞系相比,在顺铂耐药的肺癌细胞系中miR-31明显上调。 An等[27]使用miRNA芯片分析鉴定出经Rh2处理后的A549细胞与未处理的A549细胞相比,有24种miRNA存在明显的差异表达。还检测到miR-30b、miR-30c、miR-221和miR-222在吉非替尼刺激的NSCLC细胞中异常表达,这可能在吉非替尼诱导的NSCLC细胞凋亡和EMT中起重要作用[28]。这些作用可能是通过抑制BCL2、凋亡肽酶激活因子1、蛋白激酶Cε和肉瘤病毒癌基因同源物的基因的表达而介导的。
一项关于乳腺癌的研究表明,miR-7通过调节癌细胞中EGFR的表达在乳腺癌患者治疗的耐药性发展中发挥作用[29]。据报道,MiR-7还可以调节黑色素瘤细胞中IGF-1R的表达[30]。本研究中,通过微阵列技术对吉非替尼耐药A549、H1299细胞及非耐药细胞中MiRNA表达量的比较,筛选出差异表达较为明显的miR-7,qPCR研究结果表明吉非替尼耐药细胞的miR-7表达明显降低,qPCR检测结果与微阵列一致。本研究通过生物信息学分析软件预测了miR-7的靶标发现EGFR是miR-7的主要靶标之一,通过Western blot分别检测了2种细胞内EGFR的表达发现,耐药细胞EGFR表达明显高于非耐药细胞,本研究结果表明,EGFR受miR-7负调控作用,并且在吉非替尼耐药细胞中EGFR蛋白表达水平上调与miR-7的降低密切相关。
有报道,EGFR信号传导不仅有助于肿瘤细胞的增殖,分化、抗凋亡、血管生成和转移相关,而且还参与了疾病的进展[31]。因此,miR-7的降低导致EGFR表达升高在肺癌细胞治疗的耐药性发展中发挥重要作用。本研究结果表明,miR-7可能通过调节癌细胞中EGFR的表达。
本研究中,miRNA表达谱检测到了吉非替尼耐药和吉非替尼敏感的A549、H1299细胞之间的差异表达模式。在分析的miRNA基因中,有43种miRNA在细胞系之间发生了显着改变(>1.98倍),包括25种miRNA的上调和18种miRNA的下调。上述miRNA在细胞中的差异表达水平提示这些miRNA在NSCLC细胞耐药性发展中作用。
本研究的局限性在于只预测了miR-7的靶目标,所用细胞系较少,后续将选用更多细胞系, 对筛选出的更多miRNA进行预测,进一步证实miRNA在细胞中的差异表达在细胞耐药中发挥重要作用。

