CuCe氧化物催化剂的制备及CWPO降解双酚A废水研究
焦昭杰,陈立功,柳云骐,张贤明,龚海峰,高旭
(1 重庆工商大学废油资源化技术与装备教育部工程研究中心,重庆400067; 2 中国石油大学(华东)重质油国家重点实验室,山东青岛266580; 3 重庆工商大学智能制造服务国际科技合作基地,重庆400067)
引 言
双酚A(BPA)是世界上生产和消费量最大的化学品之一[1],2012 年的全球需求量超过650 万吨,之后以每年约4.6%的速度增长[2]。BPA 主要用于制造环氧树脂、改性酚醛树脂等多种树脂,也用于制备抗氧剂、增塑剂、热敏纸、油漆、农药等[1,3-4]。它可通过原料的生产加工、垃圾渗滤液及含BPA 成分的废水的排放迁移到环境当中[5],在河流、饮料、土壤、空气中均有被检测到[6-7],其中在饮料瓶中检测到的浓度甚至可达568 ng·g-1[8],在美国食品中BPA的平均浓度达到3 ng·g-1(湿重)[9]。BPA 在环境中性质较为稳定、不易挥发、具有生物累积性、难于生物降解[10],自然降解需要90 多年[11]。BPA 可以通过模拟激素的阻断和触发作用而干扰内分泌系统,少量摄取就能破坏人体的内分泌系统,会对肝细胞造成损害,可引发肥胖[12]、不育、畸胎、乳腺癌等[8,10,13],在1000~10000 μg·L-1浓度范围内,对水生生物都有急性毒性[1]。因此研究BPA 的去除方法十分必要。
高级氧化法在处理持久性有机污染物(POPs)方面被认为是比较有前景的。采用Fenton法对BPA进行处理,前期试验表明,硫酸亚铁和硫酸铁作为催化剂对BPA 催化氧化降解效果较差,离心分离后水质依然偏黄,且需调节pH 在2~4 内,沉淀3 d 后水质才较澄清,去除率仅有75%左右。采用硝酸铜、氯化铜和硫酸铜3种铜类化合物作为催化剂,反应65 min 后,BPA 去除率均超过了95%。该方法存在的最大缺点是催化剂是一次性的,需要考虑金属离子的二次污染和回收措施,同时在碱性条件下,会发生沉淀反应,易导致活性组分减少。催化湿式氧化法(CWAO)由于氧化剂是空气或氧气,仍需要在较高的温度和压力下反应,反应条件比较苛刻,如Žerjav 等[14]在温度200℃、压力2.5 MPa 下处理BPA,改变反应参数,TOC 去除率在40%~80%间波动。Kaplan 等[15]在温度200℃、压力2.55 MPa 下经5~10次循环反应,BPA去除率可达98%。CWPO法中催化剂一般选择性、通用性较差且要求在pH 2~4 条件下反应,如使用含铁催化剂,反应需要在pH 3[16-18]条件下进行;使用Fe-C(GS)催化剂降解BPA在早期阶段就损失约20%的Fe[16];使用Fe-Mt-TCC 催化剂降解BPA 时,催化剂循环3 次后,效率从100%下降到62%[17]。Cu 基催化剂具有较高的BPA降解能力[19],但也存在活性组分流失的问题,并且一些催化剂的制备过程比较复杂[20-22]。为了提高Cu基催化剂的性能,可以改性添加不同的元素,如Zr、V、Ce和Mn。其中,Ce被认为是非常有效的添加剂,可提高催化剂表面活性组分的分散度和机械强度,也能提高其耐酸性,有利于增强催化剂的稳定性[23-24]。因此,将Ce氧化物和CuO 复合,制得CuCe 氧化物催化剂,有望能克服上述问题。目前国内外对CuCe氧化物催化剂的研究较多,其制备方法大多采用沉淀法、水热法、模板法或浸渍法,且Cu∶Ce摩尔比较小,Cu 物种含量较低,一般介于1.2%~10%,更多关注结构形貌、表面物种在气固相状态下的催化性能[25],研究多集中在CO 氧化[26-27]、N2O催化分解[28]、脱硝[25]、甲苯脱除[29]、甲醇氧化[30]等方面,如Liu 等[31]采用不同方法制备了CuCe 氧化物催化剂,其中模板法效果最好,CO 转化率可达99.6%;Liu 等[28]采用水热法制备的CuCe 氧化物催化剂能够使CuO 和CeO2之间形成较强的相互作用力,且能促进Cu2+/Cu+和Ce4+/Ce3+离子对之间的氧化还原循环,对N2O 有较强的分解作用。但CuCe 氧化物催化剂在液固相条件下的研究较少,尤其在处理BPA 废水方面的研究还未有报道。
本文拟采用与上述方法不同的柠檬酸络合法制备出Cu 物种含量相对较高、pH 适应范围宽、催化效果好的CuCe 氧化物催化剂,以BPA 废水为目标污染物,考察影响BPA 降解性能的影响因素,并分析BPA 降解路径,为实际BPA 废水的CWPO 降解提供技术参考。
1 试验材料和方法
1.1 试验材料与仪器
BPA(C15H16O2,Adamas)、香 豆 素(C9H6O2,Adamas)、7-羟基香豆素(C9H6O3,Acros)、硝酸铜(Cu(NO3)2·3H2O)、双氧水(H2O2,30%)购自重庆川东化工(集团)有限公司,以上均为分析纯。
紫外可见分光光度仪(UV-2550,日本岛津)、总有机碳(TOC)分析仪(TOC-VCPN,日本岛津)、荧光分光光度计(F-7100,日本HITACHI)、电感耦合等离子体发射光谱仪(ICP2060T,江苏天瑞仪器股份有限公司)、GC-MS 气质联用仪(7890B/5977B,美国安捷伦)、LC-MS 液质联用仪(ACQUITY UPLC IClass Plus/VION IMS QTof,美国waters)。
1.2 催化剂制备
称取Cu∶Ce 摩尔比为1∶1 的Cu(NO3)2·3H2O 和Ce(NO3)3·6H2O 溶入适量的蒸馏水,加入柠檬酸(CA),柠檬酸与Ce+Cu 的摩尔比为1.8,搅拌溶解并蒸干。将蒸干的固体样品放入100℃的烘箱中恒温干燥20 h 左右。干燥后的样品,在马弗炉中以10℃·min-1程序升温到450℃,在450℃下恒温焙烧3.0 h,制得CuCe 氧化物催化剂记作CC450。经检测CC450 催化剂中Cu∶Ce 摩尔比为1.08∶1。改变焙烧温度分别制得CC550、CC650、CC750 催化剂,改变Cu∶Ce 摩尔比分别制得Cu2Ce1、Cu1Ce2、Cu1Ce3催化剂,其焙烧温度均为650℃,其中CC450中Cu物种含量为26.7%。
1.3 催化剂表征
XRD 分析由日本岛津X 射线衍射仪(XRD-6100)测定,形貌分析由日本日立公司S-4800 型电子扫描电镜(SEM)测定。催化剂的可还原性分析由H2-TPR 仪测定。XPS 分析由英国X 射线光电子能谱仪(XSAM800)测定。
1.4 分析方法
BPA废水的CWPO降解反应在具塞锥形瓶中进行,反应温度由恒温水浴控制。向锥形瓶中加入一定量的BPA 废水(由蒸馏水和BPA 组成),然后加入一定量的催化剂,再加入一定浓度的质量分数30%的H2O2,盖紧塞子,在110 r·min-1和一定温度下反应一定的时间,反应后经离心分离,取上清液分别测定吸光度和TOC 值。BPA 浓度由紫外可见分光光度仪测定计算,波长经全波长扫描确定为276.4 nm。总有机碳由TOC 仪测定。H2O2浓度由钛盐光度法测定,最大吸收波长为430 nm[11]。·OH 浓度的测定通过香豆素捕获·OH,由荧光分光光度法检测生成的7-羟基香豆素间接测定[32],经全谱荧光扫描确定香豆素的最大激发波长为277 nm,最大发射波长为392 nm;7-羟基香豆素的最大激发波长为321 nm,最大发射波长为452.6 nm。
中间产物检测:样品预处理,样品通过真空离子浓缩仪进行浓缩,GC-MS 和LC-MS 分别用二氯甲烷和甲醇作溶剂。GC-MS 中间产物分析:仪器条件,色谱柱,HP-5;进样口温度,260℃;载气,He;流速,1 ml·min-1;分流比:10/1;进样量:1 μl。升温程序:柱温40℃,保持3 min,以15℃·min-1升温至100℃,保持2 min,以15℃·min-1升温至180℃,保持2 min,以15℃·min-1升温至240℃,保持2 min,以15℃·min-1升温至280℃,保持2 min。MS 条件:四极杆温度,150℃;离子源温度,230℃;电子轰击源70 eV;质量扫描范围:m/z 45~280。LC-MS中间产物分析:仪器条件:色谱柱,BEH-C18;毛细管电压,0.8 kV;气体流速,50 L·h-1;离子源温度,120℃;溶剂脱除流量,800 L·h-1;脱除溶剂温度,550℃;水相含0.1%甲酸;流速0.3 ml·min-1。
2 结果与讨论
2.1 XRD表征
由 图1 可 知,在 衍 射 角2θ=28.5°{111}、33.1°{200}、47.5°{220}、56.4°{311}、76.7°{331}和79.1°{420}处形成了较高强度的衍射峰,与具有萤石结构、立方晶型的CeO2晶相(JCPDS No.65-2975,其中a=b=c=5.411 Å,1 Å=0.1 nm)衍射峰相符[33]。在衍射角2θ=35.6°和38.7°处形成了强度较弱的衍射峰,与CuO 晶相(JCPDS No.41-0254)衍射峰相符[34]。对XRD数据进行分析计算,得到表1所示参数。

图1 制备的CuCe氧化物催化剂XRD谱图Fig.1 XRD patterns of CuCe oxide catalysts
由图1 可知,不同制备条件下催化剂形成的衍射峰位基本相同,由表1 可知,CuCe 氧化物催化剂的a 晶胞参数均小于纯相CeO2晶胞参数(5.4103 Å),表明高温热处理能促进离子半径小的Cu2+溶入到CeO2晶格中。由衍射峰位和晶胞参数可知,CuO 可能溶入到CeO2晶格中形成了CuCe 氧化物固溶体。固溶体的形成能促进CuO 与CeO2间产生较强的相互作用,能有效削弱Cu—O 与Ce—O 键,从而促进化学键在反应中断裂形成高活性氧物种[28]。由图1可知,特征衍射峰峰位并不随焙烧温度的升高而发生变化,说明催化剂具有良好的高温稳定性。当焙烧温度较低时,CuO 和CeO2衍射峰的峰形较宽,峰强较弱,表明在低温焙烧下制得的CuO 和CeO2晶粒细小,结晶度较差,且可能含有一定的非晶相成分。随着焙烧温度的升高,CuO 和CeO2的衍射峰的峰形变窄,峰强度变强,说明CuO 和CeO2晶粒尺寸逐渐长大,结晶度逐渐趋于完好,与表1计算的结晶度和晶粒尺寸变化趋势一致。当Cu/Ce 摩尔比不同时,CuO 衍射峰的峰形和峰强变化相较CeO2衍射峰的峰形和峰强变化明显,当Cu/Ce 摩尔比由小到大变化时,CuO衍射峰的峰形和峰强逐渐变窄变强,且其平均晶粒尺寸和结晶度逐渐变大,说明催化剂的物相结构受Cu/Ce摩尔比影响较大。

表1 制得的CuCe氧化物催化剂参数Table 1 Parameters of CuCe oxide catalysts
2.2 SEM分析

图2 制备的CuCe氧化物催化剂的SEM图Fig.2 SEM images of CuCe oxide catalysts
由图2可知,制备的催化剂表面孔隙、颗粒大小和均匀度不一,但都形成了大量的粗糙、疏松和多孔的絮状结构,这是由于在干燥和高温焙烧过程中柠檬酸和硝酸盐的受热分解产生的大量CO2、CO、H2O 和NOx气 体 形 成 的。由 图2 可 知,CC550 和CC650 催化剂表面形成了大量粗糙和多孔絮状结构,且颗粒大小和孔隙分布相对比较均匀,CC750催化剂以致密表面为主,孔结构明显减少且表面结构更致密,说明适当的焙烧温度能促进催化剂表面多孔结构的形成,更高温度可能会使催化剂孔结构被烧坍塌,甚至有导致催化剂表面粒子团聚的趋势。Cu2Ce1催化剂孔状结构和蓬松度明显少于Cu1Ce3催化剂,这可归因于Ce含量的提高更有利于孔状结构的形成,有利于提高其蓬松度。
2.3 H2-TPR分析
纯相CeO2分别在500℃和800℃处有两个H2-TPR 耗氢峰[35],纯相CuO 在300℃附近有H2-TPR 耗氢峰[36]。由图3 可知,催化剂耗氢峰位对应的还原温度明显低于纯相,表明催化剂中CeO2和CuO 物种的性质发生了变化,可还原性增强。SEM 分析可知,催化剂表面具有粗糙多孔的絮状结构,为H2分子的吸附和反应提供了有利的场所,可促进表面可还原物种的还原。XRD 表征证实,Cu2+溶入CeO2晶格形成了CuCe氧化物固溶体,使得催化剂中Cu—O和Ce—O 键受到一定程度的削弱,导致相应组分的可还原性增强。由图3 可知,不同条件制备的催化剂起始反应温度和耗氢峰位不同,随着焙烧温度和Cu 含量的升高,向高温方向移动,且耗氢峰峰形明显变宽变高,可还原性降低,说明高分散在CeO2表面的CuO 有团聚和含量增大的趋势,与XRD 表征数据晶粒尺寸和结晶度变化相符。图中在低温处的α耗氢峰可归属为催化剂表面高分散的非晶相CuO或与CeO2间存在强相互作用的CuO 簇还原耗氢而形成,高温处的β 耗氢峰可归属于催化剂体相中与CeO2有强相互作用的CuO 和团聚后形成的较大颗粒的CuO的还原耗氢而形成。
2.4 XPS表征
由图4(a)可知,催化剂的Ce 3d XPS 谱图形成了6个明显的XPS峰,其中900.5 eV和882.3 eV处的峰,分别归属于Ce 3d3/2和Ce 3d5/2产生的主峰;916.5、907.1 eV 和897.9、888.2 eV 处的峰,分别是Ce 3d3/2和Ce 3d5/2产生的伴峰,表明催化剂表面主要存在CeO2
[37]。不同条件制备的催化剂Ce 3d XPS 峰所对应的峰位一致,表明焙烧温度和Cu/Ce 摩尔比对催化剂表面Ce物种的化学环境几乎没有影响。

图3 制备的CuCe氧化物催化剂的H2-TPR谱图Fig.3 H2-TPR profiles of CuCe oxide catalysts
由图4(b)可知,催化剂的Cu 2p XPS 谱图上均形成了4个明显的XPS峰,其中953.6 eV和933.6 eV处的峰,分别归属于Cu 2p1/2和Cu 2p3/2的主峰;961.6 eV和941.8 eV处的峰,分别归属于Cu 2p1/2和Cu 2p3/2的伴峰。该四处XPS 峰是Cu2+的特征峰[38],表明催化剂表面Cu 物种主要以CuO 的形式存在。由图4(b)可知,在电子结合能932.4 eV 处存在一个较弱的Cu 2p3/2谱峰,该处属于Cu+的特征峰[39],表明催化剂表面可能存在微量的Cu2O 物种,可归因于催化剂制备过程中柠檬酸或热分解生成的CO 等还原性气体在高温下对CuO物种的还原形成。
图4(c)是催化剂的O1s XPS 谱图。其中528.5~529.8 eV 的峰归属于催化剂表面晶格氧O2-,电子结合能为529.8~531 eV的峰归属于催化剂表面吸附氧或O-,而电子结合能为531.6 eV的峰则为表面吸附水的羟基氧OH-[40]。由图4(c)可知,催化剂晶格氧的XPS 峰较强,峰面积远大于吸附氧和羟基氧的峰强和峰面积,而由表2可知,晶格氧的含量均在62%以上,说明催化剂表面以分散的CuO、CeO2或CuCe氧化物固溶体为主,这可能是由于CuO 和CeO2之间的相互作用,形成了更多的氧空位,从而使晶格氧的流动性和可利用性增强[41],同时由于Ce 的掺杂有利于提高催化剂晶格氧的含量[42]。
2.5 制备条件对CWPO性能的影响

图4 制备的CuCe氧化物催化剂Ce 3d、Cu 2p和O 1s的XPS谱图Fig.4 Ce 3d,Cu 2p and O 1s XPS spectra of CuCe oxide catalysts

表2 制备的CuCe氧化物催化剂XPS参数Table 2 XPS parameters of CuCe oxide catalysts
试验前,考察了BPA 溶液挥发、单独H2O2氧化和单独催化剂的吸附作用分别对BPA 的降解贡献,反应95 min 后,其对应的去除率分别为7.14%、7.46%和9.02%,远低于同条件下催化剂和H2O2协同作用91.8%的去除率,基本上可忽略。另外考察了相同制备条件下不含Ce 组分的催化剂即CuO 对BPA 的去除效果,反应95 min 后去除率为93.1%,但缺点是Cu2+析出严重。由图5 可知,BPA 去除率与TOC 去除率变化趋势基本一致。在焙烧温度为450℃时,BPA 的去除率和TOC 去除率分别为91.8%和84.5%,随着焙烧温度升高,略微下降,但在550℃和650℃时,去除率仍高于91.5%,当焙烧温度继续升高到750℃时,BPA 的去除率下降到89.3%。由Cu2+析出浓度可知,在焙烧温度450℃和650℃条件下,Cu2+析出浓度分别为19.3 mg·L-1和16.9 mg·L-1,相差不大,从制备成本出发,选择450℃为较合理焙烧温度。在Cu/Ce 摩尔比为1.0 时,催化剂具有最佳的催化活性,BPA 的去除率和TOC 去除率均高于91.5%和81.5%。
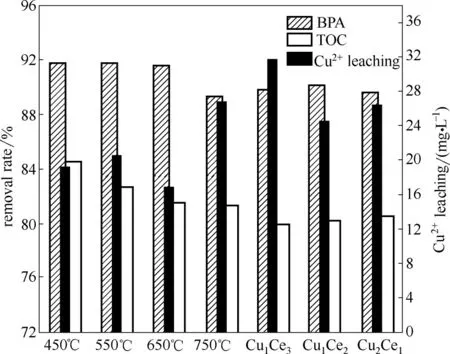
图5 制备条件对CWPO性能的影响Fig.5 Effects of preparations on heterogeneous CWPO performance of bisphenol A(催化剂=1 g·L-1,BPA=152 mg·L-1,H2O2=196 mmol·L-1,pH=6.6,t=95 min,T=75℃)
在非均相CWPO 反应中,催化剂的催化性能与其活性组分和结构有一定的关系,XRD 与XPS 表征可知,催化剂表面存在Ce4+、Cu2+和丰富的O 物种。在固溶体中,Cu2+取代CeO2晶格中部分Ce4+,破坏了CeO2晶格的配位平衡,产生了氧空缺,有利于增强催化剂对H2O2分子的吸附和活化能力,也有利于氧物种在催化剂中的扩散和迁移。同时固溶体的形成会使CuO 与CeO2之间形成较强的相互作用力,这种作用力能降低反应温度、提高反应活性和增强催化剂的结构稳定性。当Cu/Ce 摩尔比较低时,催化剂中Cu 物种相对含量降低,如XPS 结果显示Cu1Ce3催化剂,表面Cu 含量只有8.92%,晶格氧含量最低为62.71%,可能不利于CuCe 固溶体的形成。当Cu/Ce 摩尔比较高时,如Cu2Ce1,表面Cu 含量最高,为18.90%,可能导致CuO 含量超过了CeO2晶格中的饱和容量使得CuO 不能完全充分地溶入CeO2晶格中。因此,过高和过低的Cu/Ce 摩尔比都会削弱Cu 物种与Ce 物种间的相互作用,表现出较差的催化活性;同时使得大部分Cu物种以非固溶体的形式存在,导致活性组分易析出,如图5 三种不同摩尔比的催化剂,Cu2+析出浓度均高于Cu/Ce 摩尔比为1 时的析出量。
2.6 H2O2用量对CWPO性能的影响
由图6可知,随着H2O2用量的增加,BPA 的去除率和H2O2的消耗率呈逐渐增大趋势,反应65 min后,在H2O2用量为313 mmol·L-1时,BPA 的去除率达最高为92.4%,TOC 去除率和H2O2消耗率分别为84.7%和100%;在H2O2用量为196 mmol·L-1时,BPA的去除率为87.6%,TOC 去除率和H2O2消耗率分别为80.6%和99.9%,两者相差不大,综合来看,H2O2用量选择196 mmol·L-1比较经济。由图6可知,在反应初期BPA 的去除率随H2O2用量的增加而增加,可归因于在反应初期反应体系中能生成较多的·OH自由基用于有机物的催化氧化降解。在反应后期,去除率曲线逐渐趋于平缓,可能是由于反应体系中BPA 的量一定,当反应体系中BPA 几乎被降解完后,剩余的BPA 浓度降低,其进一步与·OH 反应的概率降低;同时反应进行到一定程度后,可能生成了少量的难降解的中间产物;另外一个原因是H2O2发生的副反应,如H2O2自身热分解,与生成的·OH还会发生自身消耗反应,生成弱氧化性物种(如HO2·和·O2)[43],从而降低体系的催化氧化效率。

图6 H2O2用量对CWPO性能的影响Fig.6 Effect of H2O2 dosage on BPA degradation by CWPO(催化剂=1 g·L-1,BPA=152 mg·L-1,pH=6.6,T=75℃)
2.7 BPA初始浓度对CWPO性能的影响
由图7 可知,当BPA 浓度从40.1 mg·L-1增加到331 mg·L-1时,在反应15 min 后,BPA 的去除率从60.9%降低到43.6%,H2O2的消耗率从85.6%降低到45.1%,去除率和消耗率变化明显,反应35 min 后去除率和消耗率曲线趋于平缓,说明在反应初期BPA浓度的变化对反应体系有很大影响。在反应65 min后,BPA 的去除率均高于86.7%,H2O2的消耗率均高于90.0%,说明在反应后期,去除率和消耗率受浓度变化影响不大。反应初期,BPA 的去除率均随浓度升高而降低,可能是由于反应初期在短时间内不能产生足够多的强氧化·OH 自由基,同时由于污染物浓度过大,造成附着在催化剂表面的浓度较高,导致边界层厚度和传质阻力增加,影响·OH 与污染物的充分接触。反应后期,体系中有了足够多的·OH自由基,从而使得去除率受初始浓度影响不大。
2.8 初始pH对CWPO性能的影响

图7 BPA初始浓度对CWPO性能的影响Fig.7 Effect of initial concentrations on BPA degradation by CWPO(催化剂=1 g·L-1,H2O2=196 mmol·L-1,pH=6.6,T=75℃)
由图8(a)可知,在pH3.0~7.9 范围内,BPA 的去除率均相差不大。反应65 min 后,在pH 3.0、4.7、6.6 和7.9 条件下,BPA 的去除率分别为94.0%、91.3%、87.6% 和88.8%,H2O2的 消 耗 率 分 别 为97.0%、99.9%、99.9%和99.9%,均达到了较高水平,说明在此pH 范围内,催化剂的催化降解效果没有受到较大影响,催化剂具有较高的pH 适应性。由于单一的BPA 废水pH 通常在中性左右,故反应过程中不需要额外调节废水的pH。由图8(b)可知,在pH 1.6、2.0 和3.0 条件下,反应85 min 后,BPA 的去除率分别为78.1%、91.6%和98.1%,TOC 去除率分别为69.5%、81.5%和83.6%,说明在pH 3.0 以下对BPA 的去除依然具有一定的效果。但Cu2+析出严重,Cu2+析出分别为106.8、106.8 和102.1 mg·L-1,反应液中没有检测到Ce4+,说明在强酸性条件下,Cu物种较Ce 物种更容易析出。在pH 4.7、6.6 和7.9 条件下,Cu2+析出分别为32.5、26.4 和23.9 mg·L-1,相比强酸性条件下析出情况大大下降。在pH 10.1 条件下,Cu2+的析出达到最低值为0.36 mg·L-1,但BPA 的去除率只有8.2%。以上说明强酸环境对CuCe 氧化物催化剂的结构有很大破坏,当反应体系pH 比较低时,在反应早期BPA 的去除率和TOC 去除率均较低,可归因于在CWPO 反应过程中催化剂中的CuO物种在酸性条件下溶解,破坏了催化剂的结构,使得催化剂表面活性中心数量减少,不利于H2O2分子的活化。但随着反应的进一步进行,体系中有了足够多的·OH自由基,pH影响逐渐降低。当反应体系pH 大于11.9 时,BPA 的去除率又急剧下降,可归因于在较高pH 条件下,H2O2会与·OH 发生反应生成HO2·和O2,导致溶液中产生的·OH 量急剧降低。由上可知,CuCe 氧化物催化剂的pH 适应性较强,在pH 1.6~7.9 范围内,均具有较高的催化活性,可归因于稀土元素Ce的添加。
2.9 羟基自由基浓度变化及降解路径分析
由图9 可知,随着反应时间的延长,体系中·OH自由基的浓度呈逐渐下降趋势,说明大量的·OH 自由基参与了反应。BPA 中间产物的检测条件为:BPA 初始浓度152 mg·L-1、催化剂用量1 g·L-1、H2O2用量196 mmol·L-1、室温及在3~10 min 内取样。LC-MS 和GC-MS 检测到的中间产物及结构如表3所示。从检测到的中间产物来看与Chen 等[44]检测的中间产物有许多相同,说明BPA 在不同催化剂条件下,可能具有相同的降解路径。可能主要是由于BPA 结构对称,强氧化性·OH 自由基的进攻位置基本相同。当BPA 接触到催化剂和H2O2后,反应就会迅速进行,在室温下,就会渐渐有颜色产生,BPA 中的C—C 键或者O—H 就遭到了破坏,可能生成了大分子物种,后进一步生成对羟基甲苯,之后生成苯酚,苯酚又进一步被氧化生成对二苯酚,对二苯酚经脱氢后,生成苯醌,这条路径也可能可逆。另一条路径可能是双酚A之间的接合生成了大分子量的酚,之后键断裂生成了2,4-二叔丁基苯酚和2,5-二叔丁基苯酚,然后又继续氧化,可能生成了邻甲酚,后继续可能生成了大分子醇或酮化合物,酮化合物进一步被氧化为4-乙基苯甲醛和对异丙烯基苯酚,然后进一步被氧化为对二甲苯和苯乙烯。这几条路径下,可能都生成了苯酚,苯酚又进一步被氧化为乙酸、丙酸、甲醛、乙醛或者草酸等,最后被进一步氧化为CO2和H2O。BPA可能的降解路径如图10所示。

图8 初始pH对CWPO性能的影响Fig.8 Effect of pH on BPA degradation by CWPO(催化剂=1 g·L-1,H2O2=196 mmol·L-1,BPA=152 mg·L-1)

图9 CWPO反应过程中·OH自由基浓度的变化Fig.9 Variations of·OH concentration in CWPO system(催化剂=1 g·L-1,H2O2=196 mmol·L-1,BPA=152 mg·L-1,T=75℃)
3 结 论
(1)催化剂中离子半径小的Cu2+溶入CeO2晶格中形成了CuCe 氧化物固溶体,在其表面主要存在Ce4+、Cu2+和丰富的O 物种。制备的催化剂具有良好的高温稳定性,但物相结构受Cu/Ce 摩尔比影响较大。适当的焙烧温度能促进催化剂表面粗糙、疏松、多孔结构的形成。随着焙烧温度和Cu含量的升高,催化剂可还原性降低。
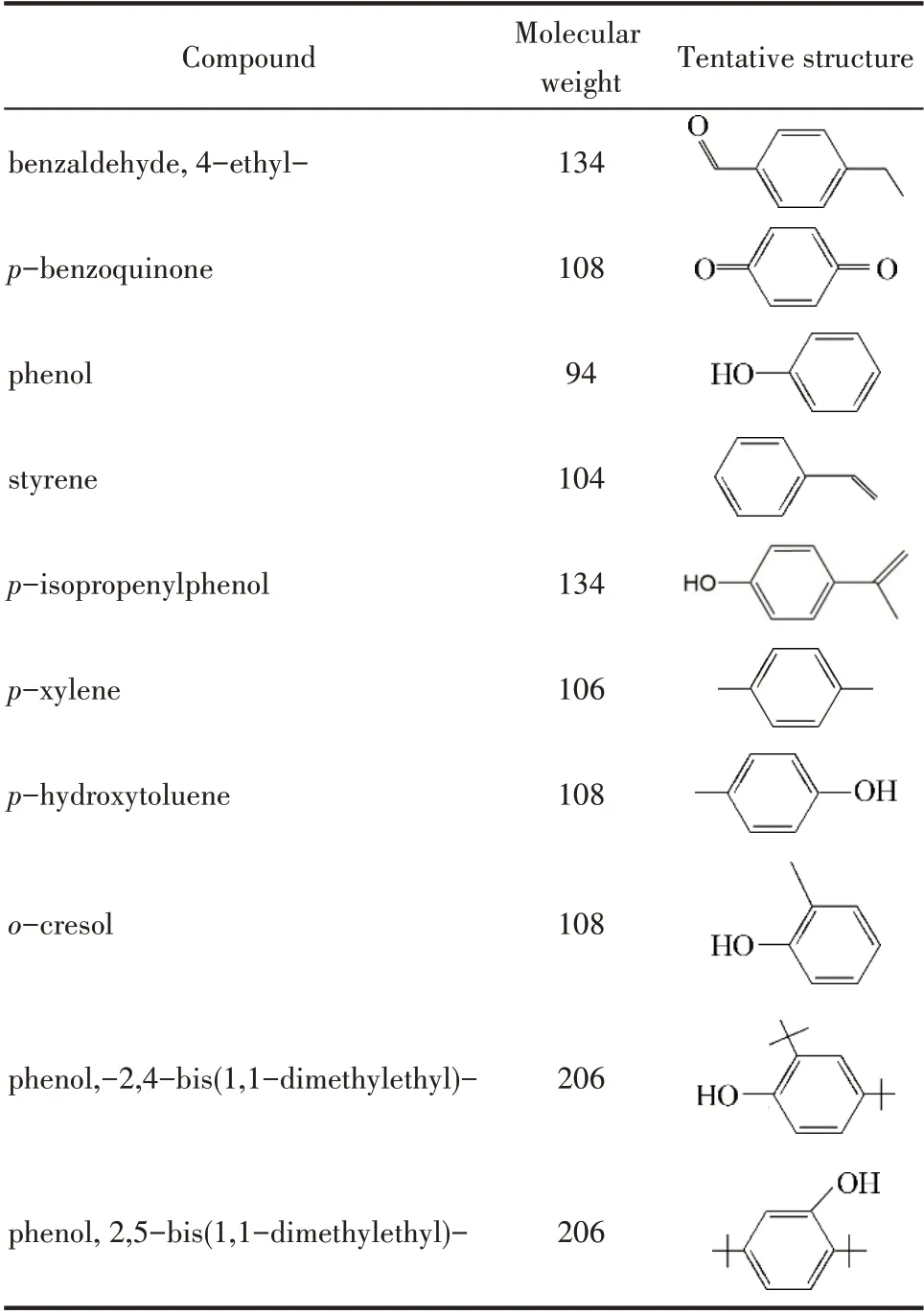
表3 BPA降解过程中可能的主要中间产物Table 3 Possible major intermediates in BPA degradation process
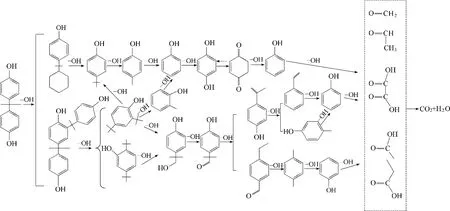
图10 可能的BPA降解路径Fig.10 Probable degradation pathway of BPA
(2)在Cu/Ce 摩尔比1.0、焙烧温度450℃、催化剂用量1 g·L-1、H2O2用量196 mmol·L-1、BPA 浓度152 mg·L-1、pH 6.6、反应温度75℃反应95 min 后,BPA 和TOC 去除率较高,分别为91.8%和84.5%,H2O2消耗率为99.9%。催化剂的pH 适应性较强,在pH 1.6~7.9 范围内,均具有较高的催化活性,反应过程不需要调节pH。在BPA 的降解过程中主要检测到了10 个中间产物。制备的催化剂应用于BPA的CWPO 反应,可为有毒、难生物降解含苯环的有机废水的预处理或深度处理提供思路。

