离子液体用于四氢呋喃-乙醇-水三元共沸物系分离的研究
李文秀,张羽,曹颖,丁忠瀚,赵思雨,张弢
(沈阳化工大学化学工程学院,辽宁沈阳110142)
引 言
四氢呋喃(THF)和乙醇都是重要的有机溶剂,含有THF、乙醇和水的混合物广泛存在于如十八烷基炔诺酮生产过程等化工和制药过程中[1],THF-乙醇-水三元混合物的分离具有实用价值。由于THF、乙醇和水之间可形成三个二元共沸,即两两共沸,通过常规的精馏方法难以有效地对三者的混合物进行分离。特殊精馏方法如共沸精馏、变压精馏和萃取精馏广泛用于分离共沸物[2-13]。其中萃取精馏通过添加萃取剂来改变轻组分和重组分之间的相对挥发度,从而消除二者的共沸现象,在分离共沸混合物方面已经被大量而深入地研究。
萃取剂的选择是萃取精馏过程中的至关重要的影响因素。常见的有机溶剂如乙二醇、二甲基亚砜、甘油等常被用作萃取精馏中的萃取剂。林毅等[14]以N,N-二甲基甲酰胺为萃取剂对从THF、乙醇和水混合液中提取THF 和乙醇进行了研究,结果显示所得产品中THF 的质量分数为99.61%,乙醇的质量分数为90.24%,水的质量分数为99.99%。Zhao等[15]分别采用二甲基亚砜(DMSO)、乙二醇(EG)以及它们的混合物作为萃取剂研究了THF-乙醇-水三元共沸物的分离过程,结果表明以DMSO和EG的混合物为萃取剂显示出了比以DMSO 和EG 作为单一溶剂更好的分离效果,并且三种产物的摩尔分数分别为THF 99.9%,乙醇99.9%,水99.9%。尽管上述研究中的有机溶剂对于THF-乙醇-水的分离都达到了较好的结果,但传统有机溶剂的一些缺点如易挥发、用量大、稳定性差等仍无法避免。
离子液体作为一种绿色溶剂近年来受到广泛关注,因其可忽略的蒸气压和良好的热稳定性等特质[16-18],已经被广泛地作为传统有机溶剂的替代品。目前,使用离子液体分离THF-乙醇-水三元共沸物系的研究尚未见报道。因此,通过模拟研究分析离子液体用于THF-乙醇-水三元共沸物系的分离很有必要。
本文使用COSMOThermX 软件,对能够分离THF-乙醇二元共沸物的三种离子液体(1-丁基-3-甲基咪唑四氟硼酸盐[BMIM][BF4]、1-辛基-3-甲基咪唑四氟硼酸盐[OMIM] [BF4]和1-丁基-3-甲基咪唑二氰胺[BMIM] [DCA][19]进行了初步筛选,以获得可能适于分离THF-乙醇-水三元体系的离子液体萃取剂。利用COSMO-RS 模型预测水-离子液体二元体系的汽液相平衡数据,并使用NRTL 模型进行数据拟合以获得水-离子液体的二元交互参数。利用Aspen Plus 软件模拟了含有离子液体的THF-乙醇-水三元混合物的萃取精馏过程,并通过σ-谱图分析了THF-乙醇-水-离子液体四元体系中分子间的相互作用规律,对离子液体作为萃取剂用于THF-乙醇-水三元体系的萃取精馏过程进行了研究。
1 溶剂筛选和流程模拟
1.1 溶剂的筛选
由于目前尚未有离子液体用于分离THF-乙醇-水三元混合物的报道,本文以三种溶质中价值相对较高的THF 和乙醇为关键组分,选用Cao 等[19]用来分离THF-乙醇二元共沸物的三种离子液体[BMIM] [BF4]、[OMIM] [BF4]和[BMIM] [DCA]为研究对象,采用基于COSMO-RS 理论的COSMOThermX(Version C30-1701)软件在TZVP 水平下进行量子化学计算,得到离子液体在25℃时对溶质的选择性,并以作为萃取剂的性能指标,的计算公式如下

1.2 萃取精馏过程建立及模拟
1.2.1 离子液体数据库的建立 由于离子液体的种类繁多、结构复杂而不常见,Aspen Plus 的数据库中不包含它们的热力学性质如偏心因子、沸点和蒸气压等。本文用Valderrama 等[24]开发的基团贡献法的估算结果来描述[BMIM][DCA]的沸点、临界性质和偏心因子等热力学性质,用Antoine 的扩展方程Ridel 方程[25]来描述离子液体的蒸气压。Ridel 方程的表达式如下
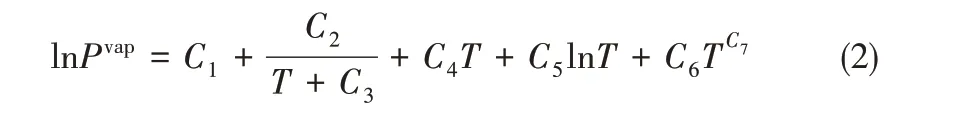
其中,T 为热力学温度,K;Pvap为温度T 下液体的饱和蒸汽压,Pa;C1~C7为Ridel 方程的参数,与物质种类有关。
1.2.2 热力学模型参数的回归 在过程模拟中,热力学模型及其参数是必不可少的。Renon 等[26]提出的热力学模型——NRTL 方程已经被广泛地应用于含有离子液体的汽液相平衡系统[27-29]。本文选用NRTL 方程来描述相关的气液相行为,其公式如式(3)~式(6)所示

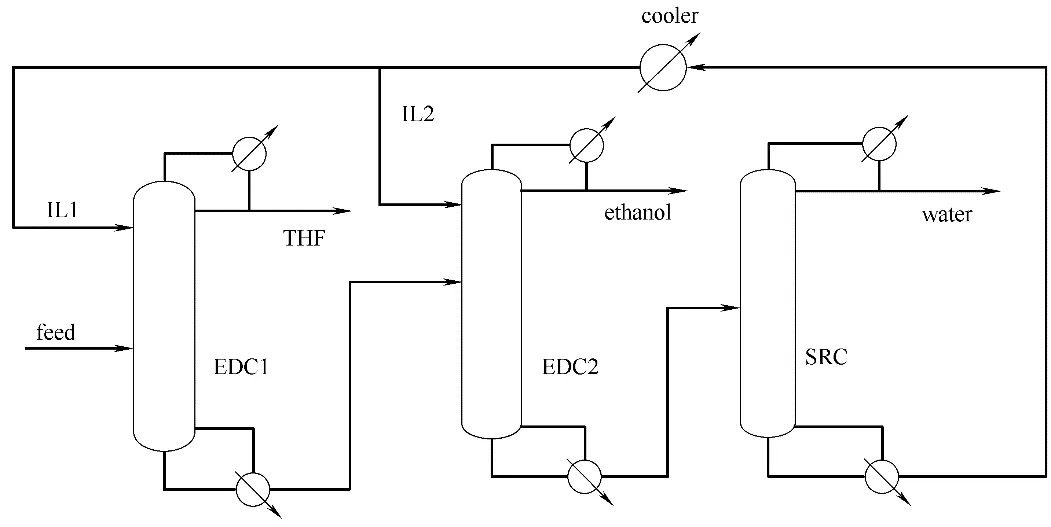
图1 萃取精馏工艺流程Fig.1 Extractive distillation process

式中,gij为组分i 和组分j 的二元能量交互作用参数;αij为非随机参数;R 为摩尔气体常数;T 为温度,K。
COSMOThermX 软件能够很好地预测二元或三元汽液相平衡数据,这些预测数据被一些研究者用于NRTL 方程的参数的回归,具有较高的准确性[30-32]。本文用COSMOThermX 软件预测水-离子液体的二元汽液相平衡数据,并使用NRTL 方程进行参数回归。
1.2.3 萃取精馏流程 萃取精馏工艺流程如图1所示。装置主要由萃取精馏塔1(EDC1)、萃取精馏塔2(EDC2)和溶剂回收塔(SRC)组成。含THF、乙醇和水的混合物与萃取剂在EDC1 内进行萃取精馏,EDC1 塔顶馏出THF,塔底馏出的乙醇、水和离子液体混合物进入EDC2。EDC2 塔顶产物为乙醇,塔底馏出的水和离子液体混合物进入溶剂回收塔SRC。SRC 塔顶产物为水,塔底产物为离子液体,其进入EDC1和EDC2循环使用。
2 结果与讨论
2.1 溶剂筛选结果
表1 中 给 出 了[BMIM][BF4]、[OMIM][BF4]和[BMIM][DCA]三种离子液体在THF(1)+乙醇(2)、THF(1)+水(2)和乙醇(1)+水(2)三个二元共沸体系中的值。从表1 中可以看到,离子液体[BMIM][DCA]在三个二元共沸体系中均具有最高的值,即具有最好的分离效果。所以本文选[BMIM][DCA]为萃取剂,对离子液体用于THF-乙醇-水三元共沸混合物的分离进行进一步的研究。

表1 离子液体用于三个二元共沸物系的筛选结果Table 1 Screening results of ionic liquids for three binary azeotrope systems
2.2 萃取精馏过程建立及模拟结果
2.2.1 IL的热力学性质及模型参数 表2为[BMIM][DCA]的热力学性质,均取自文献[24],表3 为通过AspenPlus 软件计算得到的[BMIM][DCA]的Ridel 方程参数。
由于离子液体用于四氢呋喃-乙醇-水三元共沸物系分离的首次应用,水-[BMIM][DCA]的NRTL模型参数缺失。因此利用COSMOThermX 软件预测了水-[BMIM][DCA]的二元汽液相平衡数据,其结果列于表4,并用NRTL 方程对得到的数据进行拟合,拟合结果列于表5。
表5给出了用于过程模拟的溶质-[BMIM][DCA]的NRTL 方程参数,除了前述通过相平衡数据预测得到的参数外,THF-[BMIM][DCA]和乙醇-[BMIM][DCA]的NRTL 方程参数来自于文献[19],THF-乙醇、THF-水、乙醇-水的NRTL 方程参数均取自Aspen数据库。

表2 [BMIM][DCA]的临界性质Table 2 Critical properties of[BMIM][DCA]
表3 [BMIM][DCA]的Ridel方程参数Table 3 Ridel equation parameters of[BMIM][DCA]

表4 基于COSMO-RS理论预测的等压水(1)+[BMIM][DCA](2)二元汽液平衡数据Table 4 Isobaric VLE data for water(1)+[BMIM][DCA](2)predicted based onCOSMO-RS theory
2.2.2 流程模拟结果 采用上述热力学性质参数和工艺流程图进行模拟计算。其中FEED、IL1 和IL2 采用常温常压进料,FEED 的进料流率为100 kmol/h,组成为30%的THF,30%的乙醇和40%的水,IL1 和IL2 都用[BMIM][DCA],进料流率分别为21.9 kmol/h 和51.1 kmol/h。以三种产物的质量分数不低于99.99%为目标,对全过程进行流程模拟。模拟过程中精馏塔的第一块理论板为冷凝器,最后一块理论板为再沸器,考虑到离子液体不易挥发的特性,为对其充分使用,离子液体的进料位置选为第二块理论板。模拟条件和结果如表6所示。
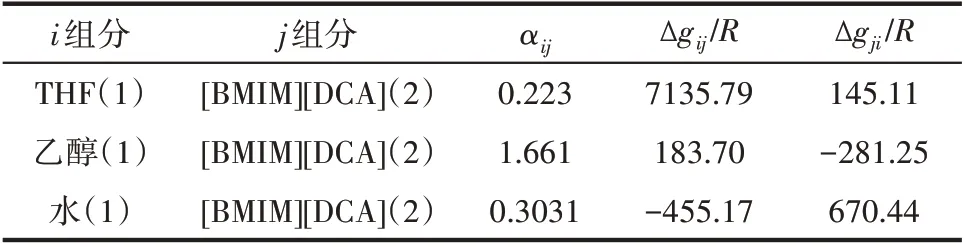
表5 溶质-[BMIM][DCA]的NRTL方程参数Table 5 NRTL equation parameters of solute-[BMIM][DCA]

表6 流程模拟的条件和结果Table 6 Conditions and results of process simulation
从表4中可以看出,以[BMIM][DCA]作为萃取剂完全可以满足THF-乙醇-水的分离要求,并且产品也达到了较高的品质,THF、乙醇和水的质量分数均接近100%。流程中EDC1,EDC2 和SRC 的温度和组成分布图如图2~图4所示。
2.2.3 机理分析 离子液体对于THF-乙醇-水的作用机理,可以通过它们的σ-谱图来解释[33-36]。σ-谱图按成键情况可化分为三个区域:氢键供体区域(σ<-0.82 e/nm2)、氢键受体区域(σ>0.82 e/nm2)和非极性区域(-0.82 e/nm2<σ<0.82 e/nm2)。在非极性区域外,谱图中的峰在y 轴上的值越大,离x 轴上的零点越远,意味着其拥有更强的极性。图5 显示了THF、水、乙醇、离子液体的阳离子[BMIM]+和阴离子[DCA]-的σ-谱图。

图2 EDC1的温度和成分分布Fig.2 Temperature and composition profiles of EDC1

图3 EDC2的温度和成分分布Fig.3 Temperature and composition profiles of EDC2
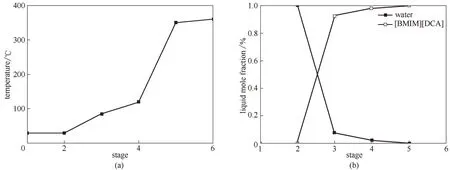
图4 SRC的温度和成分分布Fig.4 Temperature and composition profiles of SRC
从图5 中可以看出,THF 是氢键受体,乙醇、水和离子液体[BMIM][DCA]既可以作为氢键受体也可以作为氢键供体形成氢键,并且[BMIM][DCA]的供氢或受氢能力要远远高于其余三者,因此[BMIM][DCA]与THF-乙醇-水三元体系中组分形成的氢键比三组分之间形成的氢键更强。将离子液体加入THF-乙醇-水三元混合物中时,原有的氢键能够被打破,当离子液体的量达到一定值时,原有的共沸能够被打破。三元体系中的三种组分相比,氢键受体区的峰接近。THF 在氢键给体区没有峰,因此其与离子液体的结合力在三组分中是最弱的,在加热下首先作为轻组分在EDC1 塔中被分离出去。乙醇在氢键给体区的峰明显低于水,因此其与离子液体的结合力弱于水,在EDC2塔中作为轻组分被分离。

图5 THF、乙醇、水、[BMIM]+、[DCA]-的σ-谱图Fig.5 σ-Profiles for THF,ethanol,H2O,[BMIM]+and[DCA]-
3 结 论
以[BMIM][DCA]为萃取剂,进行了离子液体用于THF-乙醇-水萃取精馏的过程模拟和机理分析,结论如下。
(1)采用离子液体[BMIM][DCA]作为萃取剂,利用萃取精馏进行THF-乙醇-水的有效分离,能够得到纯度接近1的THF、乙醇和水,满足THF-乙醇-水三元共沸物系的分离要求。验证了使用一种离子液体进行三元共沸物系分离的可行性。
(2)通过对离子液体[BMIM][DCA]和三种溶质的σ-谱图分析,深入了解了萃取剂-溶质之间的相互作用,验证了整个萃取精馏过程在理论条件下的可行性,并在一定程度上对流程模拟过程的分离结果进行了解释。
符 号 说 明
p(σ)——表面电荷密度分布函数
R——气体常数,J/(mol·K)
S——选择性系数
T——体系温度,K
Tb——沸点,K
γ——活度系数
σ——屏蔽电荷密度,e/nm2
上角标
∞——无限稀释
下角标
c——临界状态
i——组分i
j——组分j
——以高中化学“氢键”的教学为例

