采用响应面法降低湿法氧化脱硫中Na2S2O3生成量
程华农,邱娜娜,岳金彩,郑世清
(青岛科技大学计算机与化工研究所,山东青岛266042)
引 言
湿法氧化脱硫技术是一种气体脱除硫化氢方法,硫化氢被碱性脱硫液吸收,变成硫氢根离子(HS-),然后在催化剂(蒽醌二磺酸钠(ADA)、萘醌、络合铁、栲胶或酞菁钴磺酸钠(PDS))作用下,被空气氧化成单质硫,同时碱性脱硫液得到再生。该法因工艺简单、脱硫精度高、操作范围广,广泛应用于城市煤气、合成气和天然气脱硫中[1-2]。生产上该过程常伴随着副反应的发生,生成大量的副盐,如硫代硫酸钠、硫酸钠、碳酸钠、碳酸氢钠等,其中Na2S2O3的含量最多,约为后几种盐含量之和[3-4]。当副盐含量超出一定值时,影响脱硫效果,需要外排脱硫液。目前大多是采用末端处理的方式[5-8],如回兑拌煤燃烧、提盐回收等。采用这些方法需要增加设备投资,同时人员操作环境差,还会产生二次污染等问题。因此对氧化再生过程中Na2S2O3生成的影响因素进行研究,帮助企业从源头上减少副盐生成,实现绿色生产具有重要意义。
Niu 等[9]通过热力学研究的方法对栲胶工艺中可能发生的含硫副反应进行了研究,指出HS-和多硫离子(Sx2-)是生成Na2S2O3的来源,温度越高,Sx2-越有利于转化成Na2S2O3。Kleinjan 等[10]研究发现即使在氧气的浓度较低或无催化剂的条件下,Sx2-氧化生成S2O32-的速度也比HS-要快得多,提出S2O32-盐主要来源于Sx2-的氧化。孟晓琴[11]对Na2S 溶液的空气氧化过程进行了实验,发现pH 和温度越高Na2S2O3生成量越大。王建宏等[12]指出H2S 在酸性溶液中氧化,只生成硫磺,不会生成硫氧化物,包括Na2S2O3。Steudel 等[13]和van den Bosch 等[14]研究了生物法脱硫体系中pH 对Na2S2O3的影响。结果表明存在单质硫的条件下,S2O32-的形成主要取决于游离的HS-和Sx2-之间的平衡,而这个平衡可以通过pH来控制。在pH 8.6 时,总溶解硫化物的21%以Sx2-存在,S2O32-盐选择性为3.9%~5.5%;在pH 10 时,占总溶解硫化物的87%,体系中20%~22%的负二价硫转化成S2O32-。Zhang 等[15]指出控制氧气和硫化氢比例,使反应器中溶解氧小于0.2 mg/L 时,硫化氢的去除率可以达到94%,81%硫化氢转化为单质硫,其他产物为Na2SO4和Na2S2O3。综上所述,Na2S2O3的生成受到pH、温度、催化剂、氧硫比等多个因素的影响,因此需要进行系统的实验研究。
Plackett-Burman(PB)实验是一种高效的因子筛选方法,能从众多的因素中快速筛选出对实验结果影响最为显著的因素,降低后续实验的工作量。响应曲面法是一种多因素的实验设计优化方法,与正交实验法相比,其优势在于可以得到直观的彩色图形,并拟合出连续的函数关系式。采用响应曲面法所得到的目标函数值更高,优化的工艺条件更加准确可靠[16-17]。
本研究以PDS 氧化再生过程为研究对象,对每个影响因素选取实际生产上的操作范围值。首先通过PB 实验筛选影响Na2S2O3产生的关键因素,然后以Na2S2O3含量为目标函数,进行三因素三水平的响应曲面实验。对实验结果进行方差分析,找出预测的响应最优值以及对应的实验条件,并进行机理解释。最后结合实际生产过程,对目前工厂的工艺操作进行分析,以期提出改进意见。
1 实验材料和方法
1.1 材料
本实验所选实验药品见表1。

表1 实验药品Table 1 Experimental agents
1.2 仪器与设备
高压反应器,Ecoclave 075,Buchi AG Company;温控器,Tango Nuevo,德国Huber;pH 计,3-Star 310P-03,Thermo Scientific Orion;电光分析天平,TG328-A,上海天平仪器厂;离子色谱,883 型,色谱条件:淋洗液3.2 mmol/L Na2CO3-1.0 mmol/L NaHCO3,流 速0.7 ml/min,定 量 环10 μl,柱 温 箱25℃,工 作 压 力12.43 MPa,色 谱 柱Metrosep A Supp5-250/4.0,抑制器6.2832.000 MSM-A Rotor,瑞士万通中国有限公司。
1.3 氧化再生反应装置与操作

图1 实验装置图Fig.1 Diagram of experimental device
实验装置如图1 所示,氧化再生反应采用釜式搅拌反应器,油浴进行准确控温,反应前后采用氮气吹扫,氧化所需的氧气来自空气钢瓶,废气通过尾气吸收装置后排放,整个系统的压力通过数字压力表监测,并传输信号到计算机端进行记录。实验前配制一定浓度的PDS 溶液,鼓空气2 h活化。按照每组实验的设计方案,向反应釜内加入相应浓度的Na2S 固体、PDS 溶液、单质硫粉末、一定比例的Na2CO3和NaHCO3及600 ml 除氧水。氮气吹扫三次赶走釜内气相空间残存的空气,开启搅拌为最低转速。因单质硫和多硫化钠的平衡时间较长[18],需要先升温至80℃并保温2.5 h 使多硫化钠达到平衡,之后降低至指定温度。温度稳定后,按照氧硫比通入相应的气量,调节搅拌至最佳转速,并同时按下计算机端的压力记录键,当压力5 min 内不再变化时,停止反应,泄压,氮气吹扫并取满瓶样分析。
1.4 实验方法
1.4.1 绘制Na2S2O3标准曲线 在使用离子色谱进行样品分析前,首先对Na2S2O3进行定性和定量分析。配制一系列已知浓度的标样,用标样的保留时间定出被测组分的位置,绘制峰面积与浓度的标准曲线如图2 所示,经拟合标准曲线为式(1),决定系数R2为0.9997。
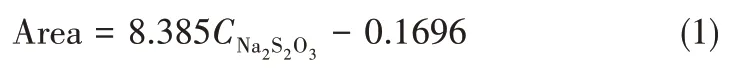

图2 不同浓度Na2S2O3溶液标准曲线Fig.2 Standard curve of different concentrations of Na2S2O3 solution
1.4.2 Plackett-Burman 实验 影响Na2S2O3生成的工艺条件有氧硫比、温度、pH、催化剂浓度和单质硫浓度。以Na2S2O3含量为响应值进行显著性因子的筛选,对每个因子按照生产上的操作范围取高低两水平,以(-1,1)进行编码。设置四个空项以估计实验误差,构成9 因素12 次实验的设计。表2 即为PB实验各因子高低水平的选取和空项设计。在设置空项时均采用等间距设计。

表2 Plackett-Burman实验设计因子与水平Table 2 Factors and levels of Plackett-Burman experimental design
1.4.3 Box-Behnken 响应面分析法 采用Box-Behnken Design(BBD)建立响应曲面模型,以优化Na2S2O3生成量最少的条件。根据PB 实验结果,结合每个因子效应大小和实验中的实际情况,以三个显著因子为自变量,以-1、0、1 三水平分别代表自变量的低、中、高,表3 即为BBD 设计的因素与水平编码。非显著性因素根据PB 实验的结果取1或-1 水平。利用Minitab 18 软件进行实验设计和结果分析,实验总共17 组,5 组中心实验,12 组归因实验。

表3 Box-Behnken设计的因素水平编码Table 3 Box-Behnken design factor level coding
2 结果与讨论
2.1 搅拌速率
在化学反应实验中,搅拌速率可能会影响反应时间及体系的气液传质效果,因此需要确定一个合适的搅拌速率。在Na2S 浓度10 mmol/L,温度35℃,pH 8.86,PDS 浓度60 mg/L 的条件下,分别调整转速为800、1000、1200、1400 r/min 进行反应。反应釜压力的变化如图3 所示,压力曲线的斜率表征不同转速下反应速率的大小。
从图3 可以看出,当搅拌速率大于1000 r/min时,反应速率基本保持不变,说明此时搅拌速度不再影响反应速度,为了保证反应的稳行性,后续选取1200 r/min作为固定的搅拌速度。
2.2 Plackett-Burman实验结果分析
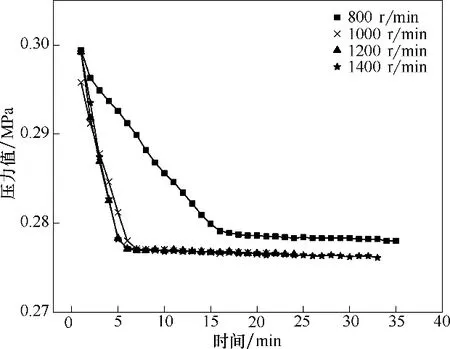
图3 不同转速下脱硫液反应速率的变化Fig.3 Change of reaction rate of desulfurization solution at different rotation speeds

表4 Plackett-Burman实验设计及结果Table 4 Design and results of Plackett-Burman experimental

表5 Plackett-Burman实验各因子显著性顺序Table 5 Significant order of each factor of Plackett-Burman experiment
以Na2S2O3含量为响应值的PB 实验设计结果见表4,其各因素的效应及显著性顺序如表5所示。从表5 中p 值大小可以看出,pH 和单质硫浓度这两个因子对Na2S2O3含量的影响大于95%,统计学意义上显著。温度的p 值为0.059,接近0.05,处于边缘状态,对目标函数的影响大于90%,因此确定以上三个因素为下一步实验的关键因素。非显著性因素均表现为负效应,因此分别取其高水平值,即PDS浓度为90 mg/L,氧硫比为1.2 mmol/mmol。
2.3 Box-Behnken 实验结果分析
三个显著因子的最适浓度范围确定后,以pH 8.7,单质硫浓度0.6 g/L,温度37.5℃为中心点实施响应面分析,各因素水平的具体设计及结果见表6。结合Minitab 18软件对表6的数据进行线性拟合,得到基于未编码因子的多元二次回归方程[式(2)],该模型的决定系数R2为97.83%,表明实际值与预测值拟合良好,校正决定系数Radj2为95.04%,表明该模型能够解释95.04%的响应值变化,只有4.96%的变异不能用该方程解释。

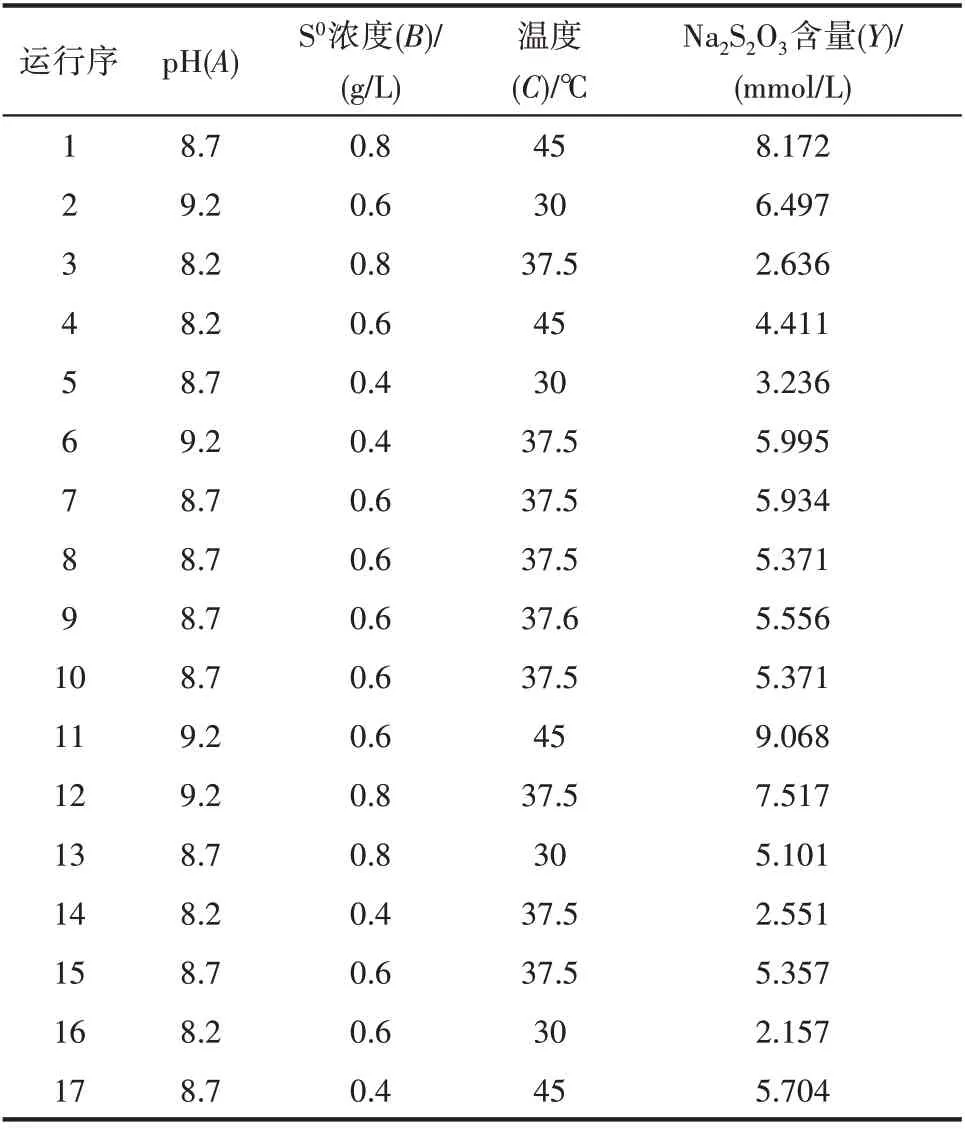
表6 Box-Behnken实验设计及结果Table 6 Design and response of Box-Behnken experiment
从表7 方差分析可知,该模型是极显著的(p<0.0001),失拟项p 值大于0.05,失拟不显著,表明实验操作可靠。模型的一次项影响显著,其次是平方项,而交互项对模型的影响最弱。
对响应曲面实验得到的结果进行优化,找出Na2S2O3生成最低的条件。结果表明当pH=8.21,单质硫浓度0.41 g/L,温度30.81℃的条件下,Na2S2O3含量最低为1.647 mmol/L。图4~图6 表示在最优条件下,固定某一因素,另外两种因素对响应值的影响。从图中可以看出,pH越大,单质硫浓度越高,温度越高,Na2S2O3含量越高。不同pH 下Na2S2O3含量变化最大,其次是单质硫浓度,温度的影响最小。观察底面等值线及结合方差分析表可以得出,双因子交互作用由强到弱依次是AB>BC>AC,但整体上双因子交互作用并不强,因此可以依次剔除交互项,将已得到的数学模型进行改进[式(3)]。
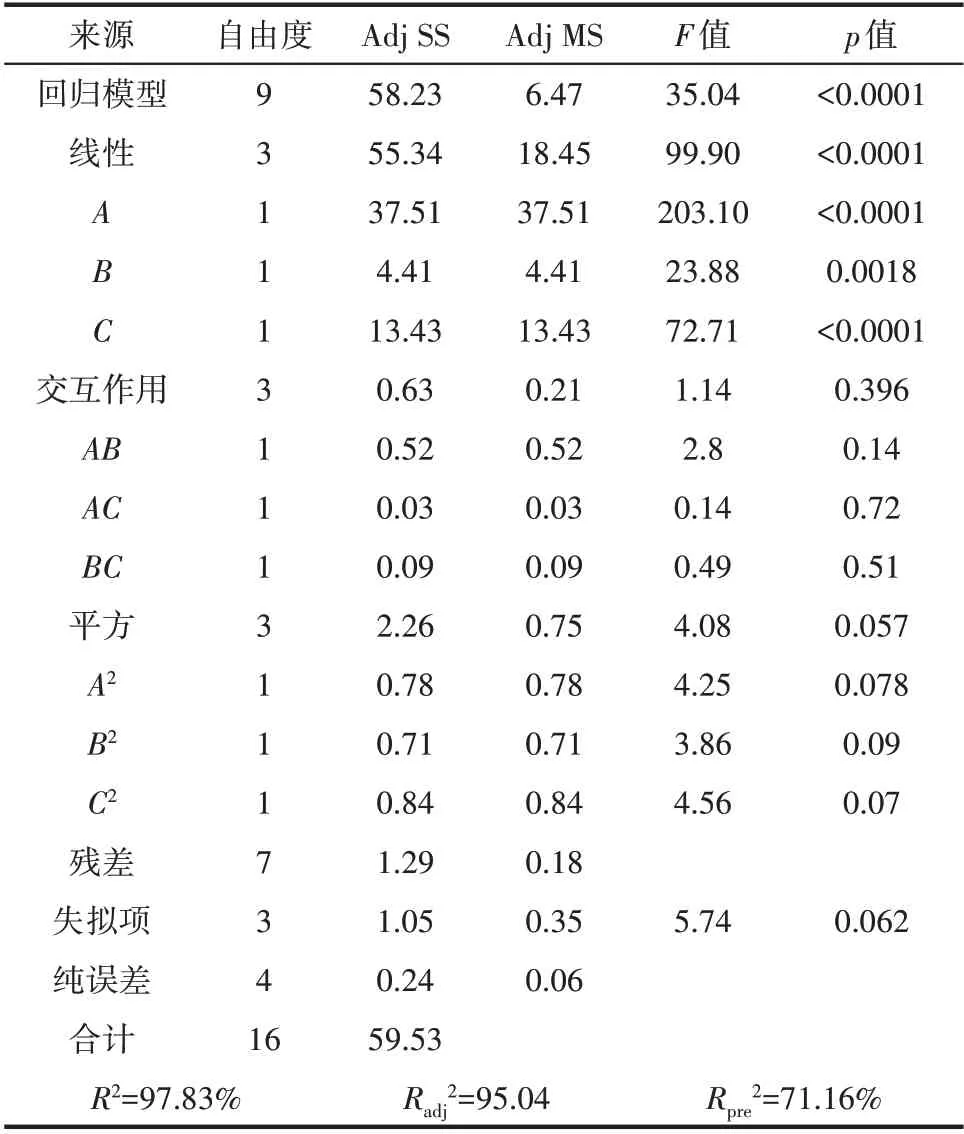
表7 Box-Behnken实验结果方差分析Table 7 Variance analysis of Box-Behnken experiment results
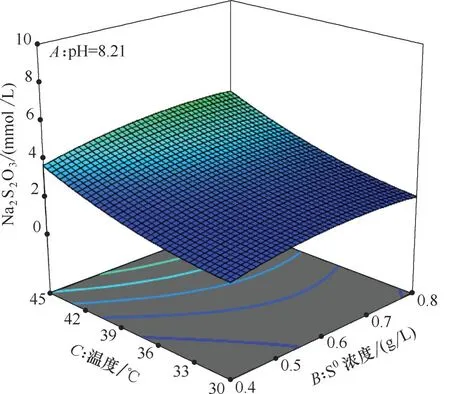
图4 温度-单质硫浓度的响应面(pH=8.21)Fig.4 Response surface of temperature and S0(pH=8.21)

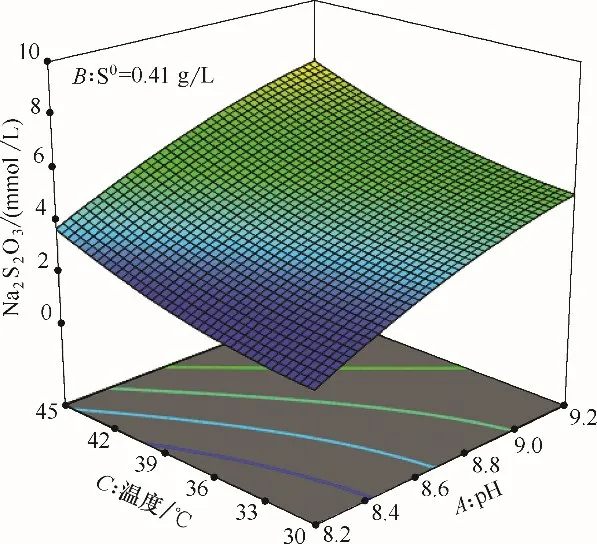
图5 温度-pH的响应面(单质硫浓度0.41 g/L)Fig.5 Response surface of temperature and pH(S0=0.41 g/L)
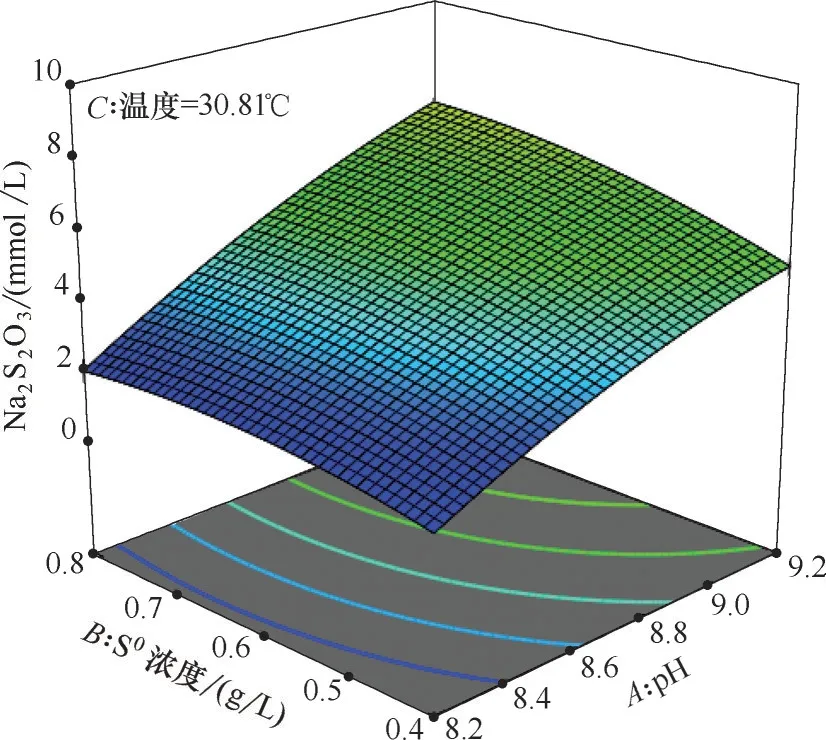
图6 单质硫浓度-pH的响应面(温度30.81℃)Fig.6 Response surface of S0and pH(T=30.81℃)
此回归方程的R2=96.77%,Radj2=94.83%,与之前回归方程相比差别不大,但Rpre2提高到88.06%,说明简化后的回归方程对未来数据的预测能力要大大优于简化前的方程模型。利用此模型进行优化,得到的最优条件为:pH 8.25,单质硫浓度0.47 g/L,温度31.80℃,氧硫比1.2 mmol/mmol,PDS 浓度90 mg/L,此时Na2S2O3含量为1.838 mmol/L。
2.4 机理分析
在脱硫液氧化再生过程中,脱硫液中HS-与氧气反应,除了生成单质硫外,还生成S2O32-盐,方程式如下

生成的单质硫也会与HS-反应生成Sx2-,这是个可逆平衡反应
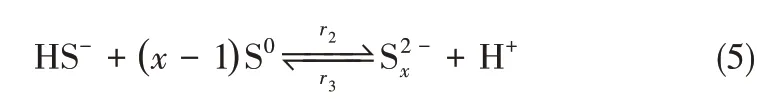
接着Sx2-被氧气氧化生成S2O32-

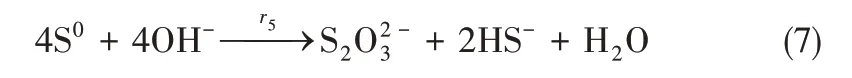
虽然通过吉布斯计算表明[18],上述三个反应[式(5)~式(7)]在25~55℃范围内均可自发进行,但是式(7)在常温下反应速度很慢,要在强碱(20℃,pH>12)或高温(pH 7.6,80℃)条件下才显著反应[19],因此,正常的氧化再生操作条件(30~40℃,pH 8~10)下,反应式(7)可以忽略。

对于HS-和Sx2-的反应速率方程可以通过以下经验方程表示
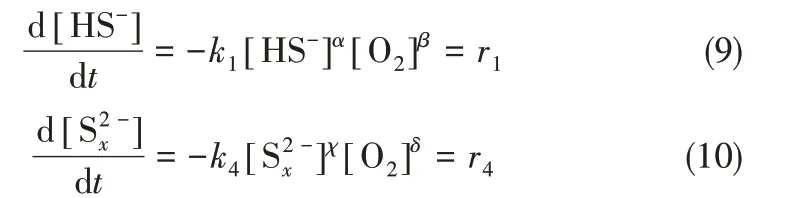
Fischer 等[20]指出,式(10)的反应速率r4即使在无催化剂条件(25℃,pH 9)下,也比HS-的反应速率r1高出两个数量级。根据O’Brien 等[21]所提出的硫化物氧化过程的反应动力学模型[式(9)],结合表8列举的不同环境下硫化物氧化动力学参数可以看出,在单位HS-和浓度下的反应速率常数是HS-的2~10 倍。此外Sx2-因其未满八电子的稳定结构,性质较HS-活泼[22],因此在硫代副盐生成过程中起到主要作用。
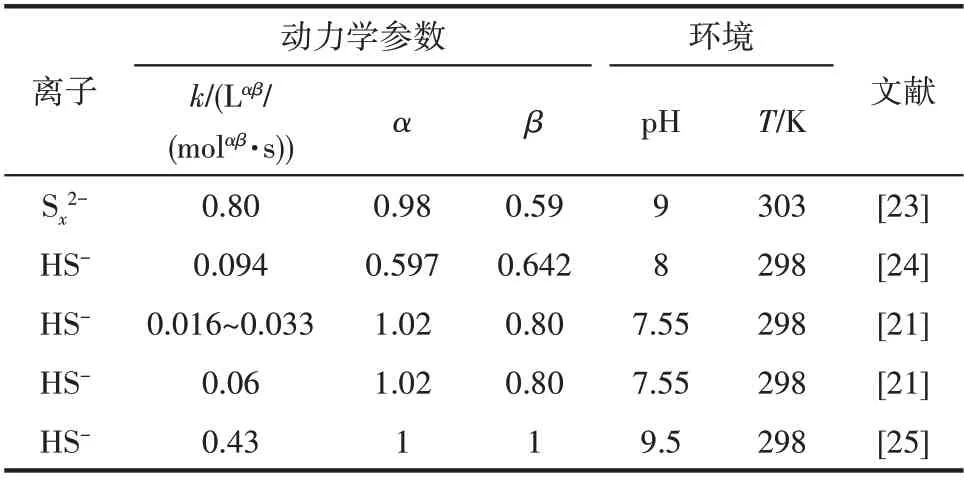
表8 不同环境下硫化物氧化动力学参数Table 8 Kinetic parameters of sulfide oxidation in different environments
pH 变化对硫代硫酸盐的影响主要体现在HS-和之间的平衡[式(5)],pH 变大,平衡右移的比重增加,导致溶液中存在大量,因此多硫离子占总负二价硫离子的比重增加,进而导致硫代副盐生成速度加快。
温度对多硫离子的平衡反应也会带来影响,其平衡常数表达式[26]如式(11)所示,表9 列举了不同文献中在不同温度下所测得的平衡常数。由表9可以看出,该反应为放热反应,温度降低,pKx数值变小,平衡常数Kx增大,反应正向移动,即向生成多硫离子的方向移动,进而导致硫代副盐含量增多。

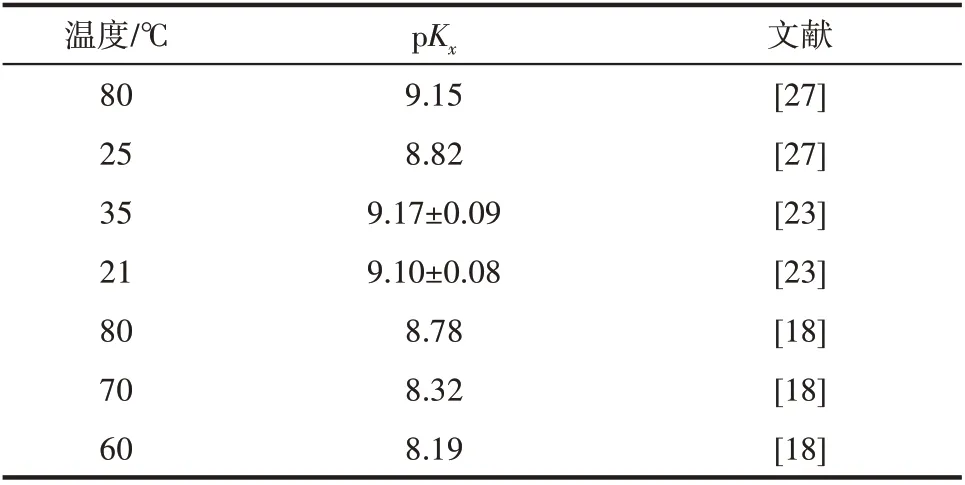
表9 不同温度下式(11)的反应平衡常数Table 9 Reaction equilibrium constant of Eq.(11)at different temperatures
2.5 实际生产过程分析与改造
某企业湿法氧化脱硫生产工艺如图7所示。原料气在吸收塔中与脱硫液逆向接触,吸收了H2S 的脱硫液进入富液槽,经泵输送到喷射器,与吸入的空气混合后,从喷射器尾部出口进入再生槽,在再生槽内完成氧化再生过程。生成的单质硫泡沫从上部溢流进熔硫釜,再生后的脱硫液经液位调节器进入贫液槽,经泵返回吸收塔循环使用。在熔硫釜中的硫泡沫经高温转化成硫磺进入成品罐。
表10为再生槽的操作参数,其氧硫比是通过测定再生槽各个喷射器入口风速,计算出喷射器吸入的空气量,然后根据水煤气原料中H2S浓度和气量,得到硫化氢的量,最后将空气量与硫化氢含量两者相比,计算得出氧硫比。
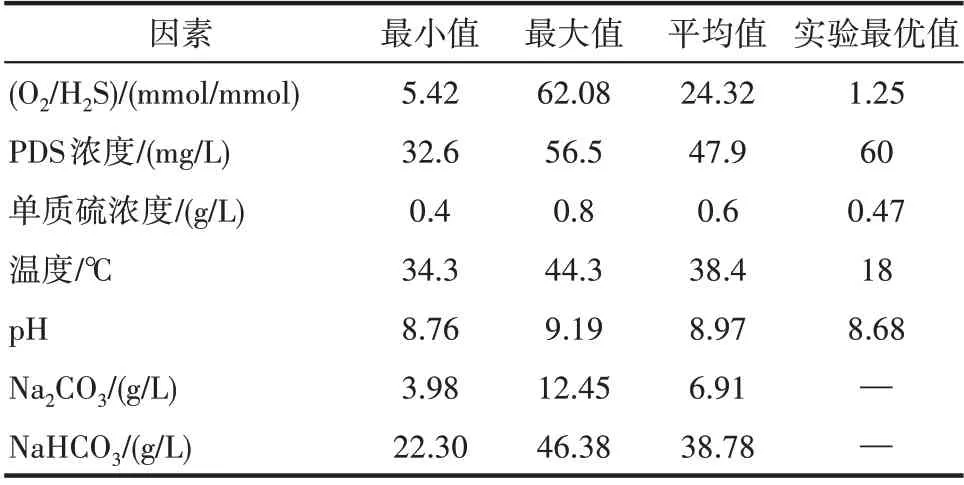
表10 再生槽操作参数Table 10 Operating parameters of regeneration tank
实际生产上再生槽的风量根据硫泡沫浮选的吹气强度确定[28],由于水煤气中H2S 含量是波动的,导致氧硫比是一个波动值,范围为5.42~62.08,平均值为24.32。考虑到再生槽和反应釜气液混合效果存在很大不同,而且实验中已经把气液混合影响降至最低,真实氧硫比可能不会这么大。
在pH、温度和单质硫浓度这三个关键因素中,除了pH 和最优条件相差较大外,其他参数均为现有操作参数的下限值。图8 表示25℃下Na2CO3-NaHCO3缓冲液组成和pH 的关系[29],从图中可以看出在生产操作的pH 范围内(8.76~9.19),碳酸氢钠浓度在20 g/L 以上,其浓度变化对pH 影响较小,有利于生产的稳定。响应面实验的最优结果只考虑了氧化再生过程的最优化,没有兼顾吸收过程的稳定性。从图8可以看出,若pH=8.2,Na2CO3浓度非常低,无法保证吸收效果。因此结合实际生产过程,pH取8.8~9比较合适。

图7 湿法氧化脱硫生产工艺简图Fig.7 Flow diagram of wet oxidation desulfurization process

图8 Na2CO3和NaHCO3对Na2CO3-NaHCO3缓冲液pH的影响Fig.8 Effect of Na2CO3 and NaHCO3 on buffer pH of Na2CO3-NaHCO3
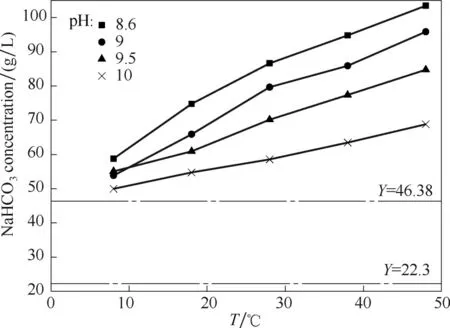
图9 实际脱硫液组成中不同温度和pH下NaHCO3的饱和溶解度Fig.9 Saturated solubility of NaHCO3 at different temperatures and pH in actual desulfurization composition
再生槽的温度在34.3~44.3℃之间,平均值为38.4℃,高出最优值。但在生产中降低操作温度还要考虑其他因素的影响。生产中脱硫液各个无机盐含量为Na2S2O346.38 g/L,Na2SO33.23 g/L,Na2SO43.37 g/L,Na2CO36.91 g/L,NaHCO338.82 g/L。由图9可以看出NaHCO3含量离饱和点最近(40℃下纯水127 g/L),而且在有其他副盐存在的条件下,NaHCO3饱和溶解度大大下降,如50 g/L Na2S2O3存在时,NaHCO3饱和溶解度只有80 g/L[30],因此碳酸氢钠最容易首先达到饱和析出,特别在气温较低时容易堵塞设备。为了避免出现这种问题,在生产装置的富液槽和贫液槽中增加了蒸汽盘管,导致脱硫液温度高出实验最优值。因此温度保持在30℃以上较好。
从整个脱硫工序来看,为降低副盐生成应保持较低的温度,但目前生产上单质硫分离采用熔硫釜,通过蒸汽将硫泡沫加热到120℃成为易于流动的熔融状态的硫。在此高温下,既加速了HS-和Sx2-生成S2O32-的氧化反应,又引发了单质硫的歧化反应,从而加剧了副盐的生成[14]。此外,从熔硫釜上层出来的残液温度高、单质硫浓度较高,返回系统循环使用不利于抑制硫代副盐的生成,因此可以采用替代的单质硫分离设备,如戈尔过滤器[31]、板框式压滤机[32]、离心机或改为内分式熔硫[33]等,不但单质硫脱除效率高,而且避免了脱硫液在高温下操作的弊端。
依据研究成果,主要在pH、单质硫浓度和温度三个方面对实际工艺进行改进。改进后的温度控制在37.5~41.5℃之间,pH 范围在8.55~8.9 之间,均比以前(表10)数据要低,而且更加稳定。采用戈尔过滤器替代原有的熔硫釜,提高了单质硫分离效率,还不会引起脱硫液温度的升高,单质硫浓度降至0.07~0.19 g/L之间。Na2S2O3浓度的增量由原来的每天增加1.88 g/L降低到每天1.2 g/L,大大减少了脱硫液的外排次数和数量。
3 结 论
(1)通过Plackett-Burman 实验,确定pH、单质硫浓度和温度这三个因素为影响Na2S2O3含量的关键因素。
(2)通过响应曲面实验,得出对Na2S2O3生成量贡献最大的项是pH,其次是温度和单质硫浓度,而交互项对模型的影响最弱。对实验结果进行数据回归,得到的回归方程R2=97.83%,表明实际值与该模型的预测值存在较好的拟合度。将不显著的交互项依次剔除,并进行优化得pH 8.25,单质硫浓度0.47 g/L,温度31.80℃,PDS 浓度90 mg/L,氧硫比1.2 mmol/mmol,此时Na2S2O3含量最低为1.838 mmol/L。
(3)考虑实际生产过程,pH 过小影响H2S 的吸收效果,操作不稳定,需要将pH 维持在8.8~9 的合理范围。单质硫浓度越低越好,采用新型的单质硫分离装置可以进一步降低脱硫液中单质硫浓度,而且避免了脱硫液在高温下加剧硫代副盐生成的问题。将本研究成果应用于实际生产过程改造中,取得了明显的效果,大大降低了脱硫废液的排放量。
符 号 说 明
CNa2S2O3——Na2S2O3浓度,mmol/L
Kx——多硫化物的平衡常数,mol/L
pKx——平衡常数Kx的负对数
k——反应速率常数,Lαβ/(molαβ·s)
R2——决定系数
Radj2——校正决定系数
Rpre2——预测决定系数
ri——i的反应速率表达式
[Sx2-]——多硫离子的浓度,mol/L
T——温度,K或℃
α——式(4)中HS-离子的反应级数
β——式(4)中O2的反应级数
γi——组分i的活度系数
δ——式(6)中O2的反应级数
χ——式(6)中Sx2-离子的反应级数
下角标
x——多硫化物链长

