酵母菌的致孔作用对PVA/CMC水凝胶性能的影响
万豫,张敏,翁云宣,李成涛
(1 陕西科技大学环境科学与工程学院,陕西西安710021; 2 北京工商大学塑料卫生与安全质量评价技术北京市重点实验室,北京100048)
引 言
水凝胶是一类由合成高分子材料或者天然高分子材料制得的具有三维网络结构的聚合物[1-3];由于含有羟基、氨基、羧基和酰胺基等功能基团,所以具有高保水性、溶胀性和对重金属离子、蛋白质、染料等有较强结合能力的优点,被广泛应用于废水处理、药物缓释等各个方面[4-7]。常用的水凝胶虽能较好地去除废水中的污染物,但存在废弃后较难降解的缺点,会对环境造成二次污染。
染料废水的处理一直是废水治理中的难题之一,目前对于染料的降解主要有光催化法[8]、氧化法[9]、生物法[10]等。相比于光催化法和氧化法,生物法因成本低、处理彻底且不产生二次污染、对环境友好而被广泛使用,其主要是利用微生物产生的降解性酶(如过氧化物酶和漆酶)对污染物进行氧化[11-12],实现对污染物的降解。国内外研究人员已发现细菌、真菌、酵母菌、藻类及某些植物在特定条件下可以降解或矿化各种染料并使其脱色[13-14]。其中酵母菌因其成本低、安全易得等特点,常被作为生物吸附剂[15]。同时有研究表明,酵母菌在新陈代谢过程中产生的氧化酶和脂肪酶可降解一些难降解高分子物质,如聚乙烯醇、聚乙二醇等[16]。
本研究以酵母菌为发泡剂,聚乙烯醇(PVA)、羧甲基纤维素(CMC)为原料制备得到了多孔水凝胶DPC。一方面利用酵母菌的致孔作用增加PVA/CMC水凝胶的比表面积,提高水凝胶对亚甲基蓝(MB)的吸附性能;另一方面利用酵母菌产生的酶降解MB,且又能在废弃后产生降解酶作用于材料,使其进行生物降解。这种生物发泡法相比于化学发泡法不会引入有毒有害的物质而造成二次污染[17],且使水凝胶具有多功能性,既降解污染物又可提高材料的生物降解性,从根本上解决对环境的污染,为深度处理染料废水提供了新思路。
1 实验部分
1.1 主要材料
PVA(聚合度2000,醇解度99%),国药集团化学试剂有限公司;CMC(平均分子量110000~120000,乙酰化程度>90.0%),成都市科龙化工试剂厂;高活性干酵母,安琪酵母股份有限公司;葡萄糖,天津市天力化学试剂有限公司;MB,天津天力化学试剂有限公司;磷酸氢二钾(K2HPO4),天津市化学试剂厂;磷酸二氢钾(KH2PO4),天津市化学试剂厂;纤维素酶,江苏省奥谷生物科技有限公司;硼酸,天津天力化学试剂有限公司;碘化钾(KI),天津市辰化学试剂厂;碘(I2),沈阳试剂厂。所用试剂均为分析纯。
1.2 D-PC水凝胶的制备
通过循环冷冻-解冻法制备D-PC 水凝胶。称取1 g PVA 溶于10 ml 蒸馏水,于90℃下搅拌2 h 制得质量分数为10%的PVA 溶液。然后加入0.6 g 的CMC 粉末,于60℃下搅拌1 h 制得分散均匀的PVA/CMC 共混液。用0.1 mol/L 的盐酸将共混液pH 调节至3.5。加入质量比为1.0∶1、1.2∶1、1.4∶1 的酵母菌/葡萄糖,30℃水浴下搅拌30 min 后倒入24 孔板,置于恒温水浴中发泡60 min 后放入低温冰箱快速定型,之后经冷冻-解冻循环3 次后用超纯水清洗,得到酵母菌发泡的水凝胶(D-PC)。将制备得到的水凝胶分别记为D-PC1.0、D-PC1.2、D-PC1.4,以未添加酵母菌/葡萄糖的PVA/CMC水凝胶(PC)为空白组。
1.3 结构表征及形貌观察
采用德国Bruker 公司的VECTOR-22FTIR 分析仪(扫描范围为4000~500 cm-1,扫描32 次)、美国FEI 公司的FEI-Q45 扫描电子显微镜SEM (冷冻后的水凝胶切成厚度为0.5 mm 的薄片,真空冷冻干燥后在25 kV 的测试电压下进行喷金处理,厚度为10 nm)、英国Malvern 公司的纳米粒度表面电位分析仪(用去离子水将发泡后的混合液配制成浓度为千分之一的悬浮液)分别对引入酵母菌前后水凝胶的化学结构进行表征、微观形貌进行观察、电位变化进行测定。
1.4 D-PC水凝胶性能的测定
1.4.1 D-PC 水凝胶对MB 的吸附性 考察了pH、温度、吸附时间和MB 初始浓度等因素对引入酵母菌后D-PC 水凝胶吸附MB 的影响。取30 ml一定浓度的MB溶液于100 ml锥形瓶中,加0.03 g D-PC,用0.1 mol/L HCl 和0.1 mol/L NaOH 调节pH,于恒温振荡器中振荡,离心过滤取上清液。紫外分光光度仪(UV-Vis)在640 nm 处测定上清液的吸光度,实验重复3次,取平均值计算上清液中剩余MB浓度。根据式(1)计算D-PC对MB的吸附率

式中,C0为MB 初始浓度,mg/L;Ce为吸附平衡后MB的浓度,mg/L;η为MB去除率,%。
1.4.2 D-PC 水凝胶的生物降解性 将D-PC1.4切成10 mm×30 mm×0.5 mm 的薄片,记重,放入50 ml 离心管中;用磷酸盐缓冲液配制浓度为0.003 g/ml 的纤维素降解酶溶液,移取12 ml 至离心管中,密封;将离心管置于45℃的摇床中(r=120 r/min),所有实验均一式三份进行,取均值。在预设的时间间隔(2 d、4 d、6 d、8 d、10 d)内取样,蒸馏水洗涤降解样数次并用真空冷冻干燥器干燥,至质量保持不变称取质量;将干燥的降解样品溶于160 ml 蒸馏水中,在90℃下搅拌1 h;取8ml 混合溶液于100 ml 容量瓶中,蒸馏水稀释至20 ml;然后加入10 ml 的4%硼酸溶液和2 ml KI/ I2溶液(2 g KI/1.27 g I2溶于100 ml蒸馏水),静置10 min。使用紫外可见分光光度仪在690 nm 处测定PVA 浓度[4,18]。根据式(2)计算D-PC1.4中PVA的降解率

式中,W1为降解前D-PC1.4中PVA 的浓度,mg/g;W2为降解后D-PC1.4中PVA 的浓度,mg/g;ηPVA为DPC1.4中PVA的降解率,%。
2 结果与讨论
2.1 酵母菌与水凝胶的相互作用
2.1.1 酵母菌对D-PC 水凝胶化学结构的影响 对引入酵母菌后D-PC1.4及其原料PVA、CMC、酵母菌的化学结构进行了表征,结果如图1 所示。图中3244、3490 cm-1为PVA、CMC 的—OH 吸 收 峰[19];1653、1547 和1240 cm-1分别为酵母菌的—NH,酰胺Ⅰ带(C O),酰胺Ⅱ带(N—H)和酰胺Ⅲ带(C—N)的特征峰[20]。由图1 可以看出,D-PC1.4中同样出现了—OH 的特征峰,相比于PVA、CMC,D-PC1.4的—OH吸收峰变宽并且发生偏移,表明PVA和CMC之间发生了氢键交联;此外,D-PC1.4在1653 cm-1和1240 cm-1处出现了酵母菌的酰胺Ⅰ带和Ⅲ带的吸收峰,表明合成了酵母菌致孔的水凝胶D-PC1.4。引入酵母菌后,酵母菌在3413 cm-1处氨基和羟基的叠加峰偏移至了3399 cm-1,表明酵母菌与D-PC1.4之间存在氢键作用;D-PC1.4在1547 cm-1处酵母菌酰胺Ⅱ带的特征峰几乎消失,且CMC在1589 cm-1处羧基特征峰的强度明显减弱,这表明酵母菌与水凝胶中CMC 羧基之间存在相互作用。
2.1.2 酵母菌对D-PC 水凝胶电位的影响 为进一步探究酵母菌与水凝胶之间的作用力,对D-PC1.4及其原料的Zeta 电位进行了测定,结果如图2 所示。从图中看出酵母菌在任何pH 下都显负电。PC 的零电荷(pHpzc)值为3.8,当溶液的pH 小于pHpzc时,水凝胶PC显正电;反之,水凝胶PC显负电。这是因为酸性条件下,CMC的—COOH被质子化(—COOH+)从而使PC 显正电,在碱性条件下发生氢离子电离(—COO-)使PC显负电[21-22]。PC中添加酵母后pHpzc′=2.4,结合FTIR 分析的结果可知,这是因为当溶液的pH 小于pHpzc时,带负电的酵母菌和CMC 中被质子化的—COOH+之间发生了静电作用,导致pHpzc(3.8)偏移至pHpzc′(2.4)。结果表明:酵母菌和PC 中CMC的羧基之间存在静电作用。
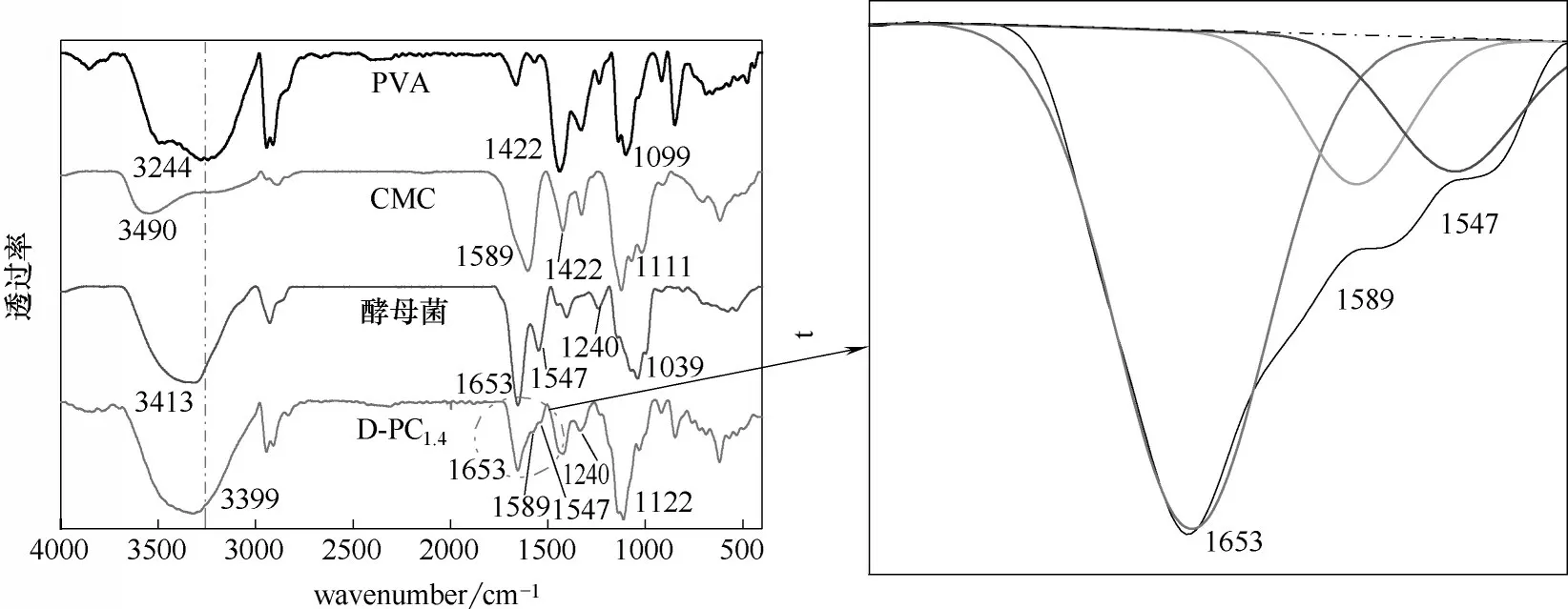
图1 D-PC1.4及其原料的FTIR光谱图Fig.1 FTIR spectrum of D-PC1.4 and its raw materials

图2 D-PC1.4、PC和酵母菌在不同pH下的Zeta电位Fig.2 Zeta potential of D-PC1.4,PC and yeast at different pH
2.2 酵母菌对D-PC水凝胶网络结构的影响
2.2.1 D-PC 水凝胶微观形貌的变化 为观察酵母菌对水凝胶微观结构的影响,采用SEM 对其进行了观察,结果如图3所示。从图中可以看出,不含酵母菌的PC表面粗糙、孔结构小。引入酵母后,D-PC表面光滑、孔径变大,且随着酵母菌量的增加,D-PC表面的网络结构越来越规整且孔洞结构越来越多。综合FTIR 和Zeta 电位的分析结果,酵母菌通过与CMC 中羧基的静电作用包覆在D-PC 中起到了物理交联点的作用,促进了材料网络结构的形成;引入酵母菌的量越多,其呼吸作用产生的气体也就越多,从而使材料孔洞结构增加。结果表明,酵母菌的引入有利于三维网络结构的形成。
2.2.2 D-PC 水凝胶比表面积的变化 酵母菌对水凝胶比表面积的影响结果如表1所示。从表中可以看出,引入酵母菌后D-PC 的比表面积和平均孔径均变大;且随着酵母菌量的增加,材料的比表面积越来越大、平均孔径越来越小,这与SEM 表征得到的结果一致。吸附剂的比表面积和平均孔径影响着材料对污染物的去除效果,比表面积越大、孔径越小,去除率越大,因此酵母菌的引入可提高水凝胶的吸附性能。

表1 D-PC和PC的BET参数Table 1 BET parameters of D-PC and PC
2.3 酵母菌对D-PC水凝胶性能的影响
2.3.1 D-PC 水凝胶对MB 吸附性的变化 图4(a)~(d)分别为不同pH、温度、MB初始浓度和吸附时间等条件下D-PC对MB去除率。由图4(a)可知,D-PC对MB 的吸附效率明显大于PC 和PVA,而且随着酵母菌量的增加而增加;随着pH 的增加PVA 水凝胶和PC 的吸附率增加,而D-PC 的吸附率先增加后达到平衡。由Zeta 电位可知D-PC 的等电位点pHpzc′=2.4,而MB 属于阳离子型染料,在pH>2.4时D-PC 显负电与MB 发生静电作用,从而有效去除MB。DPC 在pH=6 之前吸附速率较快之后吸附趋于平衡,pH=7 时吸附率达到最大。这是因为酵母菌的最适pH 为6~7,当pH>7 时,酵母菌活性有所影响,吸附率下降。
从图4(b)中可以看出,随吸附温度的升高,PVA水凝胶和PC 对MB 的吸附率先升高后保持稳定,分别在30℃和35℃时吸附率达到最大;D-PC 对MB 的吸附率先升高后降低,30℃时吸附率达到最大为75%。主要原因是:D-PC 内含有酵母菌,酵母菌的最适生长温度为28~30℃,温度小于或高于30℃时,其活性受到影响,使吸附率降低。
图4(c)中随着MB 浓度的增大,材料对MB 的吸附率都升高。初始浓度大于60 mg/L 时,吸附率开始降低,最终趋于平衡;初始浓度为60 mg/L 时,材料对MB的吸附率达到最大,其中D-PC1.4的最大,达到78%。结果表明:初始浓度的增加,有助于提高吸附率,且酵母菌添加量越多,吸附率越高。同样,图4(d)中D-PC1.4对MB 的吸附率较高,最大吸附率可达94%以上。从图中可以看出,随着吸附时间的增加,所有材料对MB 的吸附率都是先升高后趋于稳定,20 h后吸附达到平衡。
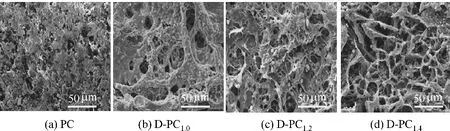
图3 D-PC和PC的SEM图片Fig.3 SEM images of D-PC and PC
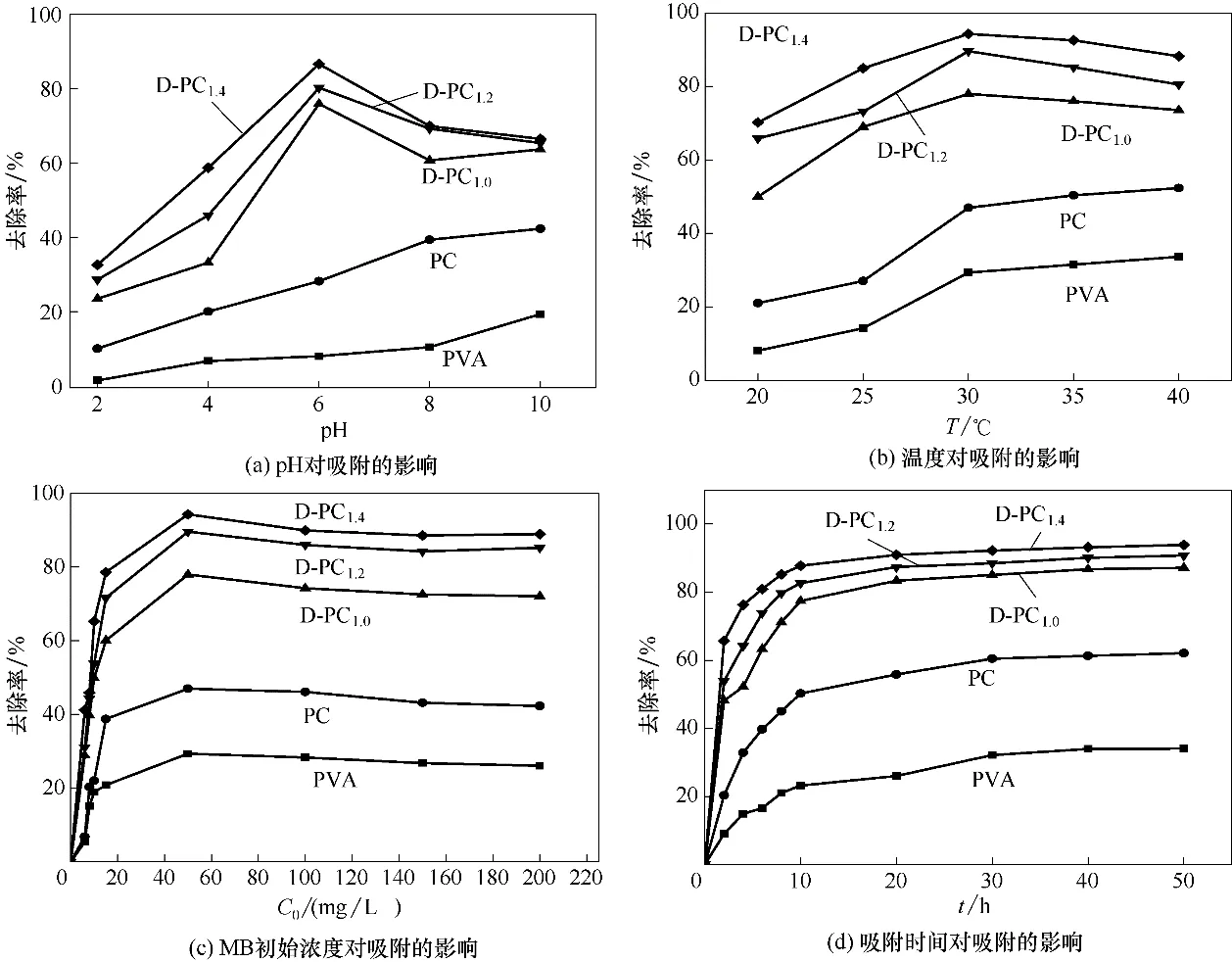
图4 酵母菌对D-PC水凝胶吸附MB的影响Fig.4 Effect of yeast on adsorption of MB by D-PC hydrogel
综上所述,酵母菌的制孔作用明显提高了水凝胶对MB 的吸附,且酵母菌的量越多对MB 的吸附性越好。
2.3.2 D-PC 水凝胶吸附MB 的机制 图5(a)为吸附不同时间后D-PC1.4和MB溶液的照片。从图中可以看出,随着吸附时间的增加,D-PC1.4的颜色逐渐变深,后变浅;MB 溶液的颜色逐渐变浅,在吸附14 h后几乎变为无色。这可能是因为酵母菌产的氧化酶对MB 进行了降解[23]。图5(b)是吸附不同时间后MB 的紫外吸收光谱。可以看出,随着吸附时间的增加,MB 的最大吸收峰明显减弱,表明MB 随着吸附反应的进行逐渐被降解,进一步验证了D-PC1.4对MB 进行了降解。图5(c)是吸附前后D-PC1.4的FTIR光谱图。从图中可以看出,吸附MB14 h 后,D-PC1.4在1422 cm-1处羧基峰的强度减弱。这是因为水凝胶中带负电荷的羧酸基和MB 之间存在静电作用,如图5(d)(A)所示。随着吸附时间的增加,D-PC1.4在3399 cm-1处羟基吸收峰的强度减弱,峰位也发生了偏移,主要是因为MB 与D-PC1.4的羟基之间发生了离子交换[24],如图5(d)(B)所示。
综上所述,D-PC 去除MB 的机制包括:①生物降解:酵母菌代谢产生氧化酶对MB 的脱色降解;②化学吸附:MB 与水凝胶羟基之间的离子交换;③物理吸附:水凝胶中羧基与MB之间的静电作用。
吸附动力学描述了吸附容量随时间的变化。在吸附动力学研究中,获得吸附容量与时间之间的关系,并使用动力学模型来拟合该关系。在不同的动力学模型中,通常用伪一级模型[式(3)]和伪二级模型[式(4)]来描述固液吸附动力学[25-27]。

式中,qe为平衡状态下MB 的吸附量,mg/g;qt为时间t下MB的吸附量,mg/g;k1为伪一级动力学模型的速率常数;k2为伪二级动力学模型的速率常数。
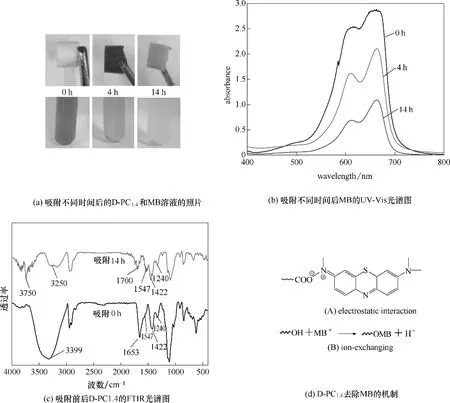
图5 D-PC水凝胶去除MB的机制Fig.5 D-PC hydrogel mechanism for removing MB

表2 伪一级和伪二级吸附动力学模型参数Table 2 Pseudo-primary and pseudo-secondary adsorption kinetic model parameters
为了进一步研究D-PC 对MB 的去除机制,采用伪一级和伪二级动力学模型拟合实验数据,结果如表2 所示。从表2 可以看出,伪二级动力学模型线性化得到的相关系数大于伪一级动力学的相关系数,且由伪二级动力学模型计算得到qe,cal与实验值qe,exp较为接近。结果表明,D-PC1.4对MB的去除以化学吸附为主。
2.3.3 D-PC 水凝胶生物降解性的变化 酵母菌对水凝胶生物降解性影响的结果如图6所示,图6(a)为引入酵母菌前后水凝胶在不含纤维素降解酶体系中PVA 的降解率。从图中可以看出,D-PC1.4中PVA的降解率明显高于PC,其最高降解值高达35%,几乎是PC的三倍,表明酵母菌的引入提高了水凝胶的生物降解性。此外,随着降解时间的增加,D-PC1.4中PVA 的降解速率呈现出先升高后稳定的趋势,主要是因为材料中酵母菌繁殖数量增加,周围营养物质减少,影响了酵母菌的活性,从而使PVA 的降解率降低。图6(b)为纤维素降解酶对D-PC1.4中PVA降解率的影响,图中D-PC1.4在含有纤维素降解酶的体系中PVA 降解率高于不含酶的降解体系。这是因为纤维素降解酶将大分子CMC 降解为小分子单糖,为酵母菌提供营养成分维持了它的活性,然后酵母菌在代谢过程中产生各种活性自由基和脂肪族水解酶,将长链PVA 降解为短链PVA,提高了PVA 的降解率[28-29]。图6(c)~(e)为降解不同时间后D-PC1.4的SEM 照片。与开始降解0 h 相比,降解4 h、14 h 的水凝胶孔洞越来越多,孔径也逐渐增大。这表明水凝胶逐渐被大量降解,破坏了水凝胶原有的三维网状结构,导致孔洞越来越多,越来越大。
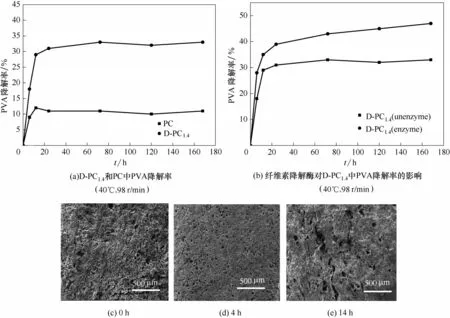
图6 酵母菌对D-PC水凝胶生物降解性的影响以及降解不同时间后D-PC1.4的SEM照片Fig.6 Effect of yeast on biodegradability of D-PC hydrogel and SEM photograph of D-PC1.4after degradation at different time
综上所述,添加酵母菌可以促进D-PC1.4降解PVA,提高材料的生物降解性,减轻了材料废弃后对环境的污染。
3 结 论
通过酵母菌发泡致孔制得的PVA/CMC 多孔水凝胶(D-PC)不仅增加了材料的比表面积和孔径,提高了对MB 的吸附性,还对材料有降解作用,去除机制以化学吸附为主,静电吸附和生物降解为辅,吸附动力学符合伪二级动力学模型;此外,酵母菌代谢产生的酶对材料中PVA 进行了降解,减少了废弃后材料可能对环境产生的二次污染。

