PD-L1在皮肤鳞状细胞癌及角化棘皮瘤中的表达
胡 婕 陈 伟 卢 平 程双华 李 灿
成都医学院第二附属医院,核工业四一六医院,四川成都,610051
皮肤鳞状细胞癌(cutaneous squamous cell carcinoma,cSCC)起源于表皮或附属器的角质形成细胞,是常见的非黑素瘤皮肤恶性肿瘤之一[1],患者行手术切除后5年生存率高于90%,但易发生侵袭和转移[2]。而角化棘皮瘤(keratoacanthoma,KA)是一种少见的皮肤鳞状细胞增生性肿瘤,具有生长快、可自行消退的特点,它在临床表现及组织病理学上与高分化的cSCC难以区分。KA究竟是cSCC的特殊类型还是一种独立的皮肤肿瘤,目前还存在争议。程序性死亡因子配体-1(programmed death factor ligand-1, PD-L1)在多种肿瘤细胞中高表达[3-5],是目前免疫治疗最重要的生物学标志物。本研究通过免疫组化染色(IHC)检测PD-L1在cSCC和KA中的表达情况,分析其与cSCC和KA临床病理参数的关系,初步探讨PD-L1在cSCC发生、发展中的作用,为cSCC的免疫治疗寻找新靶点,并分析PD-L1能否有效区分cSCC和KA。
1 资料与方法
1.1 临床资料 收集2016年2月至2019年12月在我院皮肤科行手术治疗的皮肤鳞状细胞癌及角化棘皮瘤患者共88例。cSCC共56例,男37例,女19例,年龄33~79岁,平均(65.78±11.93)岁。根据Broders病理分级分组:I组(I级)34例,II/III组(II级/III~IV级)22例。伴有淋巴结转移38例,无转移18例。肿瘤位置:曝光部位(面、颈)30例,非曝光部位(背、胸、四肢及会阴)26例。KA共32例,男18例,女14例,年龄46~84岁,平均(66.64±9.05)岁。肿瘤位置:曝光部位(面、颈)21例,非曝光部位(前胸、四肢及会阴)11例。另选取同期在我院行美容整形手术的32例正常皮肤组织切片作为对照组。各组在性别、年龄方面无统计学差异(P>0.05)。
1.2 纳入与排除标准 纳入标准:(1)标本均来源于手术完整切除的瘤体;(2)所有患者均为首次发病,术前未行其他治疗;(3)患者病历资料完整,年龄、性别、皮损部位不限;(4)所有受试者知情同意。排除标准:(1)来源于皮肤活检的标本;(2)合并其他肿瘤或相关疾病者;(3)合并心脑血管、自身免疫性疾病不能耐受手术者;(4)组织病理学诊断不明确者。
本研究患者或家属签署知情同意书,且研究方法遵循伦理学规定,上报本院伦理委员会审核批准。
1.3 研究方法
1.3.1 主要试剂与仪器 免疫组化染色试剂盒(SP法)购于迈新公司,货号:191212s457m;兔抗人PD-L1一抗购于DAKO公司;货号:M3653;EG1150H石蜡包埋机、RM2235石蜡切片机均购于Leica公司;光学显微镜型号为Nikon50i。
1.3.2 免疫组织化学法检测PD-L1表达 将保存的石蜡切片脱蜡、水化后,采用免疫组化SP法检测组织切片中PD-L1蛋白的表达,具体按照全自动免疫组化染色机(Titan,迈新)的标准化操作流程进行。
PD-L1染色结果判断:采用半定量分级法,综合染色强度和阳性细胞百分比积分。每张病理组织切片的全部视野均需观察:(1)染色强度分级:0分(无着色),1分(淡黄色),2分(棕黄色),3分(棕褐色);(2)阳性细胞百分比分级:0分(<5%),1分(5%~25%),2分(26%~50%),3分(51%~75%),4分(>75%)。最终得分=染色强度分级评分×阳性细胞百分比分级评分,结果分为4组:<2分,阴性(-);2~3分,弱阳性(+);4~6分,阳性(++);>6分,强阳性(+++)。由两位病理科资深医师采用盲法进行打分。
1.4 统计学方法 采用SPSS 25.0统计软件分析,计量资料用均数±标准差表示,采用t检验法对各组计量数据进行统计学比较;计数资料采用“%”表示,采用χ2检验法对各组计数数据进行统计学对比,当n<40,且有格子的理论频数<5时,采用Fisher确切概率法直接计算累计概率。P<0.05表示差异有统计学意义。
2 结果
2.1 PD-L1在各组中表达情况的比较 PD-L1在cSCC组的阳性率(66.07%)及KA组中的阳性率(62.50%)均显著高于正常对照组(9.38%),差异有统计学意义(P<0.05),但cSCC与KA组间的差异没有统计学意义(P>0.05)(表1、图1)。
注:cSCC组vs正常对照组:P<0.01;KA组vs正常对照组:P<0.01;cSCC组vs KA组:χ2=1.240,P>0.05
2.2 PD-L1在皮肤鳞状细胞癌组内表达情况的比较 PD-L1在Broders分级分组II/III组中的阳性率(81.82%)高于I组(55.88%),斯皮尔曼相关系数为-0.412,说明PD-L1的表达与cSCC的分化程度呈负相关,即cSCC分化越差PD-L1表达越强,分化越好PD-L1表达越弱,其差异有统计学意义(P<0.05)(表2、图2)。
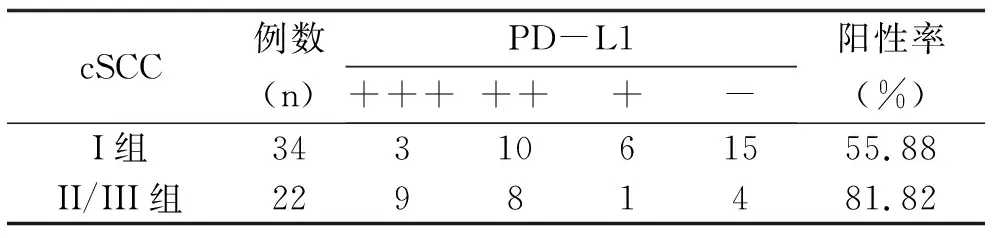
表2 PD-L1在cSCC组内表达情况的比较
注:χ2=9.354,P<0.05;斯皮尔曼相关系数为-0.412,P<0.01
3 讨论
程序性死亡受体-1(programmed death-1,PD-1)又名CD274,是一种50~55KD的I型跨膜糖蛋白,属于B7/CD28协同刺激分子超家族的重要成员。正常情况下,PD-1在活化的CD4+T淋巴细胞、CD8+T淋巴细胞、B细胞、单核细胞和DC表面广泛表达,对维持机体的免疫耐受有重要作用[6]。而在恶性肿瘤的发生过程中,淋巴细胞表面的PD-1与肿瘤细胞表面的PD-L1结合形成PD-1/PD-L1信号通路,通过激活SHP-2,抑制Zap70蛋白的磷酸化水平,上调ERK等蛋白表达,进而释放NF-κB因子,降低肿瘤局部微环境中T细胞的免疫效应[7],介导肿瘤细胞逃逸,并与肿瘤的浸润、转移相关[8]。有针对性的阻断PD-1/PD-L1通路,可以增强T细胞对肿瘤细胞的杀伤。近年来,PD-1和PD-L1抑制剂逐渐应用于非小细胞型肺癌(NSCLS)、肾细胞癌、皮肤黑素瘤和默克尔细胞癌等多种恶性肿瘤,并且取得了良好的治疗效果,一时之间PD-L1作为肿瘤免疫治疗重要的生物学标志而备受关注,但关于cSCC和KA的报道少见。
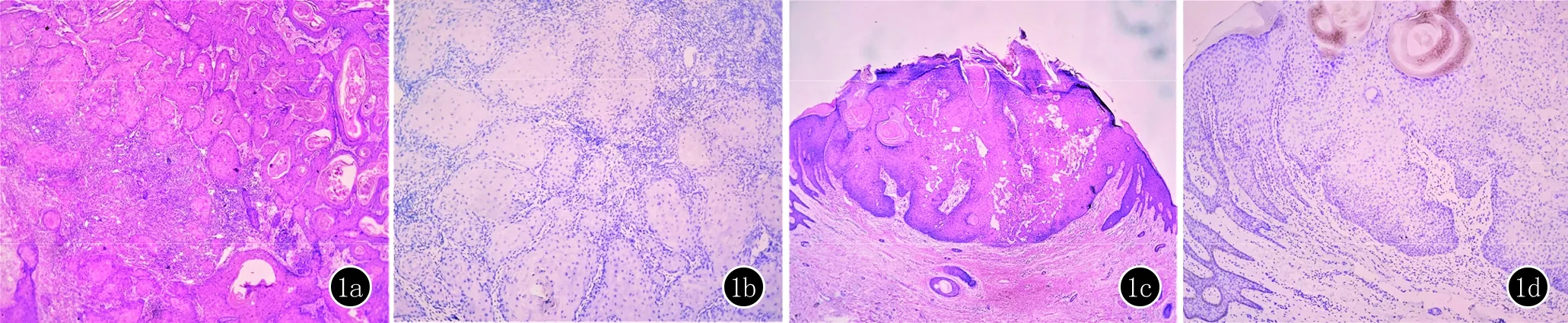
1a,1b:cSCC I组(HE,×40;IHC,×100);1c,1d:KA组(HE,×40;IHC,×100)图1 PD-L1在cSCC组和KA组中表达的情况
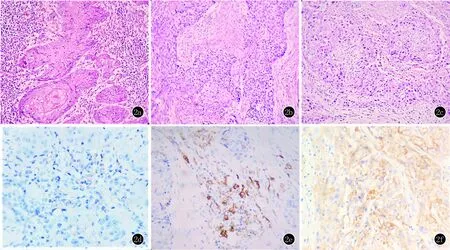
2a:cSCC I组(HE,×200);2b:cSCC II组(HE,×200);1c:cSCC III组(HE,×200);2d:cSCC I组(IHC,×400);2e:cSCC II组(IHC,×400);2f:cSCC III组(IHC,×400)图2 PD-L1在cSCC不同分级组内表达情况
cSCC来源于表皮或附属器角质形成细胞,又称为棘细胞癌,好发于日光损伤部位,易发生侵袭和转移,治疗主要依靠手术切除或者放疗。目前研究认为cSCC的发病机制与紫外辐射、免疫抑制等多因素有关,肿瘤细胞通过抑制T细胞活性,释放免疫炎症因子等方式逃避机体免疫系统的监测,进而不断增殖,加速肿瘤进展[9]。T细胞浸润在cSCC中普遍存在,T细胞受体与配体间的相互作用后可调控T细胞对肿瘤细胞的免疫效能。深入探究影响cSCC的免疫机制,对寻找cSCC的免疫治疗靶标具有重要的作用。本研究发现PD-L1在cSCC患者肿瘤组织中阳性表达率为66.07%,显著高于正常对照组的9.38%(P<0.05),这表明PD-1/PD-L1信号通路介导的免疫抑制可能参与了cSCC的发病。同时我们发现PD-L1的表达与cSCC的组织病理分化程度呈负相关,即cSCC分化越差PD-L1表达越强,分化越好PD-L1表达越弱,这一结果提示cSCC患者的治疗方案除了选择手术切除或放疗以外,在不远的未来还可能会依据肿瘤组织中PD-L1表达的情况,为患者选择个体化的治疗方案。针对PD-1/PD-L1的免疫治疗药物已逐步应用于宫颈癌、头颈部鳞状细胞癌及食管癌等肿瘤的治疗中,我们的研究表明PD-L1可能成为cSCC免疫治疗的新靶点。
KA是一个具有争议的肿瘤实体,绝大多数KA发生在有毛发的皮肤,从而推测KA来源于毛囊上皮细胞,它的消退可能与毛囊周期有关。cSCC和KA无论是临床表现还是组织病理学表现都非常相似,特别是高分化的cSCC和KA之间鉴别困难。最初认为KA是一种伴有明显角化的上皮良性增生性病变,可自愈,生长迅速,数月后可自行消退,不需手术治疗[10],部分学者认为KA具有独特的临床和组织学特征,应是一种独立存在的疾病[11]。但是随着研究的深入,又发现KA有潜在的癌变倾向,少数可恶变为cSCC,却极少发生远处转移[12],因此2004年Hurt等[13]提出KA是cSCC的一种亚型,应将其定义为高分化鳞状细胞癌(角化棘皮瘤型)。在2006版WHO皮肤肿瘤病理学和遗传学中KA被归入棘皮瘤,ICD-O编码:8071/1[14],而2018版WHO中KA被首次归入鳞状细胞癌,ICD-O编码由8071/1变更为8071/3,这表明其生物学行为由良性或恶性未肯定,明确修订为恶性[15],同义词包括:高分化鳞状细胞癌(角化棘皮瘤型)、角化棘皮瘤样鳞状细胞癌。这似乎表明KA应视为cSCC的一种特殊类型,但是2018版WHO依旧保留了“角化棘皮瘤”这个诊断,并且提出虽然cSCC和KA拥有同样的致癌基因MAP3K8(TPL2),但是KA与cSCC的遗传学特征仍存在不同[15]。Ra等[16]的研究也证实KA特有的基因表达谱系分析提示其与鳞状细胞癌在分子上是不同的。虽然目前已有研究提出Ki-67[17]、bcl-2[18]、p53等生物分子表达的差异可能有助于区分cSCC和KA,但尚未发现具有高度特异性和敏感性的分子标志物。本研究发现PD-L1在KA肿瘤细胞表达的阳性率为62.50%,显著高于正常对照组(P<0.01),这说明PD-1/PD-L1信号通路上调可能也参与了KA的发病,但PD-L1在cSCC组与KA组的表达差异没有统计学意义(P>0.05),因此PD-L1仍旧不能有效的区分cSCC和KA。
综上所述,PD-L1在肿瘤细胞中表达上调,引起肿瘤微环境中免疫监视功能的降低,从而使肿瘤细胞发生免疫逃逸,PD-1/PD-L1信号通路可能参与了cSCC和KA的发病。PD-L1与cSCC的分化程度呈负相关,分化越差PD-L1表达越强,PD-L1可能成为cSCC免疫治疗的一个新靶点。PD-L1在cSCC和KA中的表达没有差异性,更为支持KA可能是cSCC的一种特殊类型。由于本研究纳入的病例数量较少,且目前对于PD-L1免疫组化染色结果的判读尚未达成广泛共识,这可能会对结果造成一定的影响,因此后期仍需扩大样本量,继续积累经验,力争为cSCC和KA的诊疗提供更加充分、全面的论据。

