线粒体转录因子A在食管鳞癌中的表达及其机制
王凯莉 陈卫刚 丁新 杨丹平 童娟娟 陈凯丽 张少聪 郑勇
1石河子大学医学院(新疆石河子832000);2石河子大学医学院第一附属医院消化科(新疆石河子832000);3河北北方学院附属第一医院内镜中心(河北张家口075000);4新疆维吾尔自治区人民医院重症医学科(乌鲁木齐830001);5南京市江宁医院康复医学科(南京211100)
食管癌(esophageal cancer,EC)是世界上最常见的恶性肿瘤之一,在2018年全球新发食管癌患者达57 万例,因其死亡人数近51 万例[1],而中国食管癌发病率和死亡率约占全球一半,是世界上食管癌发病率和死亡率最高的国家[2],我国食管癌早期诊断率低,确诊食管癌的有90%为中晚期,5年生存率不足20%[3]。近些年,很多研究通过多种肿瘤标志物联合检测来诊断食管癌,虽然在诊断的准确性上有一定提高,但尚不能作为筛查应用[4]。靶向治疗作为一种不错的治疗途径,但在食管癌的治疗仍处于探索阶段[5]。线粒体转录因子A(mitochondrial transcription factor A,TFAM)在线粒体DNA(mitochondrial DNA,mtDNA)复制、转录和维持其稳定性中发挥重要作用,近年来许多研究已表明,TFAM基因表达水平与多种肿瘤的发生密切相关[6],而TFAM在食管癌发生发展的相关性研究鲜有报道。本研究通过免疫组化方法检测食管低高级别上皮内瘤变、食管癌及正常食管组织中TFAM 蛋白的表达,探讨TFAM与食管鳞癌发生发展的关系,并通过干扰食管鳞癌细胞EC109、EC9706 中TFAM的表达,观察干扰前后细胞增殖、迁移、侵袭、凋亡等生物学特性的变化并探索其作用机制,为食管鳞癌的监测及防治提供新的契机。
1 材料与方法
1.1 组织标本和细胞株本实验标本取自石河子大学医学院第一附属医院消化科和心胸外科2012年1月至2018年8月因食管鳞状上皮病变行胃镜或手术的患者146例,使用组织样本前均告知患者组织将用于科学研究,并签署相关知情同意书,包括正常食管组织、食管低、高级别上皮内瘤变组织和食管鳞癌组织,分别27、39、24、56例,其中正常食管组织取自距离肿瘤边缘5 cm 以上的组织,入选病例有完整的病史资料,所有患者提取组织前均未接受过放、化疗及生物治疗;人食管鳞癌细胞株EC109、EC9706 由石河子大学医学院重点实验室留存。
1.2 实验材料TFAM 兔单克隆抗体(ab176558)购自Abcam公司,免疫组织化学试剂盒购自北京中杉金桥,质粒购自上海吉凯基因化学技术有限公司,质粒序序列号S1:5′-TTGTTTCTTTATTGTGCGACG-3′;S2:5′-TTAGCTGTTCTTTAAATCTGC-3′;S3:5′-AAATCGAAGGTAAGAACTTAC-3′。试剂Lip-ofectaminTM2000和Trizol 购于美国Invitrogen公司,Transwell 小室购自美国Corning公司,流式试剂盒Annnexin V-APC/PI apoptosis Kit 购于联科生物,super signal(R)west Femto Trial kit购自Thermo Fisher科技公司,caspase3(ab32351),Bax(ab32503)兔单克隆抗体购于Abcam公司。
1.3 SP免疫组化法将组织标本从液氮罐中取出,福尔马林浸泡后,石蜡包埋,制成4 μm 切片,脱蜡,枸橼酸缓冲液修复,3%的H2O2溶液冲洗,4℃冰箱孵育一抗过夜,次日,孵育二抗1 h,滴加DAB 显色液显色胞浆,苏木素染液染核,1%酸酒精冲刷,脱水封片。结果判定:根据细胞浆着色强度分为:A 不显色或显色不清楚为0分,浅黄色为1分,黄色为2分,棕黄色为3分,棕色为4分。按显色细胞比例评分:B 显色细胞<5%为0分,6%~25%为1分,26%~50%为2分,51%~75%为3分,>76%为4分,每例积分:A×B≤2分为(-),≥3分为阳性,其中3~4分为(+),5~8分为(++),9~12分及以上为(+++)。
1.4 细胞培养与转染采用含1%双抗(青霉素-链霉素混合液100×),10%胎牛血清的高糖DMEM培养基,于37℃、5%CO2培养箱中培养细胞,24 h 换一次液。细胞汇合度至90%时,以3.5×105个/孔的浓度接种六孔板,以质粒与Lip2000 比例为5 μg/8.5 μL 转染。其中实验组转染干扰质粒,对照组转染空载质粒。加入无血清培养基培养5 h 后换完全培养基培养48 h 后进行实验。
1.5 实时荧光定量PCR实验Trizol 裂解细胞提取总RNA,用Takara Prime Script TMRT reagent Kit(Perfect Real Time)反转录试剂盒反转录为cDNA。qRT-PCR检测TFAM 干扰效率,筛选出下调效果最好的质粒,GAPDH 上游引物:5′-GCTGACAGGATGCAGAAGGA-3′,下游引物:5′-GTGGACAGTGAGGCCAGGAT-3′;TFAM 上游引物为5′-CGCTCCCCCTTCAGTTTTGT -3′,下游引物为5′-TTATATACCTGCCAC TCCGCC-3′。扩增条件为:95℃预变性30 s;95℃变性3 s,60℃退火30 s,循环40次。利用2-△△Ct法计算TFAM 相对表达量。
1.6 MTT实验细胞以3 000个每孔接种于96 孔板,每组设置5个复孔。细胞培养箱培养0、24、48、72 h时在每孔加入10 μL MTT溶液(5 mg/mL),孵育4 h 后,每孔加入150 μL 二甲基亚砜,低速振荡10 min 使结晶物充分溶解,酶联免疫检测仪490 nm 处测量各孔的吸光值。
1.7 平板克隆实验转染48 h 后,以EC109(500个/孔),EC9706(1 000个/孔)接种于六孔板,细胞培养箱中培养9 d 后,PBS 洗涤,多聚甲醛固定,结晶紫染色,计数超过50个细胞的集落。
1.8 Transwell实验细胞转染48 h后,消化、离心,无血清培养基重悬细胞1.5 × 105个/mL,取200 μL细胞悬液接种于transwell 上层小室,下层小室加入750 μL 20%完全培养基,48 h 后取出小室,固定染色,计数迁移细胞数,侵袭实验取配好的Matrigel胶70 μL 加入上层小室孵育5 h 备用,其余同迁移实验。
1.9 流式细胞技术实验取转染48 h 后细胞,不含EDTA 胰酶消化收集细胞,预冷PBS 洗涤两次,收集105个细胞,用1×Binding Buffer 500 μL 重悬细胞,每管加入5 μL Annexin V-APC和10 μLPI,混匀后,室温孵育5 min 后检测。
1.10 Western blot 实验细胞转染48 h 后,用300 μL 裂解液(PMSP∶RIPA=1∶100)在冰上裂解细胞提取蛋白,根据浓度配平后,煮沸15 min,取15 μL 蛋白液电泳,转到硝酸纤维素膜,封闭1 h,加入一抗在摇床孵育过夜。室温孵育二抗2 h,发光试剂显色曝光。Image J 软件测定条带的灰度值。
1.11 统计学方法采用SPSS 22.0 进行统计分析。数据统计以表示,计量资料两组间比较采用独立样本t检验,等级资料采用非参数检验,相关性用Spearman 检验,检验水准为α=0.05。
2 结果
2.1 在不同食管组织中TFAM的表达免疫组化结果显示,TFAM 蛋白在细胞浆中表达(图1),正常食管、食管鳞状上皮内瘤变组织和食管癌中表达阳性率分别为11.1%(3/27)、90.5%(57/63)和100%(56/56),其表达呈递增趋势,差异有统计学意义(Z=115.44,P<0.001;ρ=0.88,P<0.001)。见表1。
2.2 食管鳞癌组织中TFAM的表达与临床病理特征的关系TFAM蛋白的表达与食管癌浸润深度、临床分期、淋巴转移有关(P<0.001)。与患者年龄、性别、组织学分级无关(P>0.05),侵及肌层及外膜层的食管鳞癌组织中TFAM的蛋白表达明显高于侵及黏膜层的食管鳞癌组织(P<0.001),TFAM的阳性表达率随着TNM 分期等级的增高而增加(P= 0.001)。在淋巴结转移的食管鳞癌组织TFAM 阳性表达率高于无淋巴结转移的食管鳞癌组织(P=0.042)。见表1、2。

图1 TFAM 蛋白在正常食管组织,低、高级别上皮内瘤变和食管鳞癌组织中的表达(SP×200)Fig.1 Expression of TFAM protein in normal esophageal tissue,low-grade intraepithelial neoplasia,high-grade intraepithelial neoplasia and esophageal squamous cell carcinoma(SP×200)
2.3 瞬转后TFAM在食管鳞癌细胞中的表达量显著降低qRT-PCR 结果显示,EC109 细胞转染TFAM 干扰质粒后,与对照组相比TFAM的表达降低[(0.363±0.148)vs.(1.000±0.298),t=-3.304,P= 0.030]。同样,EC9706 细胞瞬转干扰质粒后TFAM表达量低于对照组[(0.346±0.017)vs.(1.000±0.398),t=-2.837,P=0.047]。见图2。Western blot结果显示,EC109 细胞实验组TFAM表达量显著降低[(0.420±0.021)vs.(1.520±0.035),t= 59.434,P<0.001];EC9706细胞实验结果与其一致[(0.649±0.013)vs.(1.095±0.030),t=23.276,P<0.001]。
2.4 降低TFAM表达能抑制食管鳞癌细胞增殖能力MTT 增殖实验显示,下调TFAM 蛋白表达后能显著抑制食管鳞癌细胞的增殖能力,EC109 细胞在转染12 h时就出现细胞增殖能力减弱[(0.250±0.046)vs.(0.310±0.029),t=-2.72 6,P= 0.03]。同样,EC9706 细胞在转染12 h时也表现出增殖能力受限[(0.260±0.013)vs.(0.310±0.013)],差异有统计学意义(t=-6.049,P<0.001),见图3A。干扰TFAM表达后细胞增殖速度明显减慢。见图3B。
2.5 下调TFAM表达能抑制食管鳞癌细胞克隆形成能力克隆形成试验结果表明,下调TFAM表达后,EC109和EC9706 细胞株克隆形成能力均降低,EC109 对照组克隆形成率高于实验组[(30.00±1.40)%vs.(25.67±1.30)%,t=3.927,P=0.017]。EC9706 细胞实验结果与其一致,与对照组克隆形成率(21.27±0.83)%相比,实验组克隆形成率减少(13.50±0.78)%,差异有统计学意义(t= 11.783,P<0.001)。见图4。
2.6 降低TFAM表达能抑制食管鳞癌细胞迁移能力对TFAM 敲减后,EC109 细胞迁移能力显著降低,对照组和实验组穿膜个数分别为(81.33±8.39)、(34.67±4.16)个(t= 8.633,P= 0.001);EC9706 细胞实验结果与其一致,对照组细胞迁移个数(73.75±24.17)个,多于干扰组细胞迁移个数(38.5±6.65)个,差异有统计学意义(t= 2.812,P=0.031)。见图5。
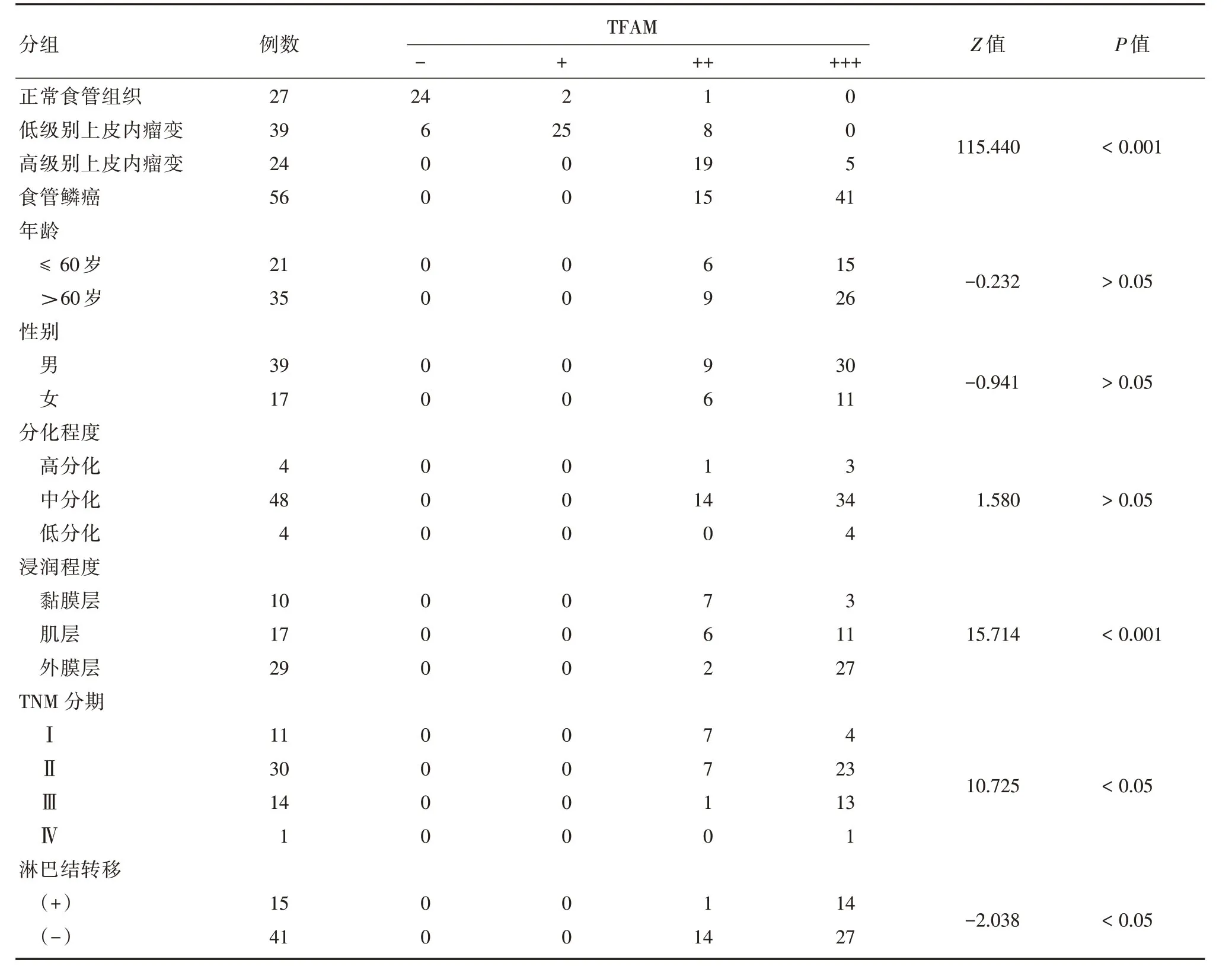
表1 TFAM 蛋白在不同食管鳞状上皮组织中的表达及其与临床病理因素的关系Tab.1 Expression of TFAM protein in different esophageal squamous epithelial tissuesand its relationship with clinicopathological factors例

表2 TFAM蛋白在不同食管鳞状上皮组织分组中的表达Spearman相关系数表Tab.2 Expression of TFAM protein in different esophageal squamous epithelial tissuegroups by Spearman correlation coefficient table例
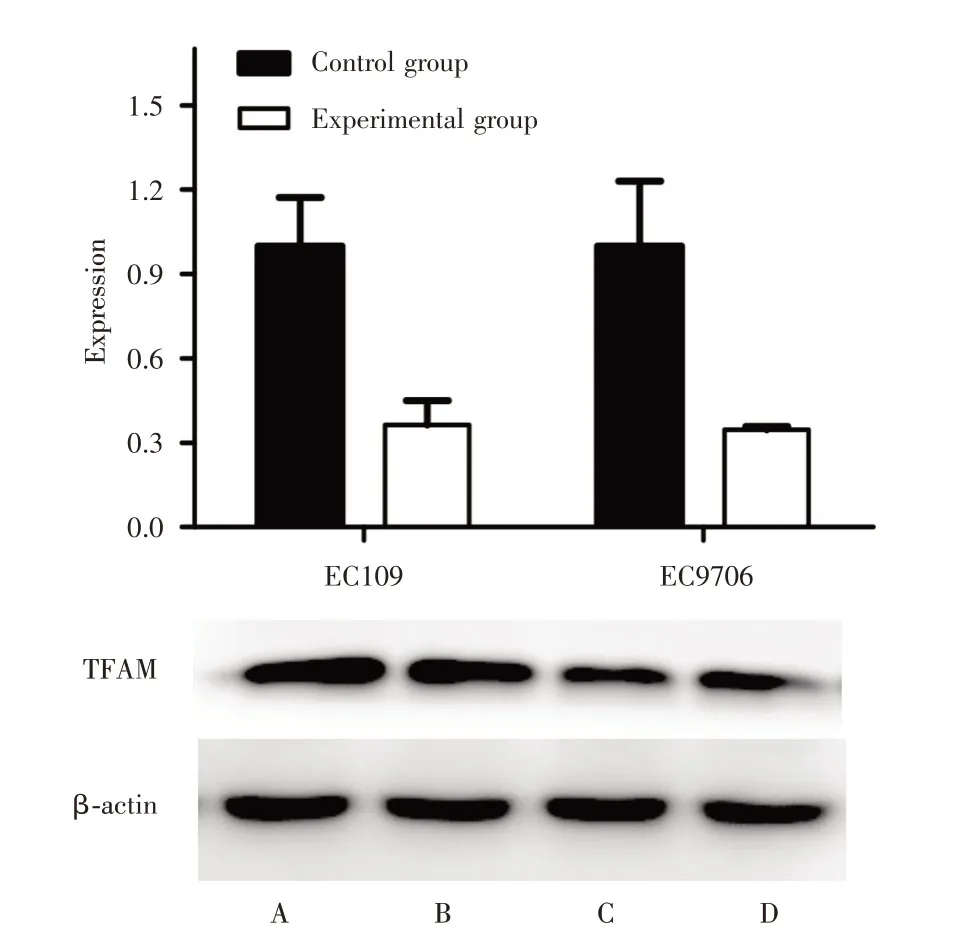
图2 qPCR(A)和Western blot(B)分析各组细胞的转染效率Fig.2 qPCR(A)and Western blot(B)analysis of transfection efficiency of each group of cells

图3 MTT 检测各组细胞增殖能力结果Fig.3 MTT test results of cell proliferation abilities in the various groups
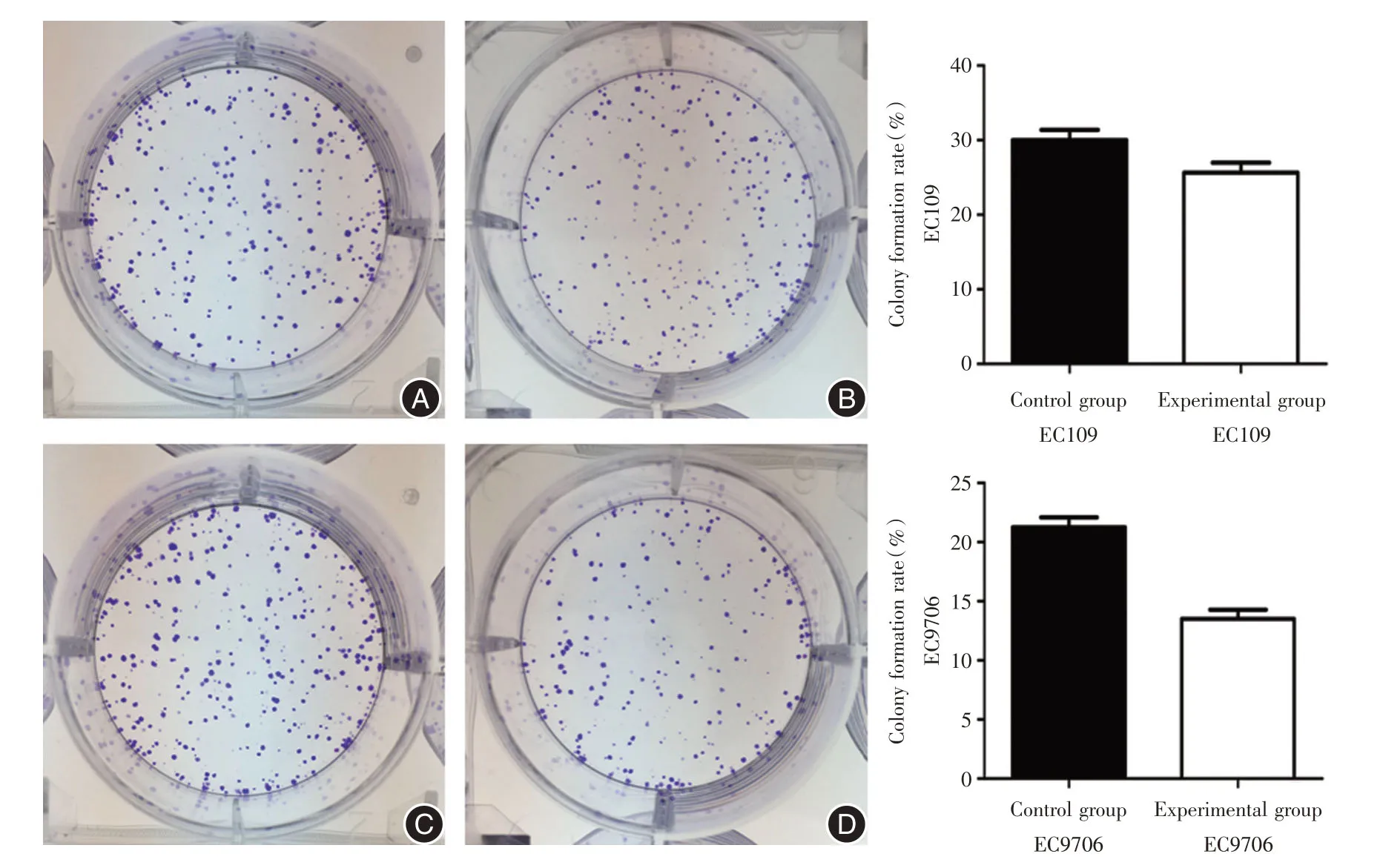
图4 EC109 EC9706 细胞克隆形成实验结果Fig.4 Results of the EC109 EC9706 cell clone formation experiment
2.7 降低TFAM表达能抑制食管鳞癌细胞侵袭能力Transwell 侵袭实验结果表明:下调TFAM基因能够抑制EC109 细胞侵袭能力,EC109 细胞的对照组穿膜数(62.67±7.51)个,明显多于干扰组(18.00±2.65)个,差异有统计学意义(t=9.721,P=0.001)。同样,EC9706 细胞对照组侵袭个数多于实验组[(43.6±5.03)vs.(14.6±4.67)个,(t=9.449,P<0.001)]。见图6。
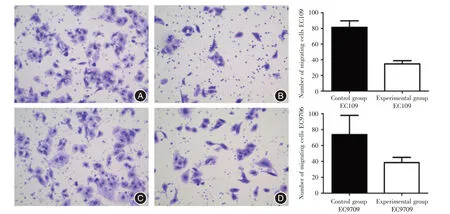
图5 EC109、EC9706 细胞Transwell 迁移实验结果(结晶紫染色×200)Fig.5 Experimental results of migration of EC109 and EC9706 cells in Transwell(crystall violette staining× 200)
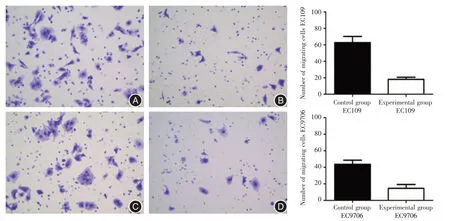
图6 EC109、EC9706 细胞Transwell 侵袭实验结果(结晶紫染色×200)Fig.6 Experimental results of invasion of EC109 and EC9706 cells in Transwell(crystall violette staining× 200)
2.8 降低TFAM表达可促进食管鳞癌细胞的凋亡流式细胞技术实验结果表明,下调TFAM基因能够促进EC109 细胞凋亡,对照组与干扰组的凋亡率分别为:[(6.176±0.652)%vs.(33.560±2.458)%,t=-18.647,P<0.001]。EC9706细胞对照组凋亡率(6.563±0.918)%,比实验组细胞凋亡率(32.333±1.835)%低,差异有统计学意义(t=-21.747,P<0.001)。见图7。
2.9 降低TFAM表达可促进食管鳞癌细胞bax、Cleaved caspase3蛋白表达与对照组相比,EC109细胞干扰组Bax表达量显著升高[(0.450±0.023)vs.(0.690±0.021),t=-16.764,P<0.001];EC9706细胞实验结果与其一致[(0.320±0.021)vs.(0.870±0.041),t=-26.309,P<0.001]。此外,EC109细胞干扰组Cleaved Caspase3表达量显著升高[(0.750±0.023)vs.(1.080±0.014),t=-27,P<0.001];EC9706 细胞实验结果与其一致[(0.750±0.020)vs.(0.970±0.021),t=-17.394,P<0.001]。见图8。
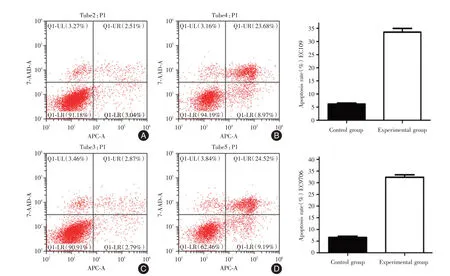
图7 流式细胞技术检测细胞凋亡实验结果Fig.7 Experimental results of flow cytometry for detecting apoptosis

图8 各组食管鳞癌细胞中Bax和Cleaved caspase3的蛋白质表达水平Fig.8 Protein expression levels of Bax and Cleaved caspase3 in esophageal squamous carcinoma cell
3 讨论
我国食管癌发生在80~84岁年龄阶段人群中最多[7],老年人由于身体状况差且常伴有多种基础疾病,如高血压、糖尿病等,使手术难度大、风险高,只能选择放化疗,尽管放化疗的方案仍在不断改进,但放化疗远期所面临的癌症复发及各种并发症仍然难以避免[8-9]。我国食管癌预后差的重要原因是早期诊出率低。若能早期诊治,及时给予干预措施,将为公共卫生事业减轻负担。因此,早期诊断食管癌的技术手段及肿瘤标志物的研究更为迫切。
本研究中,食管鳞癌组织TFAM表达阳性率显著高于非典型增生上皮及正常食管上皮组织,提示TFAM可能参与食管鳞癌的发生。在严重的食管鳞癌患者中,TFAM表达量明显更高,表明TFAM可能参与食管鳞癌的侵袭及演进。与QIAO等[10]研究结果一致,TFAM在肝癌组织中的表达量明显高于癌旁组织。此外,本研究细胞实验结果显示,干扰TFAM 使其表达下调后发现两株食管癌细胞增殖、迁移、侵袭能力显著下降,表明该基因可能扮演着促癌基因的角色,促进食管癌的增殖、转移和浸润。XIE 等[11]研究认为是下调TFAM后激活ROS 介导的JNK/p38MAPK 信号传导通路并且降低细胞能量所致。但TFAM在食管癌中的作用机制尚待进一步研究。WU 等[12]发现下调TFAM可提高肺腺癌细胞对化疗药物的敏感度,表明TFAM可能介导癌细胞对抗肿瘤药物耐药性的产生。TFAM 有望成为治疗、预测癌症患者预后的有效靶点和标志物。
本研究流式结果提示,通过下调TFAM表达后,细胞凋亡率明显增高,线粒体是介导细胞凋亡的重要细胞器,其活性的破坏与癌症的发展有关[13]。mtDNA是除细胞核染色体以外的基因组,具有自我复制、转录和蛋白质合成功能,TFAM在维持mtDNA 完整性中发挥着核心作用[14-15],当线粒体受到损伤后,介导Caspase 凋亡途径引起“瀑布”样酶联反应,首先诱发促凋亡蛋白Bax 活化,使线粒体膜两端电压差消失,膜通透性增加,细胞色素C(Cytochrome C,Cytc)得以释放,Cytc、Apfl和DATP/ATP 结合生成凋亡小体,凋亡小体自我剪切后,活化Caspase-9,其在进一步活化下游Caspase3、6、7,最终促使细胞内蛋白质降解,细胞不可逆地走向死亡。在线粒体凋亡途径中Caspase3是凋亡信息的执行者,是Caspase 介导凋亡的必经之路[16]。Bax是Bcl-2 家族中促进凋亡的成员,是线粒体介导的Caspase 凋亡途径的关键效应物[17]。为了解其机制,笔者用Western blot 方法检测,发现下调TFAM表达的食管鳞癌细胞中Cleaved caspase3、Bax表达明显增加,预示着降低TFAM在食管癌细胞中的表达可能通过促进Cleaved caspase3、Bax 凋亡蛋白的表达对细胞凋亡产生影响。
综上所述,TFAM与食管癌的发生发展有密切联系,并可能通过影响Bax、caspase3的表达来调控食管癌细胞的凋亡。随着国家精准医疗战略的开展,若能靶向检测食管癌上该基因表达量及抑制该基因,将为食管癌的早期诊断、治疗和预后提供新的契机。然而由于本研究样本量较少,且缺少体内实验,论证结果说明有限,后期将进行动物实验进一步研究。
——一道江苏高考题的奥秘解读和拓展

