孕激素和脂联素分子受体3过表达对子宫内膜异位症间质细胞中ERK1/2表达及细胞侵袭性影响
郝婷 商丽红 哈春芳
1宁夏医科大学临床医学院(银川750001);2宁夏医科大学总医院妇科(银川750004)
子宫内膜异位症(endometriosis,EMs,简称内异症)是指子宫内膜(间质或腺体)出现在宫腔以外的部位导致以慢性盆腔疼痛、痛经和不孕症为主要症状的育龄妇女常见的妇科良性疾病[1]。虽然是良性疾病,但其浸润周围组织,甚至可以通过淋巴转移至盆腔以外的组织,有很多肿瘤才有的遗传学改变,高复发性,严重影响女性身心健康。目前该病发病机制仍不明确,研究显示[2]EMs是一种子宫内膜细胞活性增高所致的内膜异常性基因病,与内膜细胞的异地粘附、增殖及侵袭性增强有关。ERK1/2是MAPK 信息传导通路中一个重要的因子,目前是MAPK 信号通路中研究最广泛的,在细胞外活性因子调节细胞内各种酶促反应中发挥重要的作用,与细胞增殖与凋亡关系密切[3]。研究显示[4]ERK1/2与正常子宫内膜比较,在内异症中的在位内膜间质细胞过度表达,并且磷酸化的水平也明显增高,孕激素通过ERK1/2 刺激内膜间质细胞增殖、抑制细胞凋亡,ERK1/2 能够在子宫内膜异位症的发病机制中起着一定的作用,但其确切机制尚不十分清楚。肿瘤学研究显示ERK通过Ras/Raf/MEK/ERK 通路介导肿瘤细胞的侵袭与转移,内异症中研究甚少。脂联素分子受体3(progestin and adipoQ receptor,PAQR3)是脂连素受体家族的成员之一,最近被定性为负性调节Ras/Raf/MEK/ERK 信号传导的空间调节因子级联。近年来研究显示[5]PAQR3在多种恶性肿瘤疾病中抑制ERK表达影响细胞增殖、侵袭及凋亡,进而促进疾病发生发展。但PAQR3在内异症中对于ERK的表达及细胞侵袭性的影响仍未有报道。本研究通过构建重组过表达PAQR3 慢病毒,探讨其对于子宫内膜异位症在位内膜间质细胞中ERK1/2表达及细胞侵袭性变化,为从机制上探寻EMs 新的治疗靶点。
1 资料与方法
1.1 一般资料研究标本(子宫内膜组织)均来源于2018年9月至2019年6月宁夏医科大学总医院在妇科行“腹腔镜下卵巢子宫内膜异位囊肿剥除术”,术中“刮宫术”获取子宫在位内膜组织,术后经病理科诊断为“卵巢子宫内膜异位囊肿”的子宫内膜异位症育龄期妇女患者10例(术前月经周期规律,均处于分泌期子宫内膜,半年内无其他器官器质性病变无内科疾病,术前未接受激素药物治疗,宫腔无占位等病变),年龄20~40岁,平均(30.860±5.216)岁。该研究已通过“宁夏医科大学总医院伦理委员会”的批准授权,参加实验及研究人员均已签定知情同意书。
1.2 方法
1.2.1 原代细胞培养术中获取新鲜在位子宫内膜组织放于液氮罐,快速转运至细胞间,用PBS(磷酸盐缓冲液)清洗3次,剪成约1 mm3大小的细小组织,加入含0.25%胶原酶IV(Gibio 17104-019)受热消化吹打8 min,取上清液移入新离心管,含10%血清培养基终止消化,800 r/min 离心1 min,弃去上清,重新悬浮后加入培养皿中,37℃5%CO2培养箱培养,隔日换液1次,细胞达到90%左右的融合进行细胞传代及冻存。
1.2.2 细胞鉴定按照2 × 104/mL的细胞密度接种于6孔培养板,6 h后观察待细胞贴壁50%后,PBS清洗标本3次各1 min,4%多聚甲醛固定15 min;室温干燥5 min;PBS 清洗3次各1 min,加入过氧化酶阻断剂,置于37℃30 min;PBS清洗3次各1 min;加山羊血清,置于37℃30 min;一抗孵育(PBS配兔单克隆波形蛋白抗体1∶500;兔单克隆角蛋白1∶50;抗体均购自上海abcam公司;阴性对照用PBS),置于湿盒内4℃过夜;PBS 清洗3次,各1 min;二抗(山羊抗兔单克隆抗体)湿盒37℃30 min 孵育;PBS 清洗3次,各1 min;加入链霉素抗生物素蛋白-过氧化酶,置于37℃30 min;PBS 清洗3次各1 min;DAB 显色避光约3~10 min ;蒸馏水清洗2次,各1 min;苏木素复染30 s;自来水清洗10 min;95%乙醇脱水1~2 s,树胶封片显微镜下观察。
1.2.3 重组慢病毒PAQR3转染细胞病毒由北京合生生物科技公司设计构建合成,测定在位内膜间质细胞MOI=50(72 h 转染效率80%以上)为最佳转染;以每皿3×105个细胞接种于6 cm2培养皿,晃动细胞皿使其均匀分布,置于37℃5%CO2培养箱中过夜,待细胞贴壁30%~50%,无血清培养基换液,取MOI=50 作为最佳MOI 进行慢病毒转染,3组细胞吹散均匀混合,置37℃5%CO2培养箱8~12 h 后,继续添加2 mL 含血清培养基后置于37℃5%CO2培养箱,观察细胞状态必要时进行细胞换液,培养72 h 后观察细胞荧光进行细胞传代,以2 μg/mL 嘌呤霉素进行筛选阳性稳定克隆株。
1.2.4 Western blot当子宫内膜间质细胞培养融合达70%以上时,用预冷PBS液冲洗3次,凯基蛋白提取试剂盒说明进行蛋白提取,用BCA 蛋白检测试剂盒检测蛋白浓度后,置于沸水中10 min 使其蛋白变性。用8% SDS-PAGE 分离蛋白,然后转移至醋酸纤维膜上,5%脱脂牛奶室温封闭1.5 h,一抗孵育4℃过夜,次日TBST 冲洗3遍各5 min,二抗室温下晃荡1 h,TBST 冲洗5遍各5 min,最后,置于BIO-RAD 成像仪,加入ECL 增强液反应1 min(1 mL A液+1 mL B液,混匀,覆盖膜表面),最后根据曝光结果,运用Image J 计算光密度比值。
1.2.5 Transwell将Matrigel与无血清培养基按照1∶8 比例混合均匀,取Transwell 小室移入24 孔板中,每个小室上室内加入100 μL 配置好Matrigel,避免底部接触,37℃孵育过夜;取对数期生长间质细胞,用0.25%的EDTA 胰酶将消化,加入无血清培养液制成细胞悬液,计数1.5×104/mL,小室中加入细胞悬液200 μL(3 000个/孔)。下室中加入配置含20%血清的培养液500 μL,在37℃5%CO2培养箱中培养48 h 后,取出小室吸出培养液,PBS 冲洗3遍,4%多聚甲醛固定30 min,0.1%结晶紫染色30 min,PBS 冲洗3遍,棉签蘸取多余水分,显微镜下每个小室选5个视野进行计数拍照,计算平均值,最后比较各组干预前后细胞穿膜数的变化。
1.3 统计学方法每组实验均重复3次以上,采用SPSS 23.0 统计软件进行统计学分析,计量资料结果以()表示,计量资料两组间比较采用两样本t检验,多样本均数比较采用单因素方差分析,以P<0.05为差异有统计学意义。
2 结果
2.1 原代子宫内膜异位症在位内膜间质细胞鉴定原代培养、分离、纯化在位子宫内膜间质细胞。以波形蛋白阳性,角蛋白阴性作为间质细胞鉴定标准。通过免疫细胞化学鉴定细胞,显微镜下观察:波形蛋白组细胞大多呈梭形,染色呈棕黄色,细胞核明显,提示波形蛋白染色阳性,而角蛋白组细胞也呈梭形表现,胞核明显,但未见细胞染色,提示角蛋白染色阴性,PBS组细胞同角蛋白组,阴性表现,依据以上结果判定其为间质细胞。每张细胞片取10个不同视野进行间质细胞计数,细胞纯度可达(93.00±0.17)%。见图1。

图1 子宫内膜间质细胞免疫细胞化学鉴定(×100)Fig.1 Immunocytochemical identification of endometrial stromal cells
2.2 慢病毒转染效果带有绿色荧光蛋白(green fluorescent protien,GFP)的慢病毒Lv-PAQR3 及空载慢病毒,两者均转染内异症在位子宫内膜间质细胞,倒置荧光显微镜下观察转染效果,病毒组和空载组72 h 后GFP 下观察阳性细胞布满视野,表明转染成功。见图2。
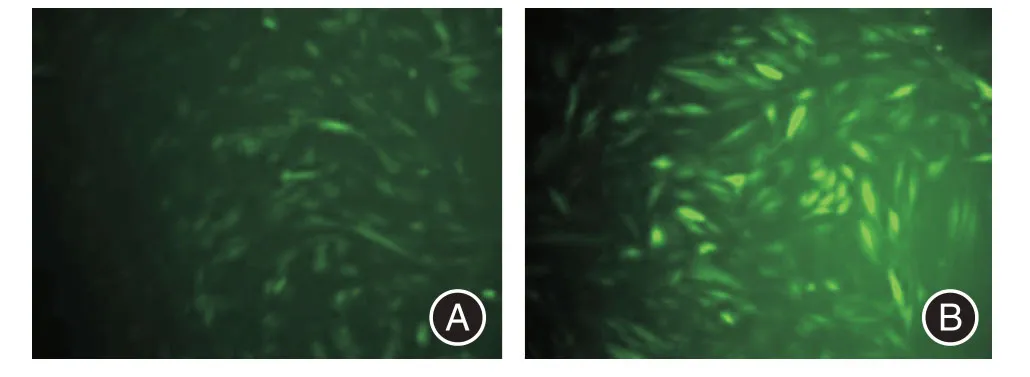
图2 倒置荧光显微镜下观察72 h 子宫内膜间质细胞的慢病毒转染效果(×200)Fig.2 Effect of Lentiviral Transfection of Endometrial Stromal Cells in 72 h under an Inverted Fluorescence Microscope(×200)
2.3 3组细胞中PAQR3蛋白表达情况Western blot 检测在位内膜间质细胞转染前后PAQR3 蛋白表达情况,Lv-hPAQR3 干预后病毒组PAQR3 蛋白表达情况较空载组明显上调,差异具有统计学意义(P<0.05),而空载组与空白组间差异无统计学意义(P>0.05)。见图3、4 及表1。
表1 3组细胞中PAQR3 蛋白表达相对量Tab.1 The relative amount of PAQR3 protein expression in three groups of cells ±s

表1 3组细胞中PAQR3 蛋白表达相对量Tab.1 The relative amount of PAQR3 protein expression in three groups of cells ±s
注:*与空载组比较,P<0.05
组别病毒组空载组空白组PAQR3表达量0.954±0.317*0.268±0.130 0.293±0.154 F 值9.668 P 值0.013

图3 慢病毒转染后各组细胞中PAQR3 蛋白表达结果Fig.3 PAQR3 protein expression in cells of each group after lentivirus transfection
2.4 3组细胞中ERK1/2 蛋白表达情况Western blot 检测在位内膜间质细胞转染前后ERK1/2 蛋白表达情况,Lv-hPAQR3 干预后病毒组ERK1/2 蛋白表达情况较空载组明显下降,差异具有统计学意义(P<0.05),而空载组与空白组间差异无统计学意义(P>0.05)。见图5、6 及表2。

图4 慢病毒转染后各组细胞中PAQR3 蛋白表达影响Fig.4 Effect of PAQR3 protein expression in cells of various groups after lentivirus transfection
表2 3组细胞中ERK1/2 蛋白表达相对量Tab.2 The relative amount of ERK1/2 protein expression in three groups of cells±s

表2 3组细胞中ERK1/2 蛋白表达相对量Tab.2 The relative amount of ERK1/2 protein expression in three groups of cells±s
注:*与空载组比较,P<0.05
组别病毒组空载组空白组ERK1/2表达量0.254±0.166*1.105±0.313 1.199±0.312 F 值10.926 P 值0.01

图5 慢病毒转染后各组细胞中ERK1/2 蛋白表达结果Fig.5 Expression of ERK1/2 protein in cells of each group after lentivirus transfection
2.5 3组细胞侵袭性变化情况Transwell 侵袭实验检测各个组细胞侵袭性变化结果,Lv-hPAQR3干预后病毒组细胞48 h 穿膜细胞数与空载组穿膜细胞数比较,差异具有统计学意义(P<0.05);空载组与空白组两者比较,差异无统计学意义(P>0.05)。见图7 及表3。

图6 慢病毒转染后各组细胞中ERK1/2 蛋白表达影响Fig.6 Effect of ERK1/2 protein Expression in cells of various group after lentivirus transfection
表3 过表达PAQR3 对3组在位内膜间质细胞侵袭性的影响Tab.3 Effects of PAQR3 overexpression on invasiveness of eutopic endometrial stromal cells in three groups±s

表3 过表达PAQR3 对3组在位内膜间质细胞侵袭性的影响Tab.3 Effects of PAQR3 overexpression on invasiveness of eutopic endometrial stromal cells in three groups±s
注:**与空载组比较,P<0.01
组别病毒组空载组空白组细胞穿膜数(个)65.8±4.438**97.8±3.271 99.6±4.700 F 值103.92 P 值<0.001
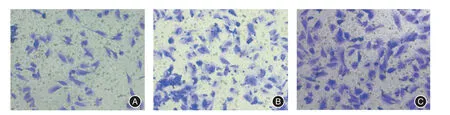
图7 各组在位内膜间质细胞48 h 侵袭效果(×400)Fig.7 48-hour invasion effect of eutopic endometrial stromal cells in each group(×400)
3 讨论
子宫内膜异位症具有类似恶性肿瘤侵袭、迁移、血管生成以及凋亡等生物学特性,多条信号通路可能促进其发生发展。目前治疗方式仍以手术及药物治疗为主[6]。病理特点包括局部浸润生长、远端移植、新生血管形成和术后高度复发[7]。目前EMs 发病机制仍然是妨碍疾病治疗及预防的难点之一,研究显示[8]解剖学因素、遗传因素、内环境、激素调节、免疫反应和氧化应激因子等都与EMs的发病机制相关。目前研究显示[9]子宫内膜异位症中ERK1/2和MEK1/2表达上调,提示MAPK通路在子宫内膜异位症中过度活化。细胞从受到刺激至其出现相应生物学效应的改变过程中,MAPK 相应出现多级激酶的变化,而在这一过程中,ERK1/2 活化是将信号从细胞膜表面受体转导至细胞核的关键,这一转导过程有GTPase2Ras、Ras21和MEK 双特异性激酶等上游元素参与,Ras/Raf/MEK/ERK 细胞信号传递通路中ERK1/2是重要的信号分子[10-13]。
课题组前期通过表达谱芯片技术分析EMs在位、异位内膜中基因表达谱差异,发现MAPK、VEFG、PKC、Ras、ERK、NF-κB和PI3K 等因子显著上调,各因子间具体调控机制不明确。前期研究已验证子宫内膜异位症中ERK1/2 较正常内膜呈高表达,需进一步明确ERK1/2 及其对EMs 细胞侵袭性作用机制。结合肿瘤学研究显示ERK 通过Ras/Raf/MEK/ERK 通路介导肿瘤细胞的侵袭转移,结合前期研究机制统一指向Ras/Raf/MEK/ERK 信号通路。PAQR3 作为Ras/Raf/MEK/ERK 通路特异负性调节因子,本研究采用重组过表达PAQR3 慢病毒转染EMs在位原代间质细胞抑制Ras/Raf/MEK/ERK 信号通路,运用Western blot 及Transwell实验方法,结果显示实验组过表达PAQR3 后ERK1/2 蛋白表达较阴性对照组呈下降趋势,且实验组较阴性对照组细胞侵袭性明显受抑制,阴性对照组与空白对照组间差异无统计学意义。说明在子宫内膜异位症中ERK 可能是通过Ras/Raf/MEK/ERK 信号通路发挥作用,影响细胞侵袭性变化,进而促进子宫内膜异位症发生发展。
ERK1/2[14]是一种细胞外调节蛋白激酶,主要被各种生长因子、离子射线、过氧化氢等磷酸化激活发挥作用。ERK1/2[15]主要定位于胞质,受细胞外炎性因子刺激并由其上游激酶MEK 激活,继而入核发挥作用。Matsuzaki S 教授等研究表明在内异症及深部浸润内异症患者上皮细胞和间质细胞中ERK1/2表达及磷酸化程度较正常内膜相比显著增高[16],提示ERK1/2 可能在子宫内膜异位症侵袭和发展中发挥重要作用。近年研究[17]发现PAQR3 作为一种抑癌新基因在许多肿瘤细胞增殖、侵袭、转移及凋亡变化过程中发挥重要作用。PAQR3是一种特异定位于高尔基体膜上的细胞器膜蛋白,PAQR3 已被认定为许多肿瘤的抑制因子,PAQR3 过度表达导致肿瘤细胞增殖、迁移、种植和血管生成[18-19],其主要作用是将胞质内的B-Raf和C-Raf 激酶锚定在高尔基体上,造成Raf 激酶空间分布变化,干扰Raf 激酶与上游活化G 蛋白Ras-GTP 以及下游底物MEK 激酶的结合,阻断和抑制其活化信号的传递,进而阻碍丝裂原信号Ras/Raf/MEK/ERK 通路的活化[20],其在能量代谢,细胞凋亡,肿瘤发生等方面发挥重要调控作用[21-22]。在人类白血病研究中其可通过抑制ERK表达进而抑制细胞增殖,诱导细胞凋亡[23]。依据本实验结果显示子宫内膜异位症中过表达PAQR3 抑制Ras/Raf/MEK/ERK 信号通路,可下调ERK1/2 蛋白表达并且抑制细胞侵袭性变化。这一发现是从机制和源头上寻找内异症发生发展的原因,进一步揭示复发的关键。
综上所述,ERK1/2在子宫内膜异位症发生发展中发挥重要作用,而该作用可能是通过Ras/Raf/MEK/ERK 通路调控,但具体调节机制仍需进一步明确。EMs 作为一种多因素导致的基因混乱疾病,对于其研究仍任重道远。

