2017 年WHO 成釉细胞瘤新分类的逻辑性与临床指导意义
陶谦, 杨耀成
中山大学光华口腔医学院·附属口腔医院,广东省口腔医学重点实验室,广东 广州(510055)
成釉细胞瘤是最常见的牙源性上皮性良性肿瘤,具有局部侵袭和复发的倾向[1],素有“临界瘤”之称。肿瘤起源于牙源性上皮或牙源性上皮剩余,组织病理学形态多样,临床病理分类比较复杂,多种分类标准共存,其中世界卫生组织(World Health Organization,WHO)的分类标准最具广泛性和权威性。自1971 年第一版国际分类标准开始,WHO 对成釉细胞瘤分类前后进行了3 次修订[2-5]。本文回顾了成釉细胞瘤命名和分类的历史演变,纵向对比、归纳并总结第四版《WHO 头颈部肿瘤分类》中关于成釉细胞瘤分类的变化,分析其内在逻辑,以期深化对成釉细胞瘤新分类的认识和理解。
对成釉细胞瘤的认识最早可追溯至1879 年,由Falkson 首先描述此病,1885 年Malassez 称之为釉质上皮瘤(adamantinoma)或牙釉质瘤(adamantoblastoma)。直到1930 年,Ivy 和Churchill 正式命名为成釉细胞瘤(ameloblastoma),并一直沿用至今。20 世 纪 中 期,Pindborg 和Clausen 认 为 牙 源 性 肿 瘤在某种程度上体现了上皮和间充质组织之间的相互作用,并据此提出分类,其后逐渐发展演化为1971 年的《WHO 牙源性肿瘤、颌骨囊肿及其相关病变的组织学分类》(第一版)[2],标志着世界范围内统一的、公认的命名体系和分类标准的出现,随后一些具有独特临床病理学特点的成釉细胞瘤陆续被报道,例如1975 年Singh 等报道的棘皮瘤型成釉细胞瘤,1977 年Robinson 等报道的单囊型成釉细胞瘤(unicystic ameloblastoma)以及1984 年Eversole 等报道的促结缔组织增生型成釉细胞瘤(desmoplastic ameloblastoma)等。1992 年WHO 更新并发布了《牙源性肿瘤的组织学分型》(第二版)[3],首次对成釉细胞瘤进行组织病理学分型,需要指出,第二版并未对成釉细胞瘤临床亚型进行分类。2005 年《WHO 头颈部肿瘤病理学与遗传学分类》(第三版)再一次对牙源性肿瘤分类进行修订,首次使用复数词“ameloblastomas”表述成釉细胞瘤,体现了肿瘤命名内涵的多样性,新增良/恶性成釉细胞瘤的临床亚型分类,并认识到单囊型成釉细胞瘤的独特表现[4]。新近《WHO 头颈部肿瘤分类》(第四版,简称“WHO 新分类”)在2017 年1 月发布[5],新分类以“简明(simplicity)、实证(clinical relevance)、科学(scientific validity)和实用(utility)”为指导原则,对成釉细胞瘤分类作了较大幅度的修订[6,7],见表1。除了WHO 分类外,较为大家所认可的成釉细胞瘤分类还有Gardner 分类和于世凤分类,二者的共同特点是将成釉细胞瘤分为一般型、单囊型和外周型3 大临床亚类。
疾病命名和分类体系的不断变迁反映出认识疾病是一个循序渐进的过程。第一版中仅依据肿瘤的良恶性简单分为成釉细胞瘤和成釉细胞癌两类;而第二版突出肿瘤细胞的排列特点,分出滤泡型、丛状型、棘皮瘤型、基底细胞型和颗粒细胞型等多个病理学亚型;第三版中成釉细胞瘤不再简单地作为单一实体,而分为“实体/多囊型、骨外/外周型、促结缔组织增生型和单囊型”4 种临床亚型;新近第四版分类在简化肿瘤临床亚型的同时,更吸收和强调遗传学和分子生物学的研究成果。梳理不同版本分类间变化脉络,可以看出简单-复杂-简单的螺旋式上升的特点,相互间既有传承,又有升华,体现了人们对疾病认识不断深入的过程。
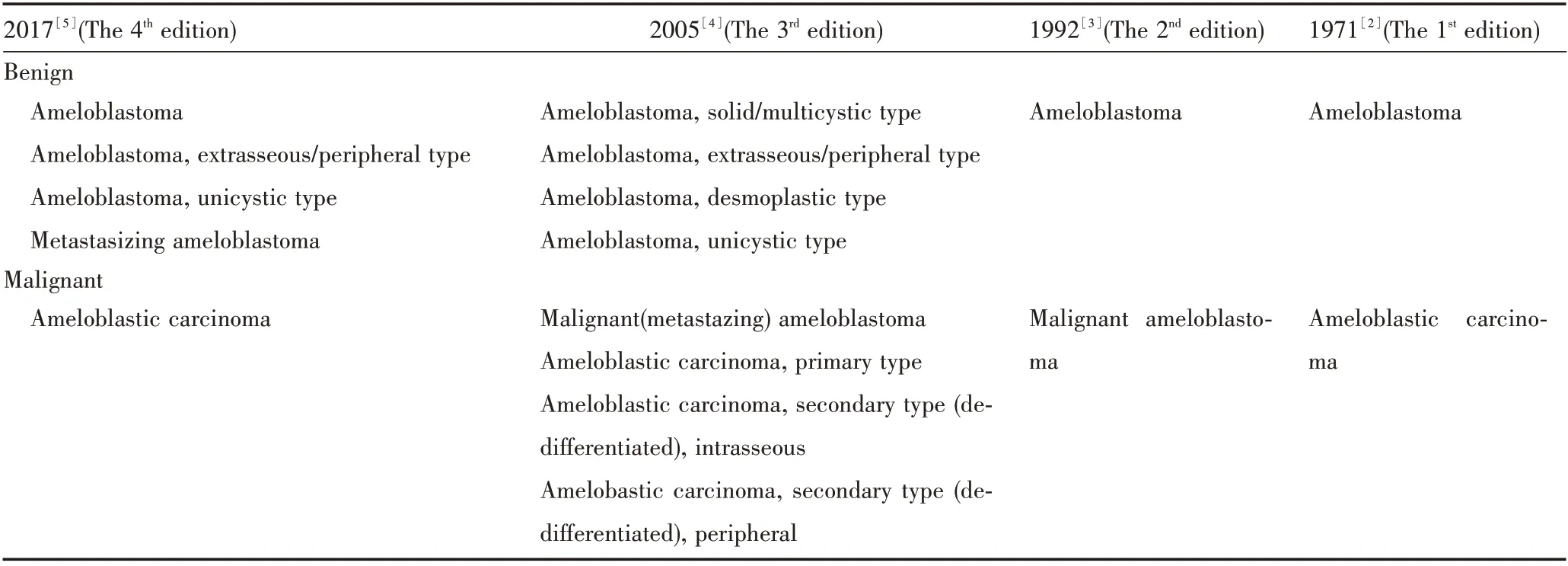
表1 4 版WHO 良/恶性成釉细胞瘤分类Table 1 Four editions of WHO classification of benign/malignant ameloblastoma
大量临床病理资料发现[1,8-10],绝大多数成釉细胞瘤都表现为实性肿瘤组织与局部囊性病灶同时存在,“实性”或“囊性”与肿瘤的生物学行为没有关联,这种形态学描述缺乏临床意义,且“囊性”的使用容易与单囊型成釉细胞瘤的概念混淆[6,11],因此WHO 新分类中描述性定语“实性/多囊(solid/multicystic)”被删除。此外,“促结缔组织增生型成釉细胞瘤”在前一版分类中作为独立临床诊断而列出[4],但事实上其临床行为与经典成釉细胞瘤并没有区别,这种组织病理学亚型分类不具有临床意义[12],因而第四版将其剔除,把以往的多个临床病理亚型统称为“(经典型)成釉细胞瘤”[5]。不难看出,WHO 新分类依据临床实证,淡化组织病理学亚型而突出临床生物学行为的权重,分型更加简明实用,可更好地指导临床诊疗和预后评估。与此同时,WHO 也大大精简了成釉细胞癌的分类。第三版将成釉细胞癌分为三种亚型:原发型、继发型(去分化)骨内型和继发型(去分化)周围型[4]。然而,这些亚型之间具有形态学连续性和相似的生物学行为,亚型分类的临床意义并不大[6,11],而且成釉细胞癌的发病率很低[13]。因此,WHO 新分类仅保留成釉细胞癌单一诊断[5],再一次印证了新分类的简明与实用宗旨。
WHO 新分类保留了具有独特生物学行为的两个亚型——“骨外/周围型”和“单囊型”成釉细胞瘤,后者可分为三种组织学亚型[14]:单纯囊性型(luminal variant)、囊腔内瘤结节型(intraluminal variant)和囊壁内浸润型(mural variant)。其中,单纯囊性型和囊腔内瘤结节型的复发率不到10%,囊壁内浸润型的复发率为36%,与传统的成釉细胞瘤相似[14]。有学者据此建议将侵犯囊壁的单囊型成釉细胞瘤划为经典成釉细胞瘤[9]。因此,WHO 新分类特别指出,囊壁内浸润的单囊型成釉细胞瘤具有与传统成釉细胞瘤相同的生物学侵袭特性,临床医生无论在手术还是术后随访都应加强对这一亚型的重视,但是否重新分类仍需更进一步的临床实证和研究[5]。
第三版认为“转移性成釉细胞瘤(metastasizing ameloblastoma)”是恶性成釉细胞瘤的一种亚型,并指出诊断该病只有在转移发生后才能作出,确诊的依据是其临床行为而非组织学表现[4]。事实上,尽管转移性成釉细胞瘤可发生远处转移,但原发灶和转移灶均为良性成釉细胞瘤的组织学特征[15]。与发生在唾液腺的转移性多形性腺瘤相似,后者已被认为是传统良性多形性腺瘤的一种变体[5]。据统计,转移性成釉细胞瘤最常见于肺部,其次为颈部淋巴结,患者带瘤生存时间可长达37 年,而且放射治疗和化疗并不能改善其预后[16]。因此,WHO 新分类将“转移性成釉细胞瘤”归入“良性牙源性上皮性肿瘤”的类别中[5]。这一变化明确了转移性成釉细胞瘤的良性本质,为指导临床诊治、避免过度治疗提供参考依据,具有重要临床意义。
基础和应用基础研究可极大地促进临床医学的发展。WHO 新分类既及时反映了成釉细胞瘤的遗传学和分子学最新研究进展,又预示其在临床靶向治疗中的应用前景。其吸收了2014 年的多项遗传学研究成果[17-19]:大多数成釉细胞瘤中存在调控细胞增殖和分化等功能的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路信号转导异常,包含有BRAF、KRAS、NRAS 和FGFR2 等多种突变,以BRAF V600E 突变最常见,发生率约为63%,而在其它牙源性肿瘤中未发现BRAF V600E 突变存在[17];体外研究表明,BRAF 抑制剂可有效抑制成釉细胞瘤细胞的增殖和MAPK 通路的激活[18-19]。后续有多位学者证实BRAF V600E 突变与成釉细胞瘤的侵袭特性显著相关,可以作为评估预后的分子标记[20-22]。有关基础研究成果推动了靶向BRAF V600E 治疗成釉细胞瘤的临床应用。BRAF V600E 抑制剂首先应用在转移性黑色素瘤、转移性肺癌等恶性肿瘤的靶向治疗[23-24],2014 年Kaye 等[25]采用BRAF 联合靶向药物(达拉非尼和曲美替尼)治疗一例多次手术后复发并颈部淋巴结和肺部转移的成釉细胞瘤患者,取得了显著疗效。此后,多个临床有效病例相继被报道:Tan 等[26]和Faden 等[27]都曾使用达拉非尼治疗多次复发的转移性成釉细胞瘤老年患者各1 例,随访近一年时间,发现肿瘤体积减小超过75%;Fernandes等[28]使用维莫非尼治疗1 例复发性成釉细胞癌年轻患者,11 个月后随访发现肿瘤显著缩小,临床症状完全消退。随着靶向药物有效治疗转移性成釉细胞瘤的更多应用报道,充分显示了WHO 新分类的前瞻性,成釉细胞瘤遗传学研究推动了其靶向BRAF 突变的临床应用,丰富了治疗手段。新分类还介绍了MAPK 信号通路以外的其他突变,例如SMO,SMARCB1,CTNNB1 等,其中SMO 突变较常见,且多与MAPK 通路突变同时发生[18-19],但靶向SMO 突变的治疗尚未见临床应用。
每一次疾病分类的更新与迭代都是为了更好地应用于临床指导疾病诊断和治疗。2017 年WHO 新分类指出,对于经典的成釉细胞瘤,目前的治疗方法是扩大切除范围,应超过影像学所示的肿瘤边界,术后随访应至少持续25 年乃至终身随访[5,29]。如果肿瘤多次复发,建议做基因检测,对BRAF 突变的病例推荐使用BRAF 靶向药物进行补充治疗。对于影像学表现为单囊型的成釉细胞瘤,其侵袭性较低,初次治疗可采取开窗术或刮除术,但如果病理结果最终确定有肿瘤细胞浸润囊壁组织,则需要再次手术扩大切除肿瘤或密切随访,一旦复发则需视作经典成釉细胞瘤进行手术切除[5]。而外周型成釉细胞瘤的治疗方式同以前,在正常组织边界内扩大切除肿瘤病灶即可,极少出现复发。新分类同时强调,转移性成釉细胞瘤属于良性肿瘤,放射治疗和化学治疗无益,不能改善患者的预后[18],因此外科手术是治疗转移性成釉细胞瘤的关键,手术方式因转移发生部位而不同。但成釉细胞癌是恶性牙源性上皮性肿瘤,治疗上需采取手术切除和术后放疗,也有学者提出采用积极的多模式治疗(如碳离子治疗和伽玛刀立体定向放射外科)[30]。
2017 年WHO 成釉细胞瘤新分类总结了过去10 余年成釉细胞瘤在组织病理和临床治疗等方面的经验及成果,依据疾病的临床本质简化分类,秉承其一贯的“简明和实用”宗旨,同时凝练近期分子遗传学等领域的研究进展,科学地指明未来对成釉细胞瘤的基础研究方向,预示BRAF 靶向治疗可能为复发性或无法手术的成釉细胞瘤患者带来新的治疗选择和希望。总而言之,成釉细胞瘤WHO 新分类将更好地服务临床日常诊疗工作,也将作为成釉细胞瘤下一轮研究和分类的新起点。
——中国居民收入分配中的逆向调节机制

