基于磁性材料的适配体传感器在赭曲霉毒素超灵敏检测中的研究进展
蔡小霞,苑静,林童,郭徐静,熊勇华,吴科盛,郭亮*
1(南昌大学 食品科学与技术国家重点实验室,江西 南昌,330047) 2(南昌大学 中德联合研究院,江西 南昌,330047) 3(江西省兽药饲料监察所,江西 南昌,330029)
赭曲霉毒素是一类由曲霉属(Aspergillus)和青霉属(Penicillium)产生的有毒次级代谢产物,主要包括赭曲霉毒素A(ochratoxin A,OTA),赭曲霉毒素B(ochratoxin B,OTB)和赭曲霉毒素C(ochratoxin C,OTC)。其中OTA毒性最大,对人和动物具有致畸性、致癌性及免疫毒性等多种毒性作用,已被世界卫生组织国际癌症研究署定为2B类致癌物[1]。OTA因其化学性质稳定而广泛存在于谷粮类食品和饲料等农产品中,对人畜健康和世界经济造成的危害仅次于黄曲霉毒素B1(aflatoxin B1,AFB1)[2]。目前食品中OTA的定性、定量检测方法主要包括色谱法、酶联免疫法(enzyme linked immunosorbent assay,ELISA)和免疫层析试纸条法(immunochromatographic test strip,ICA)等。其中,高效液相色谱法是当前常用的确证定量检测方法,但是该方法需要昂贵的大型仪器设备、繁复费时的样品前处理过程以及相应的专业技术人员,检测成本高且耗时费力[3]。ELISA和ICA均为基于抗原、抗体特异性结合的免疫学检测方法,具有特异性好、经济简便、耗时少等优点,已被广泛用于食品中有害物质的快速筛查及现场检测。但是免疫学检测中使用的抗体稳定性差、制备过程复杂、批间差异大且成本高,检测结果的重复性难以控制,检测条件及检测产品保存条件要求较高[4]。
核酸适配体是通过指数富集配体系统进化技术从随机寡核苷酸文库中筛选获得的,能与相应配体进行高亲和力特异性结合的寡核苷酸序列(DNA或RNA)。它与配体间的亲和力可与抗原抗体间相互作用相媲美,同时具有抗理化因素干扰能力强、可体外人工合成、制备成本低且无批间差异及易运输保存等诸多优点。因此,以适配体替代抗体作为识别元件的生物传感器已逐渐成为分析检测领域的研究热点之一。CRUZ-AGUADO等[5]于2008年首次筛选出具有高亲和力和高特异性的OTA核酸适配体并已被广泛应用,但迄今OTB和OTC适配体尚未见报道。适配体传感器常用的检测模式与免疫学检测方法类似,包括竞争型和夹心型2类。其中,对真菌毒素等小分子化合物的检测多采用目标物和互补DNA(complementary DNA,cDNA)竞争结合适配体的模式进行。虽然适配体传感器已被广泛用于真菌毒素等各类目标物的分析,但是由于样品基质可干扰检测信号及目标物的识别,因此其仍难以实现对复杂样品中痕量目标物的快速超灵敏检测。
表面功能化磁性微纳米材料,尤其是磁性亚微米或纳米材料,因其比表面积大、磁操作简便、溶液中悬浮性良好,可有效提高磁珠表面的反应或吸附效率,并实现待测物或检测探针与样品基质的快速分离及富集浓缩[6]。因此,磁性微纳米材料在复杂样品前处理[7]、传感器构建[8]和即时检测新方法建立[9]等分析测试领域均有广泛应用。其中,基于磁性材料以核酸适配体为识别元件的磁性适配体传感器,具有识别反应效率高的特点,可通过快速分离富集待测物或信号探针提高复杂基质检测时的信噪比,进而提高适配体传感器的检测灵敏度,以及简化操作并缩短检测时间等。基于上述优点,近年来适配体传感器、基于磁性材料的传感器以及磁性适配体传感器的相关研究数量均迅速增加(图1)。其中,磁性适配体传感器相关研究的增长最为显著,近十年来开始逐步受到关注。
图1 由Web of Science提供历年来磁性传感器、适配体传感器、磁性适配体传感器的相关论文发表情况Fig.1 Publishment on magnetic sensor, aptasensor andmagnetic aptasensor over the years from Web of Science
由于适配体与靶标识别后不能产生可检测的特殊信号,故需将其识别过程通过标记探针或化学反应,转换成易识别的物理或化学信号。根据输出信号的不同,可将适配体传感器分为光学传感器、电化学传感器、核酸定量型传感器等。近年来,随着纳米技术的快速发展,纳米材料已被广泛应用于改进或替代上述各类传感器的传统信号生成模式,以提高其检测灵敏度及稳定性。此外,基于核酸扩增反应的生物技术亦被越来越多地应用于适配体传感器的信号放大。本文综述了2011年以来基于磁性材料的适配体传感器在赭曲霉毒素超灵敏检测中的应用,其中着重对近5年来此类传感器在设计思路、适配体检测探针的制备方法以及应用纳米材料和生物技术提高其检测灵敏度等方面的最新进展进行了详细分析,以期为相关科研工作者在真菌毒素的超灵敏检测提供一定的理论及应用参考依据。
1 光学磁性适配体传感器
光学适配体传感器是指将适配体和目标分子之间的特异性相互作用转变为可测定的光学信号的装置,具有操作简便、灵敏度高、成本低等特点[10]。各类光学磁性适配体传感器在OTA检测方面的应用及其机理如下所述。
1.1 比色法适配体传感器
比色法是光学传感器中最为常见且简便的一种检测模式,主要借助颜色反应对溶液中的化合物进行检测。该方法不需要昂贵复杂的仪器,且可实现裸眼检测。由于酶可提高显色反应速率、放大显色信号,因此酶促显色反应在比色传感器中最为常用。LIN等[11]以适配体为识别元件,并利用适配体连接表面修饰cDNA片段的磁珠和装载大量辣根过氧化物酶(horseradish peroxidase,HRP)的脂质体制备三元复合物作为磁性检测探针。检测时,OTA可竞争结合适配体、破坏检测探针,从而产生游离脂质体。磁分离去除未反应的检测探针后,通过裂解磁吸上清中的脂质体释放HRP,即可催化3,3′,5,5′-四甲基联苯胺(3,3′,5,5′-tetramethylbenzidine,TMB)反应显色进行检测。与传统ELISA相比,该方法的竞争反应在悬浮于溶液中的磁珠表面进行,而非孔表面,反应面积大大增加,通过磁分离可快速简便地实现竞争反应产物和检测探针的分离,避免了包板、洗板等繁复的操作步骤。因此,磁珠的应用有效地提高了反应效率,同时简化了检测流程。此外,因单个脂质体中包裹了大量HRP,该传感器检测灵敏度较高,其检出限(limit of detection,LOD)可达0.023 ng/mL。
由于天然酶的稳定性较差、价格昂贵,近年来具有模拟酶活性的各种纳米材料因催化活性高、稳定性好、价格低廉且可大量制备等优点,在传感、环境处理及医学等领域的应用进步显著[12]。WANG等[13]设计了一种基于表面修饰cDNA的金磁纳米粒子的OTA比色传感器。该金磁纳米粒子由金纳米粒子(Au nanoparticles,AuNPs)和Fe3O4纳米粒子掺杂而成,同时具备类过氧化物酶活性和氧化铁的磁学特性。当反应体系中存在OTA时,金磁纳米粒子可从固相支持物上被竞争下来,同时通过磁吸实现催化剂的富集与分离。在该传感器中,信号探针自身具有磁性,因此可简便地通过磁富集提升信号强度,从而增高检测灵敏度。TIAN等[14]则将碱性磷酸酶(alkaline phosphatase,ALP)和具备类过氧化物酶活性的MnO2纳米片联用构建了一种“turn off”型OTA比色传感器。当OTA存在时,通过适配体和cDNA杂交双链结合于纳米磁珠表面的ALP被竞争下来,并催化抗坏血酸磷酸盐产生抗坏血酸(ascorbic acid,AA)。由于AA具有还原性,可将Mn4+转化为Mn2+,破坏MnO2纳米片的结构和模拟酶活性,从而使TMB显色降低。
此外,变色染料(如酸碱指示剂)也可用于输出比色信号。和常见酶促反应显色相比,这类试剂具有显色步骤简单、价格低廉等特点。HAO等[15]构建了一种基于(磁性)石墨烯、适配体和4种变色染料的比色传感器,用于4种毒素的同时检测。该传感器中的磁性石墨烯通过4种适配体,分别与荷载不同变色染料的石墨烯结合。当某种待测物存在时,其相应适配体连接的荷载染料的石墨烯与磁性石墨烯分离。由于4种变色染料的释放及显色条件不同,竞争反应体系经磁分离后,通过调节溶液pH值,可依次释放不同染料并呈现不同的颜色。其中,对OTA的检测范围及LOD分别为5~250 ng/mL和5 ng/mL。
1.2 化学发光适配体传感器
化学发光(chemiluminiscence,CL)是物质在进行化学反应过程中伴随的一种电磁辐射现象。化学发光分析法灵敏度高、检测限宽、仪器相对简单、操作较简便且可实现全自动化,目前在生物学、临床医学等领域应用广泛。在众多化学发光体系中,过氧化物酶催化H2O2氧化鲁米诺发光最为常见。因此,具备类过氧化物酶活性的AuNPs也被作为催化剂应用于基于鲁米诺发光反应的化学发光检测体系中。例如李素等[16]将多条生物素标记的cDNA片段2,通过适配体连接至修饰有cDNA片段1的磁珠表面,作为检测探针。竞争反应后,利用磁回收的检测探针上残留的生物素标记的cDNA片段2,捕获链霉亲和素标记的AuNPs,并加入羟胺/Au3+使检测探针上的AuNPs继续生长以增强其化学发光能力,进而提高检测灵敏度,该方法LOD低至1.58 pg/mL。
由于适配体传感器中的竞争反应产物是DNA分子,核酸反应可用于竞争反应信号的放大以提高检测灵敏度。HUN等[17]构建了一种利用DNA聚合酶和内切酶进行信号放大的OTA化学发光传感器,该传感器由2种核酸修饰的纳米磁珠、cDNA和辅助DNA(与cDNA部分互补并含缺口内切酶Nb. Bbvcl的识别位点)组成。其中表面修饰适配体的磁珠可与cDNA杂交形成探针复合物。当OTA存在时,竞争反应产生的游离cDNA磁吸后残留在上清中,并与辅助DNA部分序列杂交形成复合物。以cDNA为引物,Phi29 DNA聚合酶可催化聚合形成完整的辅助DNA互补链。该互补链可被Nb. Bbvcl切割成cDNA和一条短单链DNA(short single-stranded DNA,ssDNA)。其中,新生成的cDNA又可引发新的聚合及切割过程产生新的ssDNA。因此,经多次“聚合-切割”循环后,一个竞争反应产物(cDNA)即可引发形成大量报告分子(ssDNA),从而放大反应信号。在化学发光阶段,该ssDNA可作为连接臂,通过DNA序列互补配对作用,连接另一种核酸修饰的纳米磁珠和异鲁米诺标记的SiO2纳米粒子,形成三元杂交复合物。最后磁富集该复合物,并引入化学发光底物H2O2和催化剂Co2+反应产生化学发光信号。在该传感器设计中,2种寡核苷酸修饰的纳米磁珠分别起到了从反应体系中分离未反应的cDNA和捕获浓缩ssDNA的作用,提高了传感器设计的灵活性和检测灵敏度。该适配体传感器检测OTA的线性范围为1×10-3~50 ng/mL,LOD可达0.3 pg/mL。
1.3 荧光适配体传感器
荧光是指荧光分子或荧光纳米材料从激发态返回基态时发出的光。基于荧光信号的适配体传感器具有较高的特异性、灵敏度,可分为标记和无标记2大类。近年来,基于磁性材料的OTA荧光适配体传感器的相关研究见表1。
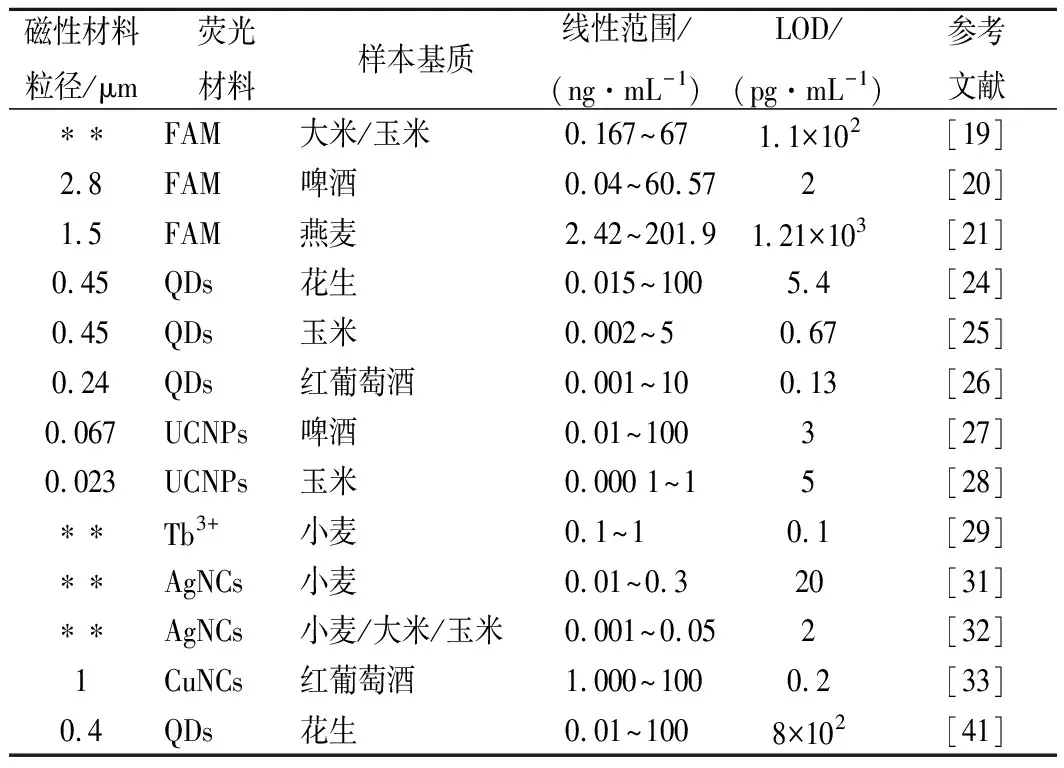
表1 基于磁性材料的荧光适配体传感器在OTA检测中的应用概况Table 1 Applications of fluorescent aptasensors based onmagnetic material in ochratoxin A detection
注:**,表示文献中未见报道(下同)
多数荧光检测采用标记检测法,其常用标记物包括有机荧光分子、荧光团及荧光纳米粒子等。荧光分子廉价易得,但荧光较弱,因此研究者将一些共轭荧光聚合物作为激发光能量传递体,引入以荧光分子为标记物的光学传感器中,以提高其灵敏度[18]。聚(9,9-双(6′-N,N,N-三甲基铵)己基)-亚芴基亚苯基二溴化物(poly(9,9-bis(6′-N,N,Ntrimethylammonium)hexyl)-fluorenylene phenylene dibromide,PFP)是一种典型的阳离子共轭荧光聚合物,具有特定的主链和大量重复的吸收单元,其可通过静电相互作用,与带负电的荧光分子标记的DNA形成稳定的聚电解质复合物,并将激发光能量通过荧光共振能量转移作用传递给DNA上的荧光分子,使其荧光信号增强。LIU等[19]首次结合使用PFP、羧基荧光素(carboxyfluorescein,FAM)标记的cDNA以及适配体修饰的磁珠用于检测OTA,其LOD为0.11 ng/mL,比未使用PFP时灵敏度提高6倍。为进一步提高检测灵敏度,HAYAT等[20]用含有大量FAM分子的荧光微球标记适配体,并以其为信号探针建立了基于表面偶联抗原的磁珠的OTA间接竞争检测法。由于荧光微球荧光强度远高于单个FAM分子,其LOD降至2 pg/mL。此外,WANG等[21]利用FAM的荧光信号可被转化为消逝波信号的原理,开发了一种基于适体的消逝波全纤维(evanescent wave all-fiber,EWA)生物传感器用于OTA的检测。该传感器具有优良的稳定性,可重复使用300次。
与有机荧光分子相比,荧光纳米材料具有更高的荧光强度和良好的光稳定性。其中,量子点(quantum dots,QDs)具有激发光谱广、发射光谱窄、量子产率高等特点,常被作为荧光标记物用于真菌毒素检测[22]。而以含有大量QD的荧光微球为探针,可进一步增强探针荧光强度,进而提高检测灵敏度[23]。WANG等[24]成功设计了一种以内部和表面带有大量CdTe量子点的SiO2亚微米球为荧光探针,表面修饰适配体的金磁粒子为捕获探针的OTA适配体传感器。其中金磁粒子表面的金壳层使磁性材料可简便、高效地与末端巯基化核酸链(适配体或cDNA)结合,并提高磁性材料的生物稳定性。检测时,OTA可将cDNA修饰的荧光探针从金磁粒子表面竞争下来,通过测定磁回收后,对上清中游离探针的荧光强度进行OTA定量检测,其LOD达5.4 pg/mL。QIAN等[25]则采用类似方法,以2种表面偶联不同颜色QDs的硅球为探针,同时检测小麦中的AFB1和OTA,其中OTA的LOD达0.67 pg/mL。在上述各检测体系中,每发生一次竞争反应仅对应产生一个荧光探针的信号,信号强度仍然有限。因此,YAO等[26]借助滚环扩增技术(rolling cycle amplification,RCA),建立了一种单次竞争反应对应多个荧光探针信号的新型OTA检测方法。该方法所用磁性检测探针表面偶联有含适配体的DNA片段,其序列与环状模板部分互补。当体系中无OTA时,含适配体的DNA片段可作为引物在环状模板上反复滚环扩增,形成含大量重复DNA片段的长链核酸。该扩增产物可与大量QDs标记的cDNA信号探针杂交,使磁珠产生强烈的荧光信号。而当OTA存在时,检测探针上的环状模板脱落,使磁珠表面的RCA反应因缺少模板无法进行,磁珠荧光信号显著降低。该方法通过磁吸可地除去多余的信号探针并浓缩磁珠,进而提高信噪比和灵敏度,其LOD可达0.13 pg/mL。
上转换纳米粒子(upconversion nanoparticles,UCNPs)是一类含有镧系离子的反-斯托克斯发光纳米晶体,且其光学性质可通过改变粒子中镧系元素的组成和比例进行调节。由于激发发射模式与大多数荧光物质相反,以UCNPs为检测探针可克服基质中荧光物质的干扰,尤其适用于复杂生物样品中的目标物分析。DAI等[27]和WU等[28]先后利用适配体和cDNA相互作用制备UCNPs-磁性纳米粒子复合物作为检测探针,分别用于检测啤酒和玉米中的OTA。当OTA存在时,UCNPs从磁性复合物中竞争下来使其荧光减弱。因此,在磁回收去除游离UCNPs后,通过测定磁性复合物荧光强度变化,即可实现OTA定量检测。研究结果表明,上述2种方法均有较宽的线性检测范围(0.01~100 ng/mL和0.000 1~1 ng/mL)。前者的实际样品检测限为5 pg/mL,后者的方法检测限达0.1 pg/mL,且复合物探针在4 ℃保存30 d后检测信号值仅损失1%。
与标记分析方法相比,无标记生物传感器无需添加二级信号探针,更为简便、快捷,且检测成本较低。ZHANG等[29]在磁珠表面偶联适配体并与cDNA形成双链,利用单链DNA可显著增强Tb3+荧光强度的原理,依据OTA将单链cDNA竞争下来前后溶液荧光强度的变化进行定量。该方法发光方式简单,无需荧光标记过程,克服了标记材料的高标记成本和标记效应。此外,特定序列的DNA可结合金属离子并反应形成具有不同性能的金属纳米材料,如荧光金属纳米簇等。由于竞争反应产物是DNA,DNA金属化是一种十分适于无标记适配体传感器的检测信号产生方式[30]。如ZHANG等[31]利用Ag+可在还原剂的作用下,可以竞争反应产生的单链DNA为模板生长荧光银纳米簇(Ag nanoclusters,AgNCs)的原理设计了一种无标记OTA适配体传感器。因金属纳米簇荧光稳定性良好、量子产率高,其LOD可达2 pg/mL。其后,该课题组[32]利用Zn2+可增强银纳米簇荧光强度的特性进一步提高了上述适配体传感器的检测灵敏度。将其应用于同时检测OTA和AFB1,LOD分别为0.2和0.3 pg/mL。除银纳米簇外,DNA也可引发合成铜纳米簇(Cu nanoclusters,CuNCs)作为荧光信号输出单元。如HE等[33]在竞争反应产生的游离cDNA末端,利用末端转移酶形成延伸的Poly(T)长链,并以其为模板引发生长多个铜纳米簇产生荧光信号。
1.4 表面增强拉曼散射信号传感器
目前利用表面增强拉曼散射(surface enhanced raman scattering,SERS)信号的磁性适配体OTA传感器的检测原理类似,均基于通过适配体和cDNA相互作用制备的磁珠-拉曼信号探针复合物[34-36]。当OTA存在时,信号探针从磁性复合物上脱落,通过测定磁回收后磁性复合物或上清的拉曼信号变化进行定量分析。由于拉曼散射很弱,拉曼分子应用于检测时需要通过化学修饰或置于强电磁场中进行信号放大。贵金属纳米材料表面可形成高强局域电磁场(热点),拉曼信号分子位于其中时,拉曼散射强度可提高106倍,是一种良好的拉曼信号放大方式[37]。ZHAO等[34]通过在表面配位连接有拉曼分子的银纳米粒子表面还原生长金壳层,制备得到拉曼分子位于银核和金壳之间的核壳式拉曼探针(Ag@Au NPs)。由于拉曼信号同时被银、金2种贵金属放大,该探针具有很强的拉曼信号。将该探针应用于磁性适配体传感器同时检测OTA和AFB1,OTA的LOD为6 pg/mL。SHAO等[35]则采用类似方法制备了具有纳米间隙的金核金银壳型核壳式拉曼探针(Au@Au-Ag NPs),并将其与Fe3O4磁性纳米材料联合用于检测OTA,其LOD为4 pg/mL。为进一步提高拉曼信号强度,SONG等[36]以金磁纳米粒子作为磁性材料与Au@Ag型核壳式拉曼探针结合使用。当拉曼探针与金磁粒子形成复合物时,拉曼探针的信号可被金磁材料的金壳层进一步增强。通过测定竞争反应后磁性复合物的拉曼信号变化检测OTA,其LOD降至0.48 pg/mL。
2 电化学传感器
电化学传感器主要通过测量因电极表面发生氧化还原反应引发的电势或电流信号,实现对目标物的检测。其具有操作简便、体积小、信噪比高和检测灵敏度高等优点。近年来基于磁性材料的OTA适配体电化学传感器的相关研究见表2。

表2 基于磁性材料的电化学适配体传感器在OTA检测中的应用概况Table 2 Applications of electrochemical aptasensors basedon magnetic material in ochratoxin A detection
2.1 基于酶标抗原的适配体电化学传感器
与传统的以抗体为特异性识别元件的电化学传感器原理类似,早期基于磁珠的OTA电化学适配体传感器主要是利用酶标抗原和抗原竞争结合磁珠上的适配体,然后将磁珠磁吸至电极表面并依据酶促反应引起的电流信号实现对OTA的检测。BARTHELMEBS等[38]和RHOUATI等[39]利用ALP酶标记的OTA;BONEL等[40]利用HRP酶标记的OTA与待测样品中的OTA竞争结合磁珠表面的适配体,继而通过微分脉冲伏安法检测电信号进行OTA定量分析。上述传感器中微纳米磁珠的使用即可保证免疫竞争反应和酶促反应的高效进行,又可在磁场作用下,方便快速地实现磁性纳米粒子与未结合的酶标抗原及样品基质快速分离,并定位富集至电极表面,且在检测后可通过撤除磁场将磁珠从电极表面移除,从而缩短分析时间、提高检测灵敏度并实现电极的表面快速更新和重复使用。
2.2 基于纳米粒子的电化学传感器
近年来纳米粒子被作为标记物广泛应用于电化学传感器的构建。例如量子点既可提供荧光信号也可产生电化学发光信号用于电化学检测。WANG等[41]构建了一种以cDNA修饰的石墨烯量子点微球和适配体修饰的金磁纳米粒子复合物为检测探针,并基于电化学发光和荧光双重检测信号的OTA适配体传感器。当竞争反应完成,磁分离后上清中游离的量子点微球可产生荧光信号,而磁回收的检测探针经重悬后可磁吸至电极表面,产生电化学发光信号。其中,荧光检测模式较快,其LOD为3 pg/mL;电化学发光模式则更为灵敏,其LOD为0.5 pg/mL。
此外,以纳米粒子为金属离子供体,利用纳米粒子消解产生的离子引发电信号,已被多种基于磁珠的OTA电化学适配体传感器作为信号产生方式。因纳米粒子可消解产生大量金属离子,此类传感器具有很高的检测灵敏度。WANG等[42]用表面荷载CdTe或PbS量子点的硅球分别标记OTA和伏马菌素(fumonisin B1,FB1)适配体,然后将其与cDNA修饰的磁珠结合,制备2种毒素的检测探针。当OTA或FB1存在时,竞争释放的硅球经磁分离后残留在上清中并被HNO3酸解产生Cd2+或Pb2+。然后利用铋修饰的玻碳电极,以方波溶出伏安法(square-wave stripping voltammetry,SWSV)测定2种金属离子产生的电信号,从而实现对OTA和FB1的同时检测,其LOD分别为5和20 pg/mL。由于此类传感器的灵敏度与检测探针中纳米粒子的含量相关,HAO等[43]利用表面荷载大量CdTe量子点的石墨烯/Au纳米复合材料制备检测探针,采用类似的模式和方法实现了对OTA的超灵敏检测,其LOD为0.07 pg/mL。此外,RCA技术也可用于提高此类传感器的检测灵敏度。TONG等[44]设计的检测探针由寡核苷酸链修饰的磁珠、适配体和辅助DNA片段组成。由于辅助DNA片段同时含有与磁珠表面寡核苷酸链以及适配体互补的DNA序列,三者可杂交形成复合物。当OTA存在时,辅助DNA因适配体脱落形成的单链区可与磁珠表面寡核苷酸链的单链部分进一步结合,形成环状辅助DNA-磁珠复合物。在DNA聚合酶作用下,磁珠表面的寡核苷酸链可以环状辅助DNA为RCA模板,扩增形成含大量重复片段的长链核酸。此时加入与重复片段互补配对的且标记有CdS量子点的DNA探针,可使磁珠表面携带大量量子点,从而提高Cd2+电信号强度和检测灵敏度。
2.3 基于电活性分子的适配体电化学传感器
电活性分子,如亚甲基蓝,是一类常用的DNA电化学传感器杂交指示剂。与光学适配体传感器一样,基于核酸酶的核酸反应也可用于DNA电化学传感器的信号放大以提高检测灵敏度。SHI等[45]构建了一种基于双链核酸外切酶III(exonuclease III,Exo III)的OTA适配体电化学传感器,该传感器检测探针由纳米磁珠通过其表面适配体和mDNA杂交而成。当OTA存在时,mDNA被竞争下来并残留在磁吸上清中。用表面修饰cDNA的金电极检测磁吸上清时,与mDNA部分互补的cDNA与mDNA杂交形成双链启动Exo III切割cDNA并释放mDNA。游离mDNA又可与电极表面其他cDNA杂交,并继续引发Exo III切割cDNA。经多次循环后,磁吸上清中微量的竞争反应产物mDNA即可导致金电极上大量cDNA被切割,从而放大反应信号。最后,电极上未被切割的cDNA可与修饰大量报告DNA的金纳米粒子杂交并吸附甲基蓝产生电化学信号。利用该传感器检测OTA,其LOD为5 pg/mL。
3 核酸定量型适配体传感器
由于痕量核酸的定量技术已非常成熟,而适配体传感器的竞争产物是DNA,MODH等[46]开发了一种基于实时荧光定量PCR技术的OTA检测方法。该方法利用cDNA将适配体结合至纳米磁珠表面,竞争反应后通过qPCR技术对磁吸后上清中的游离适配体进行扩增和定量。该OTA传感器具有极宽线性检测范围,可达0.039~1 000 ng/mL,其LOD为9 pg/mL。虽然此类基于核酸定量的检测方法具有检测范围宽、灵敏度高等优点,但其需要昂贵的定量PCR仪、耗时长且检测成本较高。
4 其他
与上述需要大型仪器的检测方法不同,基于廉价的商业化便携式血糖仪的生物传感器价格低廉,可被广泛用于非葡萄糖待测物的低成本现场快速检测[47]。如GU等[48]将蔗糖酶标记的cDNA通过OTA适配体与磁珠结合制备检测探针。当OTA存在时,竞争释放的蔗糖酶-cDNA复合物可催化蔗糖转化为葡萄糖。此时利用血糖仪测定体系中葡萄糖的浓度,即可实现非葡萄糖目标物的间接定量检测。使用该方法检测红酒中的OTA,其LOD为3.66 ng/mL。QIU等[49]则在上述检测探针中的适配体和cDNA末端分别修饰叠氮和炔基官能团,以利用点击化学反应减少cDNA的非特异性释放,从而降低背景信号、提高检测灵敏度,其LOD降至72 pg/mL。该类检测方法简便、快捷且成本低,适用于食品的大规模监测筛查。
5 展望
综上所述,基于磁性纳米材料的OTA适配体传感器多以通过适配体/cDNA结合的纳米磁珠-信号分子复合物作为检测探针。由于纳米磁珠表面积大且可分散在检测体系中,竞争反应可高效进行。同时,通过磁分离可快速分离/富集竞争反应产物或原始检测探针用于信号检测。此外,在电化学传感器中纳米磁珠可方便快速地富集至电极表面,提供并增强检测信号,而通过移除磁珠又可快速更新电极表面,实现电极的重复使用。由于以适配体作为生物识别元件,已报道的稳定性分析表明,OTA适配体传感器具有良好的稳定性和可重复利用性。在提高检测灵敏度方面,随着纳米材料的快速发展,各类新型纳米光学材料、纳米模拟酶和纳米组装体被用于增强基于磁珠的适配体传感器的光/电信号输出。此外,基于适配体传感器中竞争反应产物是DNA分子这一特点,成熟的DNA扩增技术,如RCA技术和PCR技术,以及基于各类核酸酶的新型核酸信号放大策略,均可引入适配体传感器的信号生成或传导体系中,以放大检测信号,提高检测灵敏度。
虽然已有的基于磁性纳米材料的OTA适配体传感器有较高的检测灵敏度,但其仍有可改进之处。例如,现有方法大多需要大型、昂贵的光学、电化学或核酸扩增定量检测设备且设备操作复杂,不适于基层企业或监测部门的大规模现场快速检测。与大型检测仪器相比,智能手机检测平台具有检测设备体积小、便于携带、成本低且可实现实时远程检测等优点,已与多种光学或电化学检测方法联用,用于待测物的分析。而将检测过程集成在微流芯片中进行的微流控检测平台也具有成本低、使用和携带方便及样品用量小等优点。上述检测平台与免疫层析试纸条检测一样,均适于大规模现场即时检测,应将其更多的应用于基于磁性纳米材料的真菌毒素适配体传感器。此外,磁性材料不仅可用于磁分离,亦可作为磁信号探针使用。由于穿透性强,且样品基质一般无磁信号不会形成背景干扰,磁信号在复杂食品样品分析中具有良好的应用前景,且十分适于作为基于磁性纳米材料的真菌毒素适配体传感器的检测信号。

