基于蛋白质组学研究七味清肝散的抗肝纤维化作用及机制
梁洁 孟根斯立木 颜羽昕 金蓉 包小妹 马丽杰 那日苏 苏晓丽 谢敏琦 马月宏

中圖分类号 R285 文献标志码 A 文章编号 1001-0408(2020)11-1294-09
DOI 10.6039/j.issn.1001-0408.2020.11.03
摘 要 目的:探讨七味清肝散的抗肝纤维化(HF)作用,并挖掘其潜在机制。方法:将雄性Wistar大鼠随机分为空白组、HF模型组和七味清肝散低、中、高剂量组[135、270、405 mg/(kg·d),以生药总量计],每组12只。除空白组外,其余各组均灌胃50%四氯化碳花生油溶液(2 mL/kg,每周2次,连续8周)以复制HF模型;与此同时,空白组和HF模型组大鼠均灌胃等容0.5%羧甲基纤维素钠溶液,各给药组大鼠均灌胃相应药物,每日1次,连续8周。观察各组大鼠的一般情况,于末次给药后观察其肝脏形态,并测定肝脏指数;检测大鼠血清肝功能指标[丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)、羟脯氨酸(HYP)]含量以及肝组织中α-平滑肌肌动蛋白(α-SMA)的表达情况,并采用苏木精-伊红染色和Masson染色进行组织病理学观察。采用串联质谱标签(TMT)技术,以蛋白表达量的差异倍数为指标,筛选药物组(合并七味清肝散各剂量组肝组织样品)和HF模型组的差异表达蛋白,并借助Uniprot-GOA数据库以及KAAS、KEGG mapper在线工具等对其进行基因本体(GO)和KEGG通路富集分析。结果:空白组大鼠健康状况好;肝脏呈鲜红色且表面光滑,肝小叶完整,未见变性坏死、炎症细胞浸润或纤维组织增生。与空白组比较,HF模型组大鼠饮食减少、精神萎靡、皮毛杂乱且无光泽;肝脏呈暗红色或黄色,表面粗糙,质地较硬,可见炎症细胞浸润、纤维组织破坏、桥间连接等现象;其肝脏系数、肝功能指标含量和α-SMA的表达水平均显著升高(P<0.05)。与HF模型组比较,七味清肝散各剂量组大鼠上述症状均有不同程度的改善,且低剂量组肝脏系数、高剂量组ALP含量以及各剂量组ALT、AST、HYP含量和α-SMA的表达水平均显著降低(P<0.05)。共筛选出与HF有关的差异表达蛋白42个,其中表达上调15个、表达下调27个,包括脂肪酸结合蛋白4(FABP4)、胆固醇7α-羟化酶(CYP7A1)等。富集分析结果显示,差异表达蛋白主要富集于细胞外空间、血液微粒等细胞部位,涉及氧化还原酶活性、脂肪酸结合等分子功能,异型细胞间黏附的调控、蛋白质活化级联等生物过程以及视黄醇代谢、花生四烯酸代谢、过氧化物酶体增殖物激活受体(PPAR)等信号通路。结论:七味清肝散可降低HF模型大鼠的肝脏系数以及血清中ALT、AST、ALP、HYP含量,下调α-SMA的表达,改善肝组织的炎症及纤维化程度,具有一定的肝保护作用。该方潜在抗HF作用机制可能涉及FABP4、CYP7A1、PPAR等多个靶点和信号通路。
关键词 肝纤维化;七味清肝散;蛋白质组学;串联质谱标签技术;差异表达蛋白;大鼠
ABSTRACT OBJECTIVE: To investigate the anti-hepatic fibrosis (HF) effects of Qiwei qinggan powder and explore its possible mechanism. METHODS: Male Wistar rats were randomly divided into blank group, HF model group, Qiwei qinggan powder low-dose, medium-dose and high-dose groups [135, 270, 405 mg/(kg·d),by total amount of crude drugs], with 12 rats in each group. Except for blank group, other groups were given 50% CCl4-peanut oil solution intragastrically (2 mL/kg, twice a week, for consecutive 8 weeks) to induce HF model. At same time, blank group and model group were given constant volume of 0.5% CMC-Na solution intragastrically; administration groups were given relevant medicine intragastrically, once a day, for consecutive 8 weeks. General situation of rats were observed, and liver morphology was observed after last administration and hepatic indexes were detected. The contents of liver function indexes (ALT, AST, ALP, HYP) in serum and the expression of α-SMA in hepatic tissue were determined, and HE and Masson staining were performed to observe the histopathology. Using the difference multiple of expression quantity as the index, TMT technology was used to screen the differentially expressed protein in medicine group (combining the liver tissue samples of Qiwei qinggan powder groups) and HF model group. Uniprot-GOA database and KAAS, KEGG mapper online tools were used to analyze GO and KEGG pathway enrichment. RESULTS: The rats in the blank group were in good health; the liver was bright red and smooth, the liver lobules were intact, no degeneration and necrosis, inflammatory cell infiltration or fibrous tissue proliferation was found. Compared with blank group, the rats in HF model group had poor diet, depressed spirit, disordered and lusterless fur; the liver was dark red or yellow with rough surface, hard texture, inflammatory cell infiltration, fiber tissue destruction, bridge connection and so on; the hepatic index, the contents of liver function indexes and the expression of α-SMA were increased significantly (P<0.05). Compared with HF model group, above symptoms of rats were improved to different extent in different dose groups of Qiwei qinggan powder; hepatic index in Qiwei qinggan powder low-dose group, the content of ALP in high-dose group, the contents of ALT, AST and HYP and the expression of α-SMA in different dose groups were decreased significantly (P<0.05). A total of 42 differentially expressed proteins related to HF were screened, of which 15 were up-regulated and 27 were down-regulated in expression, including fatty acid binding protein 4 (FABP4), cholesterol 7α-hydroxylase (CYP7A1). The results of enrichment analysis showed that the differentially expressed proteins were mainly enriched in extracellular space, blood particles and other cell parts, involving the molecular functions of oxidoreductase activity and fatty acid binding, the biological processes of the regulation of heterotypic cell adhesion, protein activation cascade, as well as retinol metabolism, arachidonic acid metabolism, PPAR and other signal pathway. CONCLUSIONS: Qiwei qinggan powder can reduce the hepatic index, ALT, AST, ALP and HYP contents in serum, down-regulate the expression of α-SMA, improve the degree of inflammation and fibrosis of liver tissue, and have a certain protective effect on rats. The anti-HF mechanism of it involves multiple targets and signal pathways, such as FABP4, CYP7A1 and PPAR.
KEYWORDS Hepatic fibrosis; Qiwei qinggan powder; Proteomics; TMT technology; Differentially expressed proteins; Rats
肝纤维化(Hepatic fibrosis,HF)是一种慢性的肝损伤疾病,主要发病原因包括病毒性肝炎、酒精肝、脂肪肝、寄生虫感染、化学毒物侵害、自身免疫性疾病等[1-3]。被损伤的肝脏细胞可分泌多种炎症细胞因子,后者可激活肝星状细胞(HSC),活化的HSC可合成分泌大量的以胶原纤维为主的细胞外基质(ECM)。在此过程中,ECM的暂时增生有利于肝脏的自我修复;活化的HSC可转化为成纤维细胞进而形成多能干细胞,进而分化成肝细胞,最终有利于肝脏的重塑[4-6]。由此可见,上述过程是肝脏损伤自我修复的一种保护机制。然而,当损伤长期累积,ECM将会大量聚集,造成肝硬化、肝癌等严重后果,严重危害人体健康[7-8]。有数据显示,HF的发病率在全世界范围内呈上升趋势;而且有研究表明,在排除了发病原因(如饮酒)之后,HF仍可继续进展,最终导致不良后果[9]。目前,用于治疗HF的药物大多价格昂贵且毒副作用大,临床应用受限。
蒙药七味清肝散由蓝盆花、红花、人工牛黄、石膏、香青兰、瞿麦、五灵脂等药材组成,临床可用于治疗肝热目赤、黄疸、肝区疼痛、发烧口渴、头痛等症[10]。方中,蓝盆花具有甘、涩、钝、燥、腻、重、凉等性味,可清热、清“协日”、泻火,主要用于治疗肺热、肝热、咽喉热等疾病;红花味辛、性温,入心、肝、肾经,具有清肝热的作用;牛黄可用于解热、解毒、定惊,具有清热凉肝、息风止痉的功效;石膏性凉,有清热解毒的功效;香青兰具有清胃肝热、止血的作用;瞿麦可清热解毒;五灵脂具有活血散瘀的功效;诸药合用,共奏清肝热之效[10]。本课题组前期已通过动物实验证实了七味清肝散具有抗HF的作用[11]。为进一步证明该方是通过多靶点的协同和/或竞争作用来治疗HF,本研究拟利用蛋白质组学的方法对其作用机制及靶点进行预测分析,旨在为后续该方抗HF相关的转录组学、代谢组学的深入研究奠定基础。
1 材料
1.1 仪器
ELx800型酶标仪(美国BioTek公司);725型紫外分光光度计(日本Shimadzu公司);BX51型显微镜(日本Olympus公司);Odyssey型红外激光成像系统(美国LI-COR公司);EASY-nLC 1000型超高效液相系统、Orbitrap Fusion Lumos型三合一质谱系统(美国Thermo Fisher Scientific公司);SM2010R型切片机(德国Leica公司);3K15型高速冷冻离心机(美国Sigma公司);BS2202S型电子分析天平[塞多利斯科学仪器(北京)有限公司];HH-6型数显恒温水浴锅(常州国华电器有限公司)。
1.2 药品与试剂
蓝盆花(批号:171219,产地:内蒙古)、红花(批号:171103,产地:新疆)、瞿麦(批号:170910,产地:内蒙古)、香青兰(批号171109,产地:内蒙古)、五灵脂(批号:171215,产地:河北)、人工牛黄(批号:171030,产地:甘肃)、石膏(批号:171217,产地:河北)等药材均购自内蒙古天盛蒙中医有限责任公司,由内蒙古医科大学蒙医药学院蒙药炮制实验中心主任呼日乐巴根副教授鉴定为真品。除人工牛黄外,其余药材均经粉碎后过100目筛,再加入人工牛黄,混合均匀(组方药材量分别为红花180 g、香青兰60 g、蓝盆花60 g、人工牛黄80 g、瞿麦60 g、石膏180 g、五灵脂60 g)。临用前,以0.5%羧甲基纤维素钠(CMC-Na)溶液配制成质量浓度为30 mg/mL(以生药总量计,下同)的混悬液。
水合氯醛(天津福晨化学试剂厂,批号:20141007);花生油(山东鲁花集团,批号:20171209);四氯化碳(CCl4,国药集团化学试剂有限公司,批号:20140319;临用前,用灭菌花生油配制成溶液);羟脯氨酸(HYP)、丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、碱性磷酸酶(ALP)测定试剂盒(南京建成生物工程研究所,批号分别为20180523、20180429、20180421、20180428);苏木精-伊红(HE)染色试剂盒、Masson三色染色试剂盒、RIPA裂解液、苯甲基磺酰氟(PMSF)、5×蛋白上样缓冲液(北京索莱宝科技有限公司,批号分别为20180927、20181001、20190420、20190426、20190509);BCA蛋白浓度测定試剂盒、封闭液(上海碧云天生物技术有限公司,批号分别为122118190507、20190412);兔抗大鼠α-平滑肌肌动蛋白(α-SMA)抗体、兔抗大鼠甘油醛-3-磷酸脱氢酶(GAPDH)抗体(武汉三鹰生物技术有限公司,批号分别为00075696、00075847);Dylight 800标记的山羊抗兔免疫球蛋白G(IgG)二抗(美国Abbkine公司,批号:ATSMR2201);串联质谱标签(TMT)相对定量蛋白质组试剂盒(美国Thermo Fisher Scientific公司,批号:TF266292);胰酶(美国Proemga公司,批号:121652);碘代乙酰胺、二硫苏糖醇、尿素、三乙基碳酸氢铵(TEAB)(美国Sigma公司,批号分别为WXBC4645V、SLBM4127V、WXBC8002V、BCBX4134);乙腈、三氟乙酸、甲酸等为色谱纯,其余试剂均为分析纯,水为超纯水。
1.3 动物
清洁级Wistar大鼠50只,雄性,8周龄,体质量190~220 g,购自北京维通利华实验动物技术有限公司,动物生产许可证号:SCXK(京)2016-0006。所有动物均饲养于内蒙古医科大学实验动物中心,室温18~22 ℃。大鼠自由进食、饮水,适应性饲养1周后进行后续实验。
2 方法
2.1 分组、造模与给药
将大鼠随机分为5组,即空白组、HF模型组以及七味清肝散低、中、高剂量组[135、270、405 mg/(kg·d),以生药总量计;该药成人临床剂量为1.5~3 g/d,各组给药剂量根据种属间剂量折算表并按成人最低剂量的1、2、3倍换算而得],每组12只。造模方法和干预周期参考相关文献[12]:除空白组外,其余各组大鼠均灌胃50%CCl4花生油溶液2 mL/kg以复制HF模型,每周2次,连续8周。造模同时,空白组和HF模型组大鼠均灌胃等容0.5%CMC-Na溶液,各给药组大鼠灌胃相应药物,每日1次,连续8周。第8周末,随机处死除空白组外的其余组大鼠各2只,通过病理检查判断造模成功[12]。
2.2 大鼠肝纖维化相关现象观察及指标检测
2.2.1 一般情况 在研究过程中,每周称定大鼠体质量1次,并密切观察其每日饮食、饮水以及毛发、精神状态等一般情况。
2.2.2 样品采集 于末次给药后,大鼠(每组10只,下同)禁食、不禁水12 h,然后腹腔注射10%水合氯醛溶液进行麻醉,经腹主动脉取血适量,静置20 min后,于4 ℃下以3 500 r/min离心10 min,分离血清。取血后处死大鼠,取出肝脏,分离肝组织适量,备用。
2.2.3 肝功能指标检测 采用赖氏法以紫外分光光度计检测血清中ALT、AST含量,采用比色法以紫外分光光度计检测血清中ALP含量,采用酸水解法以紫外分光光度计检测肝组织中HYP的含量,均严格按照相应试剂盒说明书操作。
2.2.4 肝组织形态学观察 观察肝脏外观及软硬度;肝脏经磷酸盐缓冲液(PBS,pH为7.2~7.4)清洗后,称定质量,并计算其与体质量的比值(即肝脏系数)。取肝组织适量,于4%甲醛溶液中固定48 h,经脱水、石蜡包埋、切片(厚度约4~5 μm)后,以HE和Masson三色染色试剂染色,置于显微镜下观察(HF组织经HE染色后可见肝板排列混乱、炎症细胞浸润、气球样变、桥间连接等现象,经Masson染色后则可见纤维组织增生)。
2.2.5 肝组织中α-SMA的表达情况 采用Western blotting法检测α-SMA的表达水平。取大鼠肝组织适量,使用RIPA裂解液裂解肝组织提取总蛋白后,采用BCA法检测蛋白含量。然后加入5×蛋白上样缓冲液适量,于95 ℃下变性8 min,取变性蛋白50 μg,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳。电泳后以湿法转膜,用封闭液室温封闭10 min,加入相应一抗(稀释度均为 1 ∶ 5 000),于4 ℃孵育过夜;洗膜后,加入相应二抗(稀释度为1 ∶ 2 500),室温孵育1 h;洗膜后,置于红外激光成像系统上扫描。使用Image Studio ver 3.1软件进行分析,以目标蛋白与内参蛋白(GAPDH)条带灰度值的比值来表示目标蛋白的表达水平。
2.3 差异表达蛋白的筛选
从七味清肝散各剂量组中随机抽取1个肝组织样品,混合,作为药物组进行后续试验。称取HF模型组和药物组肝组织样品适量至液氮预冷的研钵中,加液氮充分研磨至粉状,均分别加入4倍量(μL/μg)的8 mol/L 尿素溶液,超声(每超声3 s停5 s)裂解3 min,于4 ℃下以1 200 r/min离心10 min,去除细胞碎片。将上清液转移至另一离心管中,采用BCA法测定蛋白含量。于蛋白样品溶液中加入二硫苏糖醇使后者终浓度为5 mmol/L,于56 ℃还原30 min;加入碘代乙酰胺适量,室温避光孵育15 min。按质量比1 ∶ 50加入胰酶,于37 ℃酶解过夜;再按质量比1 ∶ 100加入胰酶,继续同条件再次酶解4 h。经酶解后的肽段用Strata X C18除盐柱除盐后,真空冷冻干燥。以0.5 mol/L TEAB溶液溶解肽段,根据TMT相对定量蛋白质组试剂盒说明书方法标记肽段。肽段经0.1%甲酸水溶液溶解后,使用超高效液相系统进行分离[色谱柱为Reprosil-Pur C18(200 mm×0.1 mm,1.9 μm),流动相为含0.1%甲酸和2%乙腈的水溶液(A)-含0.1%甲酸和10%水的乙腈溶液(B),梯度洗脱(0~42 min,6%B→22%B;42~54 min,22%B→30%B;54~57 min,30%B→80%B;57~60 min,80%B),流速为500 mL/min,柱温为50 ℃,进样量为1 μg],然后再使用质谱系统进行分析[电离源为纳升级电喷雾电离源(NSI),电压为2.4 kV;一级质谱扫描范围为m/z 350~1 550,扫描分辨率为60 000;二级质谱扫描范围则固定起点为m/z 100,扫描分辨率为17 500]。采用MaxQuant v1.5.2.8软件进行定量分析并对肽段定量值作归一化处理,筛选蛋白表达量(即对应肽段的信号强度)差异倍数>1.2且P<0.05的蛋白作为差异表达蛋白。上述试验由杭州景杰生物科技有限公司完成。
2.4 生物信息学分析
采用MaxQuant v1.5.2.8软件进行差异表达蛋白的质谱数据检索与解析;借助Uniprot-GOA数据库(http://www.ebi.ac.uk/GOA/downloads)对差异表达蛋白进行基因本体(GO)分析(包括GO注释和GO富集),使用Wolfpsort V0.2软件对上述蛋白进行亚细胞定位注释;使用KAAS在线服务工具(http://www.genome.jp/kaas-bin/kaas_main)对差异表达蛋白进行注释,通过KEGG mapper在线工具(http://www.kegg.jp/kegg/mapper.html)对通路进行匹配。富集分析采用Perl module方法,以P<0.05为显著富集。
2.5 统计学方法
采用SPSS 24.0软件对数据进行统计分析。数据以x±s表示,多组间比较采用单因素方差分析,组间两两比较采用LSD检验。P<0.05为差异有统计学意义。
3 结果
3.1 七味清肝散对大鼠HF的抑制作用
3.1.1 一般情况 空白组大鼠健康状况良好,饮食、饮水正常,行动敏捷,体质量自然增长,毛色有光泽,大便成形。HF模型组大鼠饮食减少,行动迟缓,精神萎靡,体质量有所下降,皮毛杂乱且无光泽,有时可见大便不成形。七味清肝散各剂量组大鼠状态介于空白组和HF模型组之间。
3.1.2 肝脏形态 空白组大鼠肝脏呈鲜红色,表面光滑,无粗糙感或颗粒感,且质地柔软。HF模型组大鼠肝脏呈暗红色甚至黄色,表面粗糙,有明显的颗粒感,质地较硬。七味清肝散各剂量组大鼠肝脏呈暗红色,表面略粗糙,但無明显颗粒感,整体状态介于空白组和HF模型组之间。
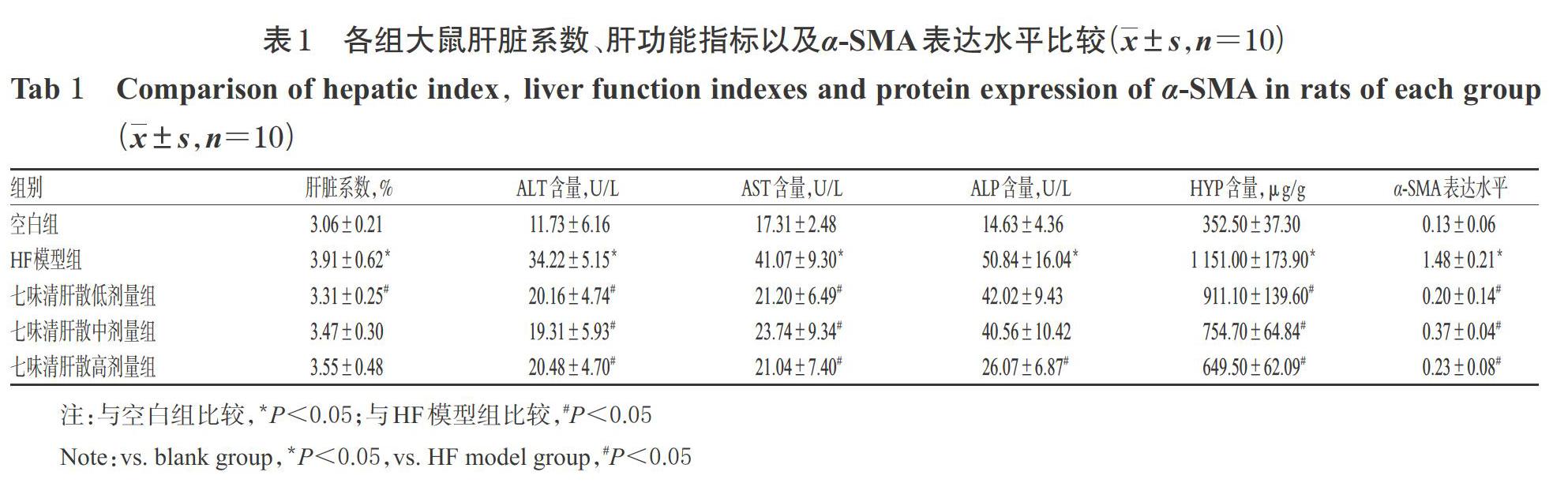
3.1.3 肝脏指数和肝功能指标 与空白组比较,HF模型组大鼠肝脏系数以及肝功能指标(ALT、AST、ALP、HYP)含量均显著升高(P<0.05)。与HF模型组比较,七味清肝散各剂量组大鼠ALT、AST、HYP含量,低剂量组肝脏系数以及高剂量组ALP含量均显著降低(P<0.05),详见表1。
3.1.4 肝脏纤维形态 空白组大鼠肝小叶结构完整,肝板排列整齐,包浆均匀,未见变性坏死、炎症细胞浸润或纤维组织增生。HF模型组大鼠肝小叶结构被破坏,肝板排列混乱,肝组织可见大量炎症细胞浸润、肝细胞气球样变、纤维组织增生,个别样本甚至出现桥间连接以及假小叶。七味清肝散各剂量组大鼠肝组织纤维增生减少,炎症细胞浸润减少,细胞变性、坏死减少,详见图1、图2。
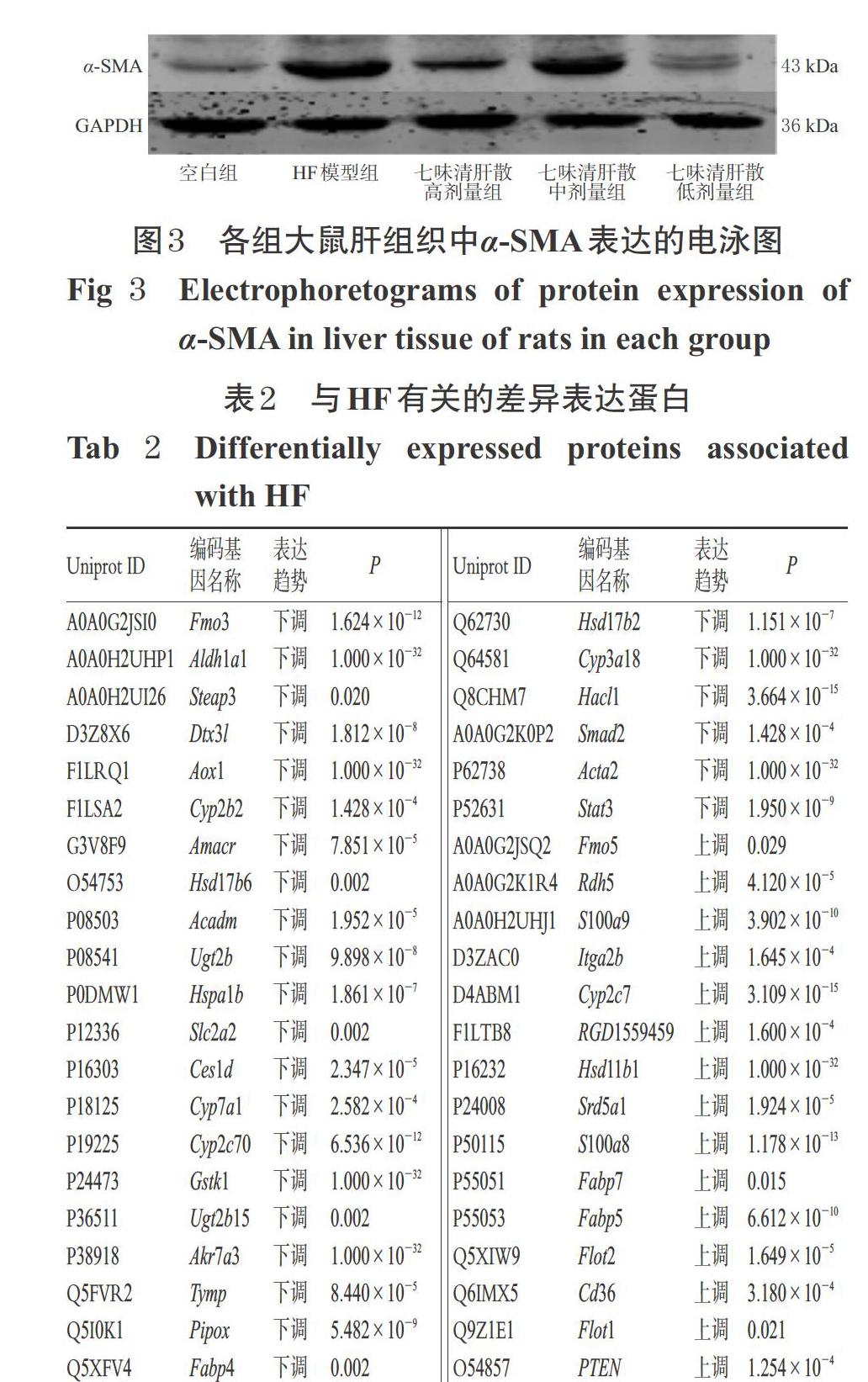
3.1.5 α-SMA表达 与空白组比较,HF模型组大鼠肝组织中α-SMA的表达水平显著升高(P<0.05);与HF模型组比较,七味清肝散各剂量组大鼠肝组织中α-SMA的表达水平均显著降低(P<0.05),详见图3、表1。
3.2 差异表达蛋白分析结果
经质谱数据解析,共鉴定出药物组表达蛋白5 013个,HF模型组表达蛋白5 012个;两组差异表达蛋白有146个,其中表达上调82个、表达下调64个;经查阅中国知网、万方数据、PubMed等数据库中的相关文献发现,其中有42个差异表达蛋白与HF有关(表达上调15个、表达下调27个),详见表2。
3.3 生物学功能分析结果
3.3.1 差异表达蛋白GO注释 GO注释内容主要包括生物过程、细胞组分和分子功能。结果显示,生物过程以参与单一生物体过程、代谢过程、细胞进程为主,分别富集差异表达蛋白97、86、83个;细胞成分以细胞、细胞器、膜为主,分别富集差异表达蛋白96、77、51个;分子功能以结合、催化活性为主,分别富集差异表达蛋白91、76个,详见图4。亚细胞定位分析结果显示,差异表达蛋白主要分布于细胞质(定位比例为29.45%,即某生物学功能项下差异表达蛋白占所有注释到该生物学功能的蛋白总数的比例,下同)、细胞外区(27.4%)和细胞膜(10.96%),详见图5。
3.3.2 差异表达蛋白富集分析 将差异表达蛋白在GO、KEGG通路这两个方面均进行富集分析,得到了GO一级分类描述下的三大类(即生物过程、分子功能、细胞组分)富集结果以及KEGG通路富集结果,分别见图6、图7(图中,条形图越长,则表示差异表达蛋白在该分类或功能上的富集越显著)。
GO富集结果显示,差异表达蛋白在细胞外空间、血液微粒、内质网部分等细胞组分,在氧化还原酶活性、脂肪酸结合、单羧酸结合等分子功能,以及在异型细胞间黏附的调控、蛋白质活化级联、调节血管大小等生物过程上显著富集。
KEGG通路富集结果显示,差异表达蛋白主要富集于类固醇激素的生物合成、视黄醇代谢、组氨酸代谢、花生四烯酸代谢、细胞色素P450代谢外源物质和过氧化物酶体增殖物激活受体(PPAR)等信号通路(P<0.05)。其中,视黄醇代谢、花生四烯酸代谢和PPAR信号通路与HF有关[13-14],且PPAR信号通路中富集到了经七味清肝散作用后下调的脂肪酸结合蛋白4(FABP4)和胆固醇7α-羟化酶(CYP7A1),二者亦与HF密切相关[15-17]。
4 讨论
七味清肝散是蒙医的经典名方,常被用于治疗各种肝脏疾病[10]。本课题组前期研究已经明确了七味清肝散的抗HF作用[11],所以本研究将重点放在了该方多靶点、多机制治疗HF的潜在靶点上。同时,由于目前尚缺乏疗效确切的HF治疗药物,加之民族医学与中医理论体系也有所差异,故本研究暂未设置阳性对照组。蒙药及其方剂成分复杂多样,因缺乏合理的方法对其作用靶点及机制进行深入探讨[18-19],使得蒙药的发展受到一定限制。随着蛋白质组学等技术的发展,通过对比药物组与模型组相关蛋白表达的变化,并以此进行潜在作用靶点的挖掘,可为科学阐释蒙药的作用机制提供新的思路。近年来,蛋白质组学相关技术已广泛应用于蒙药机制研究等领域中[20-21]。鉴于此,本课题组在进一步证实七味清肝散对HF模型大鼠保护作用的基础上,结合TMT技术初步分析了该方治疗HF的潜在靶点及机制,旨在为其深入研究提供参考。
HF是肝脏疾病发展过程中的重要节点,正确认识并及时治疗可有效控制该病的发展。有文献报道,CCl4可导致肝脏炎症以及纤维化的发生,并伴随肝细胞的变性、坏死、破裂,进而使存在于肝细胞内的酶(ALT、AST、ALP)进入到血清中,故血清肝酶含量可反映肝细胞受损程度[22]。此外,HYP是胶原蛋白中特征性的氨基酸成分,在HF发生时显著升高,可作为肝功能的评价指标之一[23]。除上述指标外,病理切片亦有助于更准确地判断肝脏病变的程度。其中,HE染色可用以观察炎症细胞浸润、气球样变、假小叶等病理状态;Masson染色则可直观反映肝组织中胶原纤维的生成情况,从而判断HF的进展程度。因此,本研究在测定肝脏指数的基础上,选择了ALT、AST、ALP、HYP等肝功能指标以及HE、Masson染色病理切片以评价七味清肝散对HF模型大鼠的保护作用。结果显示,与空白组比较,HF模型组大鼠肝脏偏硬且触摸有颗粒感,肝脏系数和血清中ALT、AST、ALP、HYP含量均显著升高;病理切片可见炎症细胞浸润、假小叶形成、桥间连接以及纤维组织增生等现象。与HF模型组比较,七味清肝散各剂量组大鼠肝组织病变均有不同程度的减轻,各剂量组大鼠血清ALT、AST、HYP含量和低剂量组肝脏系数、高剂量组ALP含量均显著降低。这提示七味清肝散可减轻HF模型大鼠的肝脏损伤和纤维化程度。
HSC激活是HF病理过程的中心环节,而α-SMA是HSC激活的标志物;HSC激活后,α-SMA呈高表达,会进一步造成ECM合成增多、堆积,最终引发HF[24]。本研究结果显示,与空白组比较,HF模型组大鼠肝组织中α-SMA的表达水平显著升高;与HF模型组比较,七味清肝散各剂量组大鼠肝组织中α-SMA的表达水平均显著降低。这提示该方可通过下调α-SMA的表达来抑制HSC的活化,从而发挥抑制HF的作用。上述结果与相关研究[11]基本一致。
本研究利用TMT技术共筛选出药物组和HF模型组间的差异表达蛋白146个,其中与HF相关的有42个。已有研究证实,磷酸酶与张力蛋白同源物(PTEN)与HF相关:PTEN可负性调控活化HSC的细胞周期、抑制活化HSC增殖、诱导活化HSC凋亡、抑制活化HSC的胶原合成,與HF的发生、发展密切相关[25-26]。视黄醇脱氢酶(RDH)是视黄醇合成的关键酶,其表达下调可导致宫颈癌细胞增殖;转染RDH后,宫颈癌细胞的迁移和侵袭能力均下降[27]。虽然目前并无研究报道RDH与HF的相关性,但RDH位于视黄醇代谢信号通路的重要节点,且视黄醇与肝脏受损密切相关,如肝脏受损可影响视黄醇的代谢[13];视黄醇可影响储脂细胞(如HSC)中的胶原纤维产生及向成纤维细胞转化[28];过量视黄醇可导致多种形式的肝脏损害[29];视黄醇缺乏可能与肝癌发生有关[30]等。本研究结果显示,与HF模型组比较,七味清肝散组PTEN、RDH蛋白的表达均显著上调(P<0.001)。这提示PTEN、RDH可能是治疗HF的靶点之一。后续本课题组将以此入手,继续研究七味清肝散抗HF的作用机制。
为了进一步明确七味清肝散治疗HF的潜在靶点和机制,本研究进一步运用蛋白质组学的方法进行分析。GO数据库能够对不同数据库中关于基因和基因产物的生物学术语进行标准化,对基因和蛋白功能进行统一的限定和描述,也就是说,GO数据库可给每个基因贴上“标签”,以便研究者能够通过此标签快速寻找到目标基因,并针对某类GO生物学功能进行快速分析[31]。通过GO注释及亚细胞结构定位,笔者发现七味清肝散治疗HF时的作用靶点主要在细胞内,位于细胞质、细胞外基质,有结合、催化和转录活性,参与单一生物体过程、代谢过程以及细胞进程相关生物过程。从富集结果来看,七味清肝散改善HF最主要是通过一些位于细胞外空间且具有氧化还原酶活性、脂肪酸结合等分子功能以及可参与细胞间黏附、蛋白质活化级联等生物过程的蛋白来发挥作用。
HF主要表现为ECM调控失调及异常沉积,影响正常肝脏功能[32]。这一过程涉及多个信号通路,例如转化生长因子β/Smad、整合素、细胞外因子/β-联蛋白、以及Rho相关卷曲螺旋形成蛋白激酶(Rho-ROCK)信号通路[33-36]。本研究也富集到一些与HF相关的信号通路,如视黄醇代谢、花生四烯酸代谢、PPAR信号通路等。有研究指出,肝脏是花生四烯酸代谢物产生、发挥作用及失活的重要场所[14]。当肝脏受损时,花生四烯酸代谢过程势必会受到影响,提示该代谢通路可能成为七味清肝散治疗HF的靶点。PPAR信号通路可参与HSC活化及其向成纤维细胞转化的过程,也参与了HF的发展[37-38]。本研究挖掘到了该通路上富集的FABP4和CYP7A1。其中,FABP4是脂结合蛋白家族中的一员,在脂质代谢中起着至关重要的作用[39]。临床研究显示,FABP4表达于肝纤维化、肝硬化组织,且随着HF程度加重而增多[15];也有研究证实,FABP4在慢性丙型肝炎病毒致肝病患者体内的表达升高,但经抗病毒药物治疗后,其表达量有所降低,提示该蛋白可能与肝损伤过程有关[16]。CYP7A1是胆汁酸合成的关键限速酶,可调节体内胆汁酸的平衡[40]。CYP7A1表达升高后,机体胆汁酸合成过多,造成肝内胆汁淤积、ECM合成增多,最终引发HF[17]。本研究发现,FABP4、CYP7A1蛋白均显著下调,提示七味清肝散抑制HF可能是通过上述靶点来实现的。
综上所述,七味清肝散可降低HF模型大鼠的肝脏系数以及血清中ALT、AST、ALP、HYP含量,下调α-SMA的表达,改善肝组织的炎症及纤维化程度,对其具有一定的保护作用。药物组和HF模型组间的差异表达蛋白主要位于细胞外空间,富集于氧化还原酶活性、脂肪酸结合等分子功能,异型细胞间黏附的调控、蛋白质活化级联等生物过程以及视黄醇代谢、花生四烯酸代谢、PPAR等信号通路上。上述蛋白及通路可能是该方治疗HF的重要靶点,也体现了该方抗HF的多靶点作用特点。本课题组后续将借助液质联用等技术分析七味清肝散整方及入血成分,通过网络药理学和反向分子对接等手段深入挖掘各组分的作用靶标;同时,拟联合转录组学、代谢组学等手段进一步探讨该方抗HF的具体机制,为该方的应用提供理论基础。
参考文献
[ 1 ] LACHENMEIER DW,MONAKHOVA YB,REHM J. Influence of unrecorded alcohol consumption on liver cirrhosis mortality[J]. World J Gastroenterol,2014,20(23):7217-7222.
[ 2 ] LIN J,WU JF,ZHANG Q,et al. Virus-related liver cirrhosis:molecular basis and therapeutic options[J]. World J Gastroenterol,2014,20(21):6457-6469.
[ 3 ] OKAZAKI I,NORO T,TSUTSUI N,et al. Fibrogenesis and carcinogenesis in nonalcoholic steatohepatitis(NASH):involvement of matrix metalloproteinases (MMPs) and tissue inhibitors of metalloproteinase (TIMPs)[J]. Cancers,2014,6(3):1220-1255.
[ 4 ] YILMAZ Y,EREN F. Serum biomarkers of fibrosis and extracellular matrix remodeling in patients with nonalcoholic fatty liver disease:association with liver histology[J]. Eur J Gastroenterol Hepatol,2019,31(1):43-46.
[ 5 ] XIE G,GAMZE K,MARZENA SS,et al. Cross-talk between Notch and Hedgehog regulates hepatic stellate cell fate in mice[J]. Hepatology,2013,58(5):1801-1813.
[ 6 ] WANG S,LEE Y,KIM J,et al. Potential role of Hedgehog pathway in liver response to radiation[J]. PLoS One,2013. DOI:10.1371/journal.pone.0074141.
[ 7 ] LUCKEY SW,PETERSEN DR. Activation of Kupffer cells during the course of carbon tetrachloride induced liver injury and fibrosis in rats[J]. Exp Mol Pathol,2001,71(3):226-240.
[ 8 ] HEYMANN F,TRAUTWEIN C,TACKE F. Monocytes and macrophages as cellular targets in liver fibrosis[J]. Inflamm Allergy Drug Targets,2009,8(4):307-318.
[ 9 ] 高強,李旭光,樊莉,等.肝纤维化发病机制的研究进展[J].现代生物医学进展,2017,17(14):2677、2780-2785.
[10] 白清云,苏荣扎布,苏和毕力格,等.中国医学百科全书:蒙医学[M].上海:上海科学技术出版社,1992:269.
[11] 马月宏,段申,金蓉,等.蒙药额力根-7抗大鼠肝纤维化作用研究[J].内蒙古大学学报(自然科学版),2016,47(5):526-532.
[12] 魏伟,吴希美,李元建.药理实验方法学[M]. 4版.北京:人民卫生出版社,2010:1137-1138、1698.
[13] SAEED A,DULLAART RPF,SCHREUDER TCMA, et al. Disturbed vitamin A metabolism in non-alcoholic fatty liver disease (NAFLD)[J]. Nutrients,2017. DOI:10.3390/nu10010029.
[14] 陈龙,毛鑫智.花生四烯酸代谢物与肝损伤[J].中国病理生理杂志,1999,15(12):1149-1152.
[15] 万世卿. CB1和FABP4在乙肝纤维化、肝硬化和肝细胞肝癌的表达及意义[D].石家庄:河北医科大学,2013.
[16] GORIN JB,MALONE DFG,STRUNZ B,et al. Plasma FABP4 is associated with liver disease recovery during treatment-induced clearance of chronic HCV infection[J]. Sci Rep,2020. DOI:10.1038/s41598-020-58768-z.
[17] GERMANI G,BURROUGHS AK,DHILLON AP. The relationship between liver disease stage and liver fibrosis:a tangled web[J]. Histopathology,2010,57(6):773-784.
[18] ZHANG CY,YUAN WG,HE P,et al. Liver fibrosis and hepatic stellate cells:etiology,pathological hallmarks and therapeutic targets[J]. World J Gastroenterol,2016,22(48):10512-10522.
[19] 敖特根.浅谈蒙医肝包如病[J].中国民族民间医药,2011,20(17):7.
[20] DONG S,CAI FF,CHEN QL,et al. Chinese herbal formula Fuzheng Huayu alleviates CCl4-induced liver fibrosis in rats:a transcriptomic and proteomic analysis[J]. Acta Pharmacol Sin,2018,39(6):930-941.
[21] ZHANG Z,WANG W,JIN L,et al. iTRAQ-based quantitative proteomics analysis of the protetive effect of Yinchenwuling powder on hyperlipidemic rats[J]. Evid Based Complement Alternat Med,2017. DOI:10.1155/2017/3275096.
[22] ABDEL-MONEIM AM,AL-KAHTANI MA,EL-KERSH MA,et al. Free radical-scavenging,anti-inflammatory/anti-fibrotic and hepatoprotective actions of taurine and silymarin against CCl4 induced rat liver damage[J]. PLoS One,2015. DOI:10.1371/journal.pone.0144509.
[23] 聂珍贵,王姝,王世全,等.和肝汤对四氯化碳致小鼠肝纤维化的防治作用[J].时珍国医国药,2018,29(8):1828- 1830.
[24] HIGASHI T,FRIEDMAN SL,HOSHIDA Y. Hepatic stellate cells as key target in liver fibrosis[J]. Adv Drug Deliv Rev,2017. DOI:10.1016/j.addr.2017.05.007.
[25] ZHANG Z,WEN H,WENG J,et al. Silencing of EPCAM suppresses hepatic fibrosis and hepatic stellate cell proliferation in mice with alcoholic hepatitis via the PI3K/Akt/mTOR signaling pathway[J]. Cell Cycle,2019,18(18):2239-2254.
[26] ZHANG C,AN R,BAO YW,et al. Inhibitory effects of octreotide on the progression of hepatic fibrosis via the regulation of Bcl-2/Bax and PI3K/Akt signaling pathways[J]. Int Immunopharmacol,2019. DOI:10.1016/j.intimp. 2019.05.055.
[27] 刘鹏飞,陈纳泽,向阳.视黄醇代谢相关基因LRAT和RDH12在宫颈鳞癌细胞系中的抗肿瘤作用[J].现代妇产科进展,2018,27(1):9-13.
[28] MA Y,BELYAEVA OV,BROWN PM,et al. 17-beta hydroxysteroid dehydrogenase 13 is a hepatic retinol dehydrogenase associated with histological features of nonalcoholic fatty liver disease[J]. Hepatology,2019,69(4):1504-1519.
[29] WANG L,DING C,ZENG F,et al. Low levels of serum β-carotene and β-carotene/retinol ratio are associated with histological severity in nonalcoholic fatty liver disease patients[J]. Ann Nutr Metab,2019,74(2):156-164.
[30] TAN L,MENG Y,ZENG T,et al. Clinical diagnostic significance of prealbumin,cholinesterase and retinol binding protein in liver cirrhosis combined with encephalopathy[J]. Br J Biomed Sci,2019,76(1):24-28.
[31] TATUSOV RL,GALPERIN MY,NATALE DA,et al. The COG database:a tool for genome-scale analysis of protein functions and evolution[J]. Nucleic Acids Res,2000,28(1):33-36.
[32] ASRANI SK,LARSON JJ,YAWN B,et al. Underestimation of liver-related mortality in the United States[J]. Gastroenterology,2013,145(2):375-382.
[33] TSOU PS,HAAK AJ,KHANNA D,et al. Cellular mechanisms of tissue fibrosis:8:current and future drug targets in fibrosis:focus on Rho GTPase-regulated gene transcription[J]. Am J Physiol Cell Physiol,2014,307(1):C2-C13.
[34] 戴琦,罗勇兵,李梦乔,等.益气活血利水汤抑制慢性肝纤维化大鼠肝脏Wnt/β-catenin信号通路[J].基因组学与应用生物学,2018,37(4):1697-1704.
[35] FABREGAT I,CABALLERO-D?AZ D. Transforming gr- owth factor-β-induced cell plasticity in liver fibrosis and hepatocarcinogenesis[J]. Front Oncol,2018. DOI:10.3389/ fonc.2018.00357.
[36] 梁洁,孟根斯立木,金蓉,等. Rho-ROCK信号通路在肝纤维化形成过程中的作用[J].生命的化学,2019,39(3):568-574.
[37] 张扬武,罗伟生,陈姗,等.枇杷叶熊果酸对大鼠肝星状细胞增殖抑制作用及对PPAR-γ、TGF-β1表达的影响[J].中国药理学通报,2017,33(4):517-521.
[38] GHOSH AK,WEI J,WU M,et al. Constitutive Smad signaling and Smad-dependent collagen gene expression in mouse embryonic fibroblasts lacking peroxisome proliferator-activated receptor-gamma[J]. Biochem Biophys Res Commun,2008,374(2):231-236.
[39] 张震,富文俊,邢宇锋,等. L-FABP/PPARα信号通路与非酒精性脂肪性肝炎关系的研究进展[J].山东医药,2016,56(8):98-100.
[40] LIU H,PATHAK P,BOEHME S,et al. Cholesterol 7α-hydroxylase protects the liver from inflammation and fibrosis by maintaining cholesterol homeostasis[J]. J Lipid Res,2016,57(10):1831-1844.
(收稿日期:2019-09-26 修回日期:2020-03-31)
(編辑:张元媛)

