新型冠状病毒康复者血浆IgM和IgG不同试剂检测结果的差异分析
陈富强 朱海峰 肖晨 李文超 颜鑫 刘虹 李英莲 陈剑锋 贺韦东 王露楠 李蓬
2019新型冠状病毒(2019-nCoV,以下简称新冠病毒)是一种线性单股正链RNA的新型β属冠状病毒,是已知可感染人类的第7种冠状病毒,可引起人类呼吸道感染[1-4]。截至结稿,新冠病毒在我国乃至全球持续蔓延,已成为全球重大的公共卫生威胁,对人类身体健康和生命安全造成严重威胁[5,6]。在目前缺乏疫苗和特效药的情况下,新冠肺炎康复者恢复期
血浆(COVID-19 convalescent plasma)是临床特异性治疗最可及的资源[7],适用于病情进展较快、重型和危重型患者。国家卫生健康委2020年2月14日印发了《关于开展新冠肺炎康复者恢复期血浆治疗重症、危重症患者的函》(国卫办医函[2020]128号),并于3月3日联合中央军委后勤保障部卫生局下发《关于印发新冠肺炎康复者恢复期血浆临床治疗方案(试行第二版)的通知》(国卫办医函[2020]185号),要求对新冠病毒血浆抗体进行检测,并测定总抗体或IgG抗体滴度。自2020年2月下旬以来,国内一些试剂厂家陆续研发出2019-nCoV IgM、IgG和总抗抗体免疫检测试剂盒。本研究使用3个厂家的酶联免疫吸附法(ELISA)试剂(分别用A、B、C代替)和1个厂家的胶体金免疫层析法(胶体金)试剂(用D代替),对15例新冠康复期血浆标本进行2019-nCoV IgM、IgG抗体检测,比对分析不同试剂的检测情况。同时检测亚甲蓝/光化学法病毒灭活血浆前后IgG抗体滴度变化,分析病毒灭活对抗体滴度的影响。
材料与方法
1 研究对象 2020年2月15日~2020年3月12日,在山东省血液中心无偿捐献血浆的新冠肺炎康复者15位。男10例,女5例,年龄21~52岁,平均年龄34.27岁,均为COVID-19康复者。本研究遵守国际协调理事会临床试验规范和赫尔辛基宣言,经山东省血液中心伦理审查委员会审核通过,并批准予以豁免患者知情同意(伦理审批件编号:鲁血伦审字[2020]3号)。
普通5 mL EDTA-K2抗凝剂2管全血用于酶免、生化、血型和新冠抗体检测,含惰性分离胶5 mL EDTA-K2抗凝剂(且要求无酶、无热源) 1管全血用于核酸检测。采血后4 h内1 500×g室温离心20 min分离出血浆,2~8 ℃保存,24 h内完成核酸检测。亚甲蓝/光化学法病毒灭活后留取血浆袋小辫标本。
2 试剂与仪器
2.1 2019-nCoV核酸检测试剂:伯杰核酸检测检测试剂盒(批号:20200123C),捷诺核酸检测试剂盒(批号:GZD2RM2020006A)。
2.2 2019-nCoV抗体检测试剂:IgG试剂盒来自国产3个厂家A、B、C(均采用间接法酶联免疫吸附试验原理),IgM试剂盒来自2个厂家A、B(均采用捕获法酶联免疫吸附试验原理),2019-nCoV IgG、IgM胶体金联合检测试剂盒来自国产厂家D。A、B、C厂家ELISA试剂均未上市,仅用于临床试验或科研。D试剂为经国家药监局批准上市的试剂。
2.3 主要仪器:Hamilton Microlab FAME (瑞士Hamilton公司);Hamilton Microlab STAR混样仪(瑞士Hamilton公司);ROCHE cobas s201核酸检测系统;Thermo MULTIFUGE X3F台式离心机,三洋低温冰箱MDF-U443;贝克曼AU640全自动生化仪;贝克曼PK7300全自动血型仪。山东淄博中保康医疗器具有限公司生产的病毒灭活柜及配套病毒灭活血浆袋。
3 方法
3.1 遵照《血站技术操作规程(2019版)》,对COVID-19 CP标本采用2种不同厂家的ELISA试剂开展HBsAg、anti-HCV、HIV Ag/Ab、anti-TP检测,
并采用罗氏s201核酸检测系统对HBV DNA、HCV RNA、HIV RNA进行单检。
3.2 2019-nCoV核酸检测:委托山东省疾病预防控制中心进行,采用实时荧光定量PCR方法,伯杰、捷诺2种核酸检测试剂同时检测,CT值>38判为阴性,否则判为阳性。2种试剂均为阴性方可判定结果为阴性。
3.3 2019-nCoV抗体检测方法:以下过程除A厂家IgG试剂标本稀释20倍需计算在滴度内之外,所有样本稀释液的稀释均不算在滴度计算内。
3.3.1 ELISA方法 IgG试剂:A厂家需将待测样本使用生理盐水进行20倍稀释,每孔加入样本稀释液100 μL,加稀释后的样本10 μL进行检测,检测结果如果为阳性,则滴度>20,其他梯度稀释后的标本不用再稀释20倍;B厂家每孔加入样本稀释液100 μL,加5 μL待测样本进行检测;C厂家每孔加入样本稀释液100 μL,加10 μL待测样本进行检测。
IgM试剂:A厂家每孔加入样本稀释液100 μL,加待测样本10 μL进行检测;B厂家需先将待测样本5 μL加入500 μL样本稀释液中混匀后,每孔加100 μL进行检测。
结果通过LIS系统传输到唐山启奥信息系统9.5自动接收判读,临界值(CUT OFF)严格按照说明书公式计算。S/CO值<1时判定为阴性,否则判定为阳性。
3.3.2 胶体金免疫层析法 IgM、IgG联合检测试剂D:在检测卡上加待测样本10 μL,然后加80 μL样本稀释液,15 min内观察是否有条带。对照条带和检测条带同时出现才可判为阳性;只出现对照条带,判为阴性;对照条带未出现,判为无效。采用手工加样、人工判读,拍照记录原始结果。
3.4 抗体滴度检测:采用生理盐水对标本稀释,先将待测样本倍比稀释后(1×、20×、40×、80×、160×、320×),除A试剂外,按照3.3方法分别进行检测。ELISA法检测结果为阳性,则判定滴度>稀释倍数,样本稀释液的稀释倍数不计算在内。根据厂家建议,A试剂要求的待测样本20倍稀释计算在滴度内。比如,IgG试剂A,样本预稀释20倍,取10 μL,加到100 μL的稀释液中进行检测,实际上该样本被稀释了大约200倍,结果若呈阳性,为滴度>20。应用Hamilton Microlab STAR混样仪完成自动稀释、加样,Hamilton Microlab FAME进行试验,加样、试验程序均严格按照试剂说明书编程[8]。
3.5 使用A试剂对7例血浆标本,在亚甲蓝/光化学法病毒灭活前、后,进行IgG抗体滴度检测。评估病毒灭活对2019-nCoV IgG抗体滴度的影响。
4 统计学处理 应用SPSS 22.0软件,对阳性率的比较采用χ2检验,P<0.05表示差异有统计学意义。
结 果
1 新冠康复者无偿献血常规检测及2019-nCoV核酸检测情况 遵照《血站技术操作规程(2019版)》要求及2019-nCoV核酸检测结果均合格(见表1)。
采用贝克曼AU6 4 0全自动生化仪、贝克曼PK7300全自动血型仪分别进行谷丙转氨酶(ALT)和ABO/Rh血型检测。15例献浆者A、B、O、AB 4种血型均有,分别占20%、26.7%、33.3%和20%,均为RhD阳性;ALT值普遍偏高,虽然均<50 U/L,符合无偿献血标准,但>30 U/L的占60%,远高于正常献血者,可能是由于新冠病毒累及肝脏或服用药物等原因,造成新冠患者肝脏损伤,出院后仍未完全恢复。ALT过高也是阻碍康复者捐献血浆的最主要因素,有3例有强烈捐献意愿的预约康复者,因为转氨酶高(>90 U/L)而无法捐献。
2 不同试剂IgM、IgG分析灵敏度比较 严格按照试剂说明书操作。结果显示不同试剂对15例标本的IgM、IgG检测结果存在较大差异(见表2),可能与试剂生产工艺、检验原理、灵敏度不同有关。如C厂家IgG试剂在原倍下检出率较高,样本稀释后未检出,可能与试剂灵敏度低有关。样本稀释对检测结果影响较大,如A厂家IgG试剂4例标本(8617、9690、9702、9704)检测结果为阴性,但该4例标本未稀释前检测均为阳性(S/CO值分别为3.62、11.78、1.38、4.30),20倍稀释后检测为阴性(S/CO值分别为0.05、0.42、0.03、0.07),根据试剂说明书应以20倍稀释后的结果作为该标本的最终结果;其他不需稀释的3种试剂,该4例标本IgG检测结果均为阳性,同样与A试剂的灵敏度有关。胶体金试剂D检测15例标本IgG均为阳性,5例IgM为阳性,其中2例(标本9694,9707)弱阳,条带颜色较浅(见图1)。
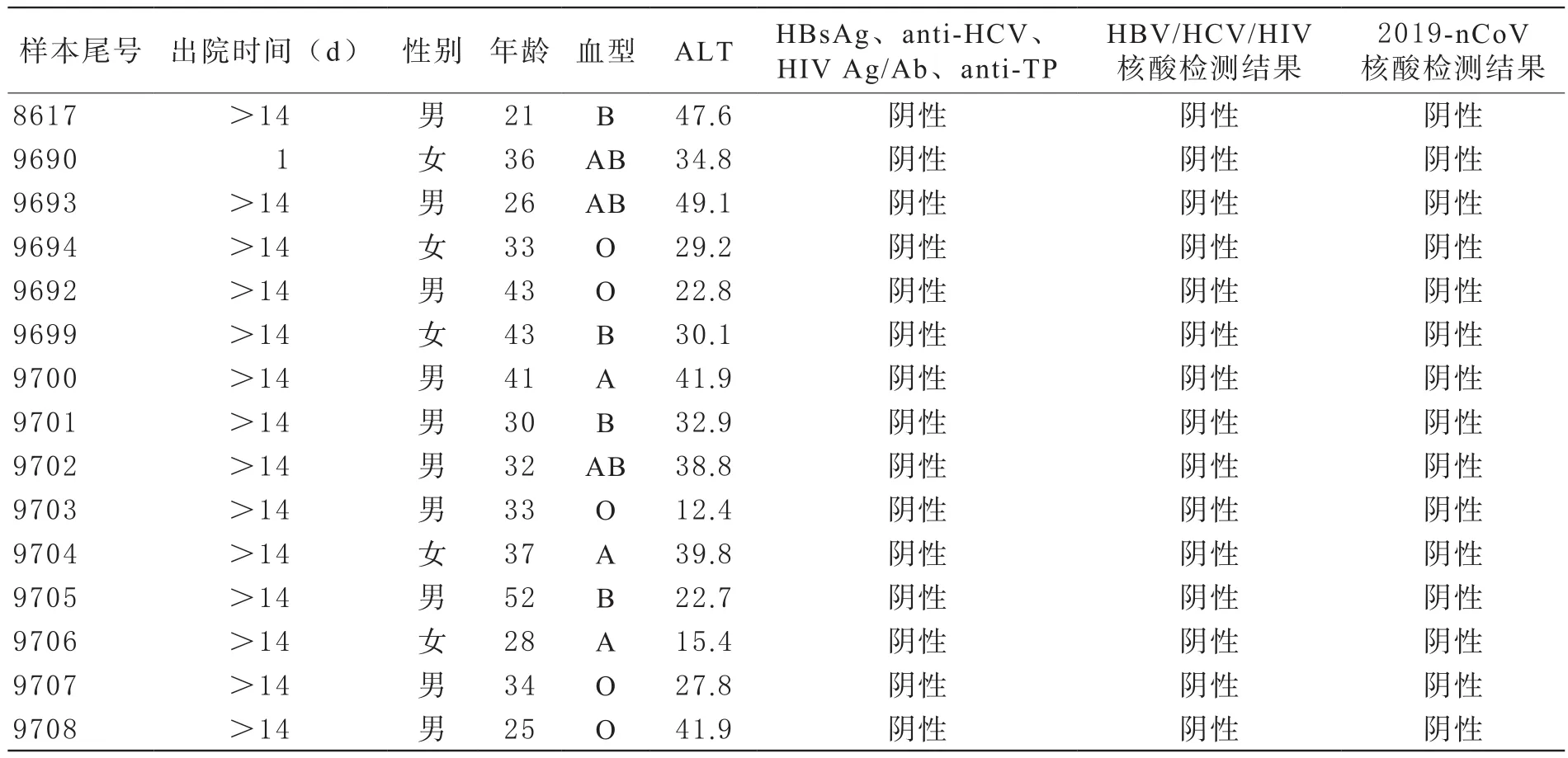
表1 新冠康复者无偿献血常规检测及2019-nCoV核酸检测情况
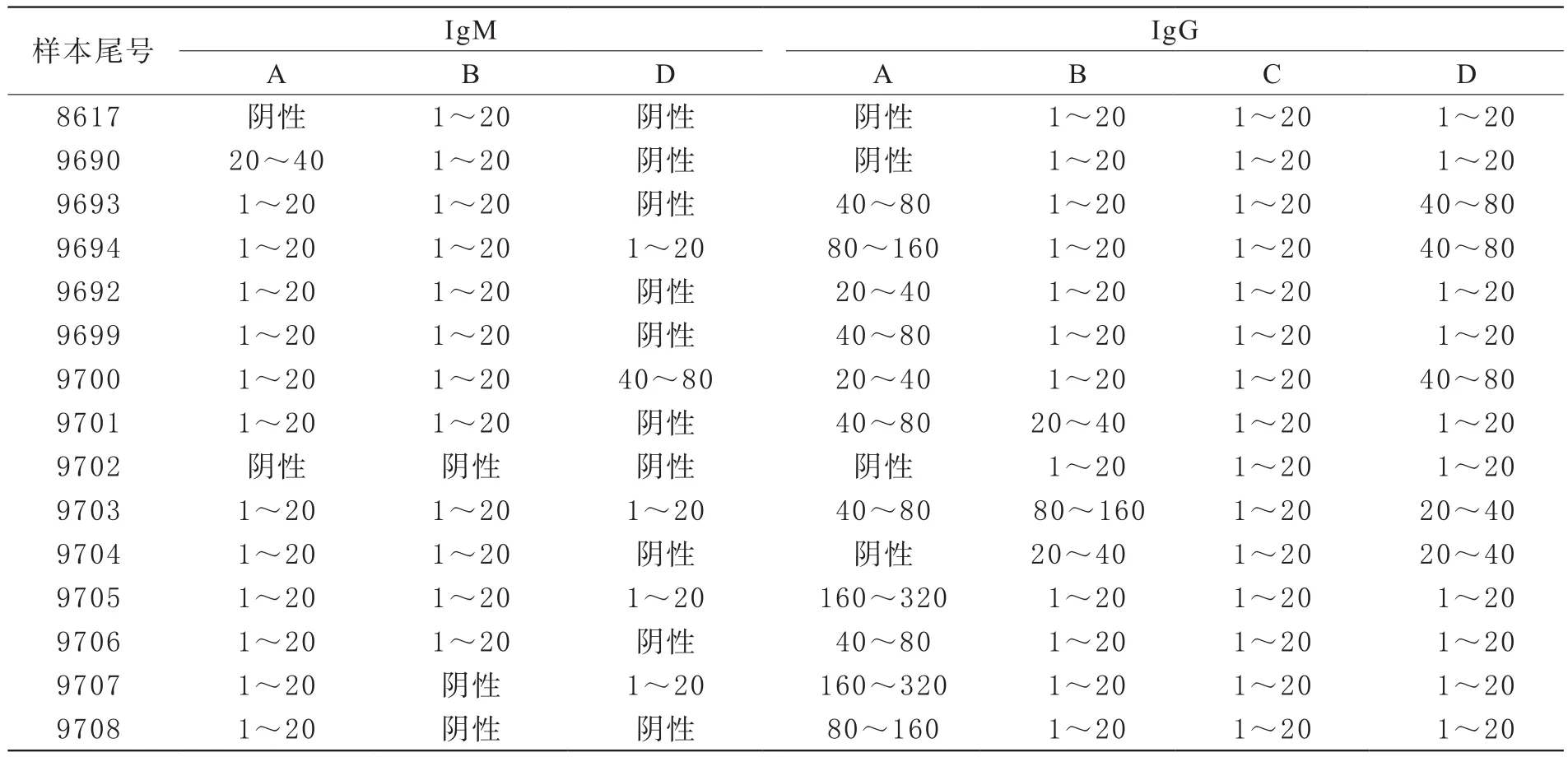
表2 不同试剂IgM、IgG分析灵敏度比较
3 病毒灭活前后2019-nCoV IgG抗体滴度变化情况将7例研究对象血浆病毒灭活前后2019-nCoV IgG抗体检测结果进行比较(见表3)。7例标本全部检出IgG,因ELISA检测S/CO值仅在较低数值时与浓度成正比,因此选择稀释后仍为阳性且较低S/CO值的数据进行稳定性比较(见图2)。结果发现7例标本在亚甲蓝-光化学法病毒灭活前后,IgG在不同的稀释倍数下定性检测结果无变化,S/CO值无明显变化。因此,我们得出结论,病毒灭活不会对2019-nCoV IgG抗体滴度产生明显影响。
讨 论
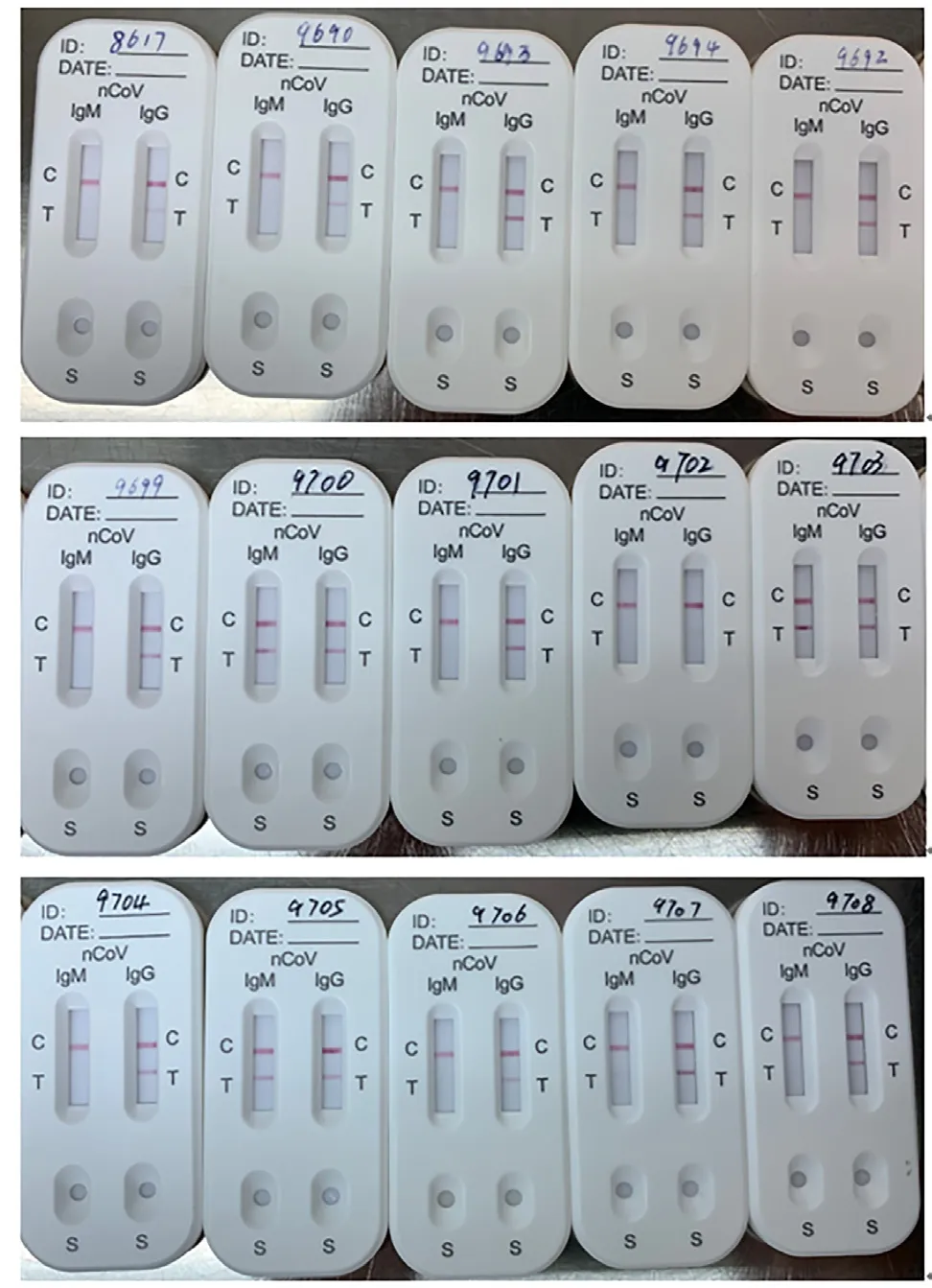
图1 2019-nCoV IgG、IgM胶体金检测结果
由于尚无针对冠状病毒感染的治疗药物,目前对于冠状病毒的治疗方案多以缓解症状、预防继发感染、减少并发症发生以及进行器官功能支持为主。其他一些治疗方法多来自于治疗SARS、MERS及流感的经验,恢复期血浆可能含有对抗病毒的中和抗体,理论上对感染者应有一定治疗效果[9]。新冠康复者恢复期血浆是由康复者捐献的含高效价新冠病毒特异性抗体的血浆,经过病毒灭活处理,并对抗新冠病毒中和抗体、多重病原微生物检测后制备而成,用于新冠肺炎危重患者的治疗。临床反映,有患者接受治疗12 h~24 h后,实验室检测主要炎症指标明显下降,淋巴细胞比例上升,血氧饱和度、病毒载量等重点指标全面向好,临床体征和症状明显好转[10]。
病毒感染机体后,免疫系统对病毒进行免疫防御并产生特异性抗体。其中特异性IgM抗体是机体感染后早期产生的抗体,IgG抗体是再次免疫应答产生的主要抗体,提示病情进入恢复期或存在既往感染。2019-nCoV IgM从感染的第7天到第9天呈直线上升,随后逐渐下降,IgG从感染的第7天到第18天呈直线上升状态[1]。为提高新冠康复期血浆治疗效果,国家要求对抗体滴度进行检测。本研究发现,第2例研究对象(9690)为出院1天康复者,IgM滴度较高,IgG较低,提示仍处于急性感染恢复期,虽然核酸检测连续多次为阴性,但是体内IgM抗体仍处于较高水平,抗体IgG处于较低水平。其他研究对象均为出院14天以上,IgG抗体均为阳性,且滴度检测高低不等,IgM抗体有的已检测不出,预示患者逐渐痊愈,并产生了对病毒的免疫力。提示应尽量采集出院14天以上的康复者血浆。
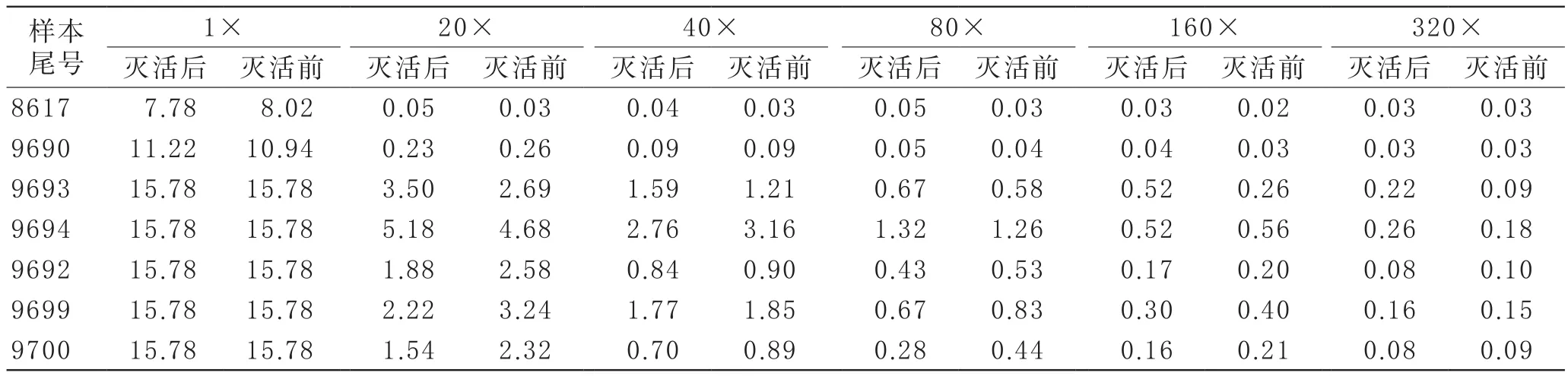
表3 病毒灭活前后2019-nCoV IgG检测结果比较(S/CO值)
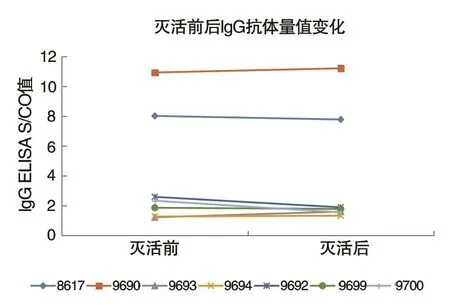
图2 灭活前后IgG抗体S/CO值变化
有研究发现,2019-nCoV IgM和IgG化学发光免疫检测试剂具有很高的临床特异度,分别达到96.2%和92.41%,敏感度分别达到70.24%和96.10%,可作为新冠病毒筛查和诊断的有效补充[11]。本研究中,胶体金试剂D为国家药监局批准上市的试剂,ELISA试剂截至目前均为未上市试剂,仅用于临床试验或科研。从原理上看,胶体金免疫层析法灵敏度应低于酶联免疫吸附法,但是本研究却发现,标本9693、9694、9700稀释40倍使用胶体金检测IgG为阳性,但ELISA试剂B、C检测为阴性,可能与标本所含抗体物质及试剂包被片段差异造成,需进一步研究。在IgM检测方面则相反,胶体金试剂D灵敏度明显低于ELISA试剂A、B。不同ELISA法试剂之间灵敏度也有差异,标本稀释对灵敏度有影响,易造成灵敏度的下降。从表2结果来看,A与B、C两种ELISA试剂的滴度结果差异较大,A试剂滴度大于160的有2个,B、C试剂没有滴度大于160的结果。可能是由于试剂之间灵敏度有差异,抗体滴度和试剂灵敏度挂钩,相同灵敏度下,才能比较抗体滴度,不同灵敏度不能比较滴度。此外也可能和滴度的计算方法有关系,本研究仅以标本提前使用生理盐水稀释的倍数来计算抗体滴度,反应体系中样本稀释液的稀释未计算在滴度稀释内,所有结果均未乘以反应体系样本稀释液的稀释倍数,故IgG抗体滴度普遍较低。
亚甲蓝(methylene blue,MB)是一种临床用静脉注射药,经一定波长光激发后具有灭活血浆中多种病毒的作用[12]。MB/光化学法灭活SARS-CoV效果已被证实,对血浆中抗体生物学活性的影响较小[13]。本研究对亚甲蓝/光化学法病毒灭活前后的血浆标本分别进行梯度稀释,检测结果表明灭活前后,IgG抗体滴度均无明显变化。这可能与光化学反应产物作用靶位有关,MB分子主要作用于病毒核酸和脂包膜上,而抗体是一种糖蛋白,不是MB的主要作用位点。因此,可用MB/光化学法处理2019-nCoV康复期患者血浆, 以保证临床输血的安全性。
本研究采用不同试剂对15例新冠康复者血浆2019-nCoV IgM、IgG抗体进行检测,旨在对目前国产试剂进行初步评价,分析其性能,为其持续改进提供参考。因所使用的试剂均为早期产品,仅供研发和临床试验使用。随着研发的深入,有些已进行了改进,比如A试剂IgG检测已不需要对标本预稀释,检测灵敏度和特异性均有所增加,这些在未来的研究中将继续探讨。此外,新冠患者恢复期血浆抗体滴度水平差异较大,表明由于个体感染病毒状况不同或机体免疫应答存在差异,在用于治疗前进行抗体滴度的检测以保证疗效是非常必要的。
利益冲突 所有作者均声明不存在利益冲突

