新型谷胱甘肽合成酶重组菌的发酵工艺优化
赵 翔 孙 超 汤利文 向 洁 赵士敏 许 岗
(湖南福来格生物技术有限公司,湖南 长沙 422010)
谷胱甘肽(GSH)是由谷氨酸、半胱氨酸和甘氨酸组成的活性三肽[1],由于其重要的抗氧化生理功能,GSH 在食品、医药、保健品及化妆品领域都有着广泛应用[2-3]。谷胱甘肽在生物体内最普遍的合成途径是通过2 步依赖于ATP 的酶催化完成,首先利用γ-谷氨酰半胱氨酸合成酶(GSH Ⅰ)将谷氨酸和半胱氨酸催化合成谷氨酰基半胱氨酸,再通过谷胱甘肽合成酶(GSH Ⅱ)连接甘氨酸合成谷胱甘肽[4]。近年来在一些革兰氏阳性细菌中发现一种新型的双功能谷胱甘肽合成酶(GshF),兼具GSH Ⅰ和GSH Ⅱ的活性[5],能将3 种氨基酸直接催化合成谷胱甘肽,且产物对其不存在反馈抑制,在谷胱甘肽生物合成中有着重要的应用价值。
1 材料与方法
1.1 菌种
重组GshF 大肠杆菌和毕赤酵母菌由该实验室自行构建和保存。
1.2 培养基
大肠杆菌SOC 培养基:2%的胰蛋白胨,0.5 %的酵母提取物,10 mM 的NaCl,2.5 mM 的KCl,10 mM 的MgCl2,10 mM的MgSO4,20 mM 的葡萄糖。
酵母发酵培养基:4%的甘油,1.5%的硫酸镁,0.25%的硫酸钙,0.15%的NaCl,0.6%的KOH,10 mL/L 的磷酸,2 mL/L 的微量元素PTM1。
1.3 培养条件
大肠杆菌培养条件控制:活化种子按1%的接种量接种于发酵罐培养基中,初始pH7.0,培养温度37 ℃,调节空气流量和转速,控制溶氧40%以上,溶氧反弹开始补加葡萄糖,使用溶氧反馈补料方式,当OD600达到要求时,缓慢降温诱导,全程氨水调节pH 值。
酵母菌培养条件控制:按1%的接种量接种于发酵罐培养基中,初始pH5.0,温度30 ℃,调节空气流量和转速,控制溶氧30%以上,溶氧反弹后开始补加甘油,8 h 后单独补加甲醇,溶氧反馈补加,氨水调节pH 值,发酵时间为115 h。
1.4 检测方法
1.4.1 生物量测定
细胞密度测定:取适量发酵液于紫外可见光分光光度计上,测600 nm 处的吸光光度,以OD600值表示发酵液中的细胞浓度。
菌体生物量的测定:取发酵液10 mL 吸入离心管内,控制转速为10 000 r/min,离心20 min 后弃去上清液进行称重,计算后即为菌体质量浓度。
1.4.2 粗酶液抽提
移取0.5 mL 发酵液样品于1.5 mL 规格的离心管中(离心管中预先加入一定量的玻璃珠),在MS3 振荡器上振荡20 min(振荡器振荡频率设为1 500 次/min),离心取清液作为粗酶液。
1.4.3 谷胱甘肽合成酶活力检测
依次称取半胱氨酸、谷氨酸、甘氨酸、ATP 和MgCl2·6H2O溶解于0.1 mol/L、pH8.0 的Tris-HCl 缓冲液配制成的底物溶液,其中半胱氨酸∶谷氨酸∶甘氨酸∶ATP ∶Mg2+摩尔比为80 ∶120 ∶120 ∶120 ∶160。精确移取粗酶液至50 mL试管中,加入已预热至37 ℃的底物溶液10 mL,于37 ℃的水浴中搅拌反应10 min 后,加入25%的三氯乙酸溶液2 mL终止反应。离心上清液定容后进行HPLC 分析(色谱柱shimpack XR-ODS 2 μm 4.6 mm×30 mm,波长210 nm,流速1.0 mL/min)。谷胱甘肽合成酶活力计算公式为:

式中:W1为谷胱甘肽标准品称量,mg。p1为谷胱甘肽标准品含量,%。A1和A2为样品HPLC 检测中谷胱甘肽面积。M 为谷胱甘肽分子量。T 为反应时间,min。V 为液态酶取样量,mL。
2 结果与分析
2.1 大肠杆菌表达GshF的发酵工艺优化
2.1.1 诱导温度的考察
诱导温度对菌体生长速率、质粒稳定性和产物蛋白折叠等都有重要影响。为获得最佳诱导温度,分别调整诱导温度至23 ℃、25 ℃、28 ℃、30 ℃进行优化对比,结果如图1 所示。在25 ℃诱导时,酶活达到最高值(68.5 U/mL)。在较低的温度条件下虽然有利于其分泌和正确的折叠,但总菌体量和酶活较低。在较高温度条件下,GshF 的过快表达可能会影响其正确折叠,容易产生包涵体。

图1 诱导温度对大肠杆菌表达GshF 的影响
2.1.2 诱导pH的优化
实验中在发酵前期控制pH7.0,诱导后分别控制pH6.0、pH6.5、pH7.0、pH7.5、pH8.0 培养40 h 后检测酶活。结果如图2 所示,最适宜的诱导表达pH 为6.5,GshF 发酵活力达到71.4 U/mL。

图2 诱导pH 对大肠杆菌表达GshF 的影响
2.1.3 诱导剂的选择
实验分别选用0.2 mmol/L的IPTG、1.2%的半乳糖和1.2%的乳糖进行对比,在分批补料的控制下诱导培养40 h,检测酶活,结果如图3 所示。乳糖诱导活力达到71.2 U/mL,与强诱导剂IPTG 结果基本一致,优于半乳糖的诱导结果。此外乳糖还具备无毒和价廉的优点,更适合在大规模发酵生产中使用。
2.1.4 诱导时机的选择
分别选择细胞密度OD600值在20、25、30、35、40、45加入1.2%的乳糖诱导,结果如图4 所示。在重组菌培养至对数生长中期OD600=35 时进行诱导,GshF 的可溶表达量最大,此时酶活最高,达到75.2 U/mL。诱导时机过早会导致菌体终浓度下降从而影响GshF 产量。而过晚诱导,虽可获得较高的菌体量,但酶活表达明显下降。

图3 诱导剂种类对大肠杆菌表达GshF 的影响
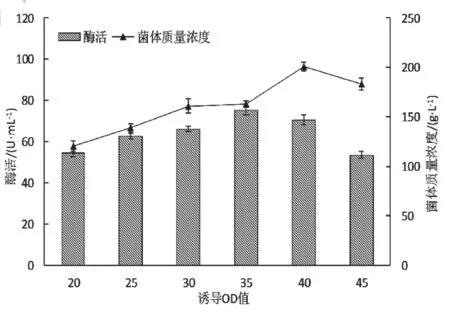
图4 诱导时机对大肠杆菌表达GshF 的影响
2.2 毕赤酵母表达GshF发酵工艺优化
毕赤酵母表达系统能在唯一碳源甲醇的诱导下高效启动外源蛋白的表达,毕赤酵母的培养通常分为菌体生产和甲醇诱导2 个阶段,通过生长环境和补料策略的控制,可以达到提高外源蛋白表达量的目的[6]。
2.2.1 诱导温度优化
由图5 可知,毕赤酵母酶活表达呈现前期增速慢,中期酶活增长快,后期酶活略有降低的趋势。诱导温度25 ℃条件下,GshF 酶活最高,达到110.3 U/mL,因此选择诱导温度为25 ℃。
2.2.2 诱导pH优化
诱导pH 优化结果如图6 所示,pH5.0 和pH5.5 酶活较高,增长趋势也比较一致,GshF 最高酶活分别为124.1 U/mL和120.6 U/mL。根据分析结果,选择毕赤酵母的诱导pH 为5.0。
2.2.3 溶氧控制范围的优化
毕赤酵母利用甲醇时需要消耗大量的氧气,溶氧不足会限制菌体增殖,并且造成甲醇及其代谢物的累积。图7 表明:当溶氧控制在10%以下,中后期酶活增长平缓。当溶氧控制超过40%,酶活也较低。所以过高或过低的溶氧都不利于毕赤酵母合成GshF,当溶氧范围为10%~20%时,酶活最高达到了133.5 U/mL。
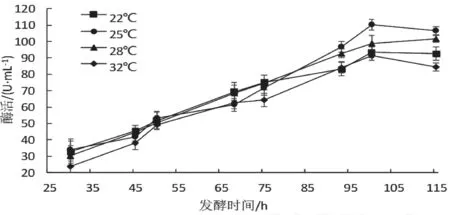
图5 诱导温度对毕赤酵母表达GshF 的影响

图6 诱导pH 对毕赤酵母表达GshF 的影响

图7 溶氧控制范围对毕赤酵母表达GshF 的影响
3 结论
利用发酵罐研究了重组大肠杆菌诱导温度、pH 值、诱导时机等培养条件对菌体生长及GshF 酶活的影响,确定最佳培养条件为pH6.5、诱导温度25 ℃、在对数生长中期(OD600=35)时流加诱导培养基,GshF 酶活达到75.2 U/mL,比优化前提高了31.3%。同时还对表达GshF 毕赤酵母菌的发酵工艺进行了系统的优化,确定诱导条件为25 ℃、pH5.0和溶氧控制范围为10%~20%,GshF 最高酶活为133.5 U/mL。经过优化后的大肠杆菌和毕赤酵母的发酵、GshF 酶活都能达到较高水平,可以依据用途选择不同的宿主菌进行规模化生产。

