桃果胶裂解酶编码基因PpPL1的鉴定及其在果实成熟软化过程中的表达
温 波 王亚兰 何丽丽 张 峰 Yaowapa Boon-Ek 柳士勇
(1安徽农业大学园艺学院,安徽 合肥 230036;2安徽省六安市果树研究所,安徽 六安 237000)
桃[Prunuspersica(L.) Batsch]果实味道甜美,且富含维生素和抗氧化性物质,深受广大消费者的喜爱[1]。 根据成熟过程中不同的果实质地变化,桃主要分为硬质型桃和溶质型桃两大类[2-3]。 溶质型桃在成熟过程中一般会释放大量的乙烯,导致桃果实在短时间内快速软化;而硬质型桃在成熟过程中呼吸跃变不明显,乙烯释放量很少,果实软化缓慢[4-6]。 细胞壁的降解是导致果实软化的主要原因[7]。 细胞壁中的果胶是维持其结构稳定的主要物质之一,随着果胶的降解,细胞壁开始解离,果实发生软化[2,8]。 植物细胞壁中的果胶根据其结构可以分为同型半乳糖醛酸聚糖(homogalacturonan,HG)、鼠李半乳糖醛酸聚糖Ⅰ(rlaamngalacturonanⅠ,RGI)和鼠李半乳糖醛酸聚糖Ⅱ(rhamngalacturonanⅡ,RGⅡ)等。 不同果胶链之间相互连接,形成了复杂的网状结构。 细胞壁中果胶的降解也是由多种结构酶共同作用的结果。 如果胶甲酯酶(pectin methylesterase,PME)、多聚半乳糖醛酸酶(polygalactusidase,PG)、果胶裂解酶(pectate lyase,PL)、β 半乳糖苷酶(β-galactosidase,β-Gal)等共同作用的结果。 前期研究表明,内多糖半乳糖醛酸酶(Endo-PG)在硬质型桃中低表达且在整个软化过程中表达恒定,而在溶质型桃中软化前表达较低,随着软化进程的推进,表达量显著升高[5]。 进一步研究发现,Endo-PG 蛋白可以被定位到桃果实细胞中层,其表达与细胞之间黏着力的失去相关[6]。 综上表明endo-PG表达与桃果实的软化高度相关。
PL 又称果胶酸裂解酶,其可以通过β-消除方式随机断裂多聚半乳糖醛酸链上的β-1,4 糖苷键,产生含不饱和C4-C5 键的寡聚半乳糖醛酸,从而降解果胶[9-10]。 PL 作为多基因家族在植物中广泛存在,在已完成基因组测序的植物,如番茄[11]、拟南芥[12]、菁芜菁[13]、杨树[14]中都鉴定出了多个PL基因。 关于PL与果实成熟与软化的关系,前人已经进行了一系列的研究。 Dominguez-Puigjane 等[15]从香蕉果实cDNA 文库中克隆了一个果胶裂解酶基因Ban17。 Northern 分析表明,Ban17 在呼吸跃变早期的果实中开始表达,在跃变峰处达到最大值,随后在过熟期表达下降;外源乙烯可以显著诱导该基因mRNA 的积累,推断Ban17 可能在果实成熟软化过程中发挥作用。 草莓果实中利用反义基因沉默PL基因后,果胶的溶解性降低,果实的硬度显著提高[16-17]。 在番茄中沉默表达果胶裂解酶基因SLPL降低了水溶性果胶的含量,显著提高了果实的硬度,延长了果实的贮藏期[11]。 研究还发现,PL可能通过降解三细胞连接处和中间层中的交联果胶聚合物,使细胞壁中的果胶多糖能够被PG 等酶降解,从而导致果实快速软化[11,18]。 这些证据都表明,PL 是导致果实软化的原因之一。 但有关PL 在桃果实软化中的作用鲜有报道。 本研究拟对桃PL 基因家族进行生物信息学分析,探究该家族基因的序列特征及遗传进化关系,并鉴定在溶质型桃和硬质型桃果实之间差异表达的基因,以期为进一步研究PL在桃果实成熟软化过程中的功能奠定基础。
1 材料与方法
1.1 材料及前处理
溶质型桃品种黄金蜜3 号(Gold honey 3)和硬质型桃品种有名(Yu myeong),采自中国农业科学院郑州果树研究所桃育种圃。 采集时间为第2 次膨大期(S3)和生理成熟期(S4Ⅰ、S4Ⅱ、S4Ⅲ)共4 个时期,分别为花后110、115、122 和127 d。 各时间点对应的果实硬度和乙烯释放量测定方法参照Pan 等[19]的报道。
溶质型桃品种湖景蜜露(Hujing Milu)和硬溶质型桃夏之梦(Xia Zhimeng),合肥市桃蹊水果农场。 于果实成熟期采摘大小一致、无病虫害的果实,采摘后立即运回实验室,剔除机械损伤的材料并用冷水清洗表面灰尘和田间微生物,再用0.02%NaClO 浸泡2 min。 常温(25±2℃)放置于实验室工作台,每隔1 d 测量硬度指标并收集样品,所有样品用液氮速冻后保存于-80℃冰箱备用。
1.2 桃PpPL 家族成员的序列分析和进化树的构建
利用 phytozome 基因组数据库(http:/ /www.phytozome.net/search.php),选择Prunuspersica v2.1 检索,以番茄PL 蛋白序列为模板[18],BLAST 获得桃基因组[20]已注释的PpPL 蛋白序列,并记录氨基酸长度和染色体位置;PL 蛋白的分子量(molecular weight,MW)和等电点(isoelectric point,pI) 采用ExPASY Compute pI/MW 在线程序[21](http:/ /web.expasy.org/protparam)进行分析;利用GSDS 2.0[22](http:/ /gsds.cbi.pku.edu.cn/)对基因结构进行分析;采用DNAMAN 8.0 对桃蛋白家族及其他物种蛋白序列进行比对;使用MEGA 7.0[23]软件,采用Neighbor-Joining 法[24]构建系统发育树,其他参数为系统默认值。 以拟南芥[12]、番茄[11]和香蕉(NCBI 登录号:CAA63496)[15]作为参比序列。
1.3 桃PpPL 基因在不同溶质型桃果实中的表达分析
通过分析Pan 等[19]RNA-seq 数据来研究PL 家族基因在不同溶质型桃果实中的表达差异。 基因的量化以RPKM (reads per kilobase of exon model per million mapped read) 表示。 使用HemI 1.0 软件对获得的数据进行层次聚类分析,并绘制热图。
1.4 荧光定量PCR(q-PCR)检测
桃果实组织总RNA 提取采用植物RNA 快速提取试剂盒CW2598(康为世纪生物科技有限公司,合肥)的方法。 采用反转录试剂盒(NO. 6110A)(TaKaRa,日本)获得cDNA 第一链,并以此为模板,使用CFX96 荧光定量仪(Bio-Rad,美国)进行q-PCR 检测。 采用SYBR Premix EX Taq(NO.RR820A)试剂盒(TaKaRa,日本)进行扩增,反应总体积为10 μL,包含SYBR Premix Ex Taq 5 μL,上、下游引物各0.5 μL,模板cDNA 1 μL,ddH2O 3 μL。 反应程序:95℃预变性5 min;95℃变性30 s,60℃退火30 s,72℃延伸30 s,共40 个循环。 每个样品3 次重复,采用Primer Premier 5.0 设计特异性引物(表1),引物由合肥通用生物技术公司合成。 选取Actin(Prupe.1G510100)作为内参基因[25],采用2-△△Ct法计算基因相对表达量。
2 结果与分析
2.1 桃PpPL 基因家族的全基因组鉴定
通过搜索Phytozome 桃基因组数据库共筛选出30个PpPL基因。 剔除8 个重叠基因,2 个不含任何桃PpPL Pec-Lyase-C/Pec-Lyase-N 结构域的基因,最终鉴定出20 个桃PpPL基因(表2)。 20 个PpPL分别分布于8 条染色体上:1 号染色体包含8 个PpPL基因位点;第2、第3 和第4 号染色体上各含2 个;第5 号染色体含有3 个;第6、第7 和第8 号染色体上各含有1 个。20 个PpPL基因编码蛋白质的氨基酸数在244~531 aa范围内;分子量介于27 442.44 ~53 577.29 Da 之间,等电点为6.00 ~9.82。 DNAMAN 8.0 比对发现,所有的PpPL 蛋白都含有Pec-Lyase-C 结构域,但只有PpPL7、PpPL8、PpPL12、PpPL17 包含Pec-Lyase-N 结构域(图1)。
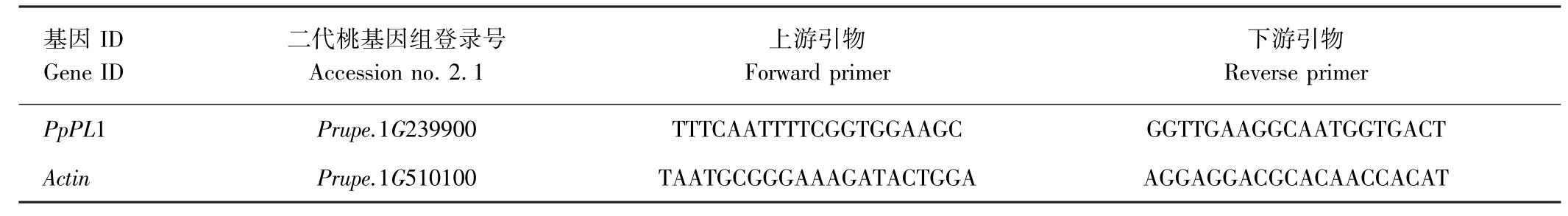
表1 实时定量PCR 引物Table 1 Quantitative real-time PCR primers
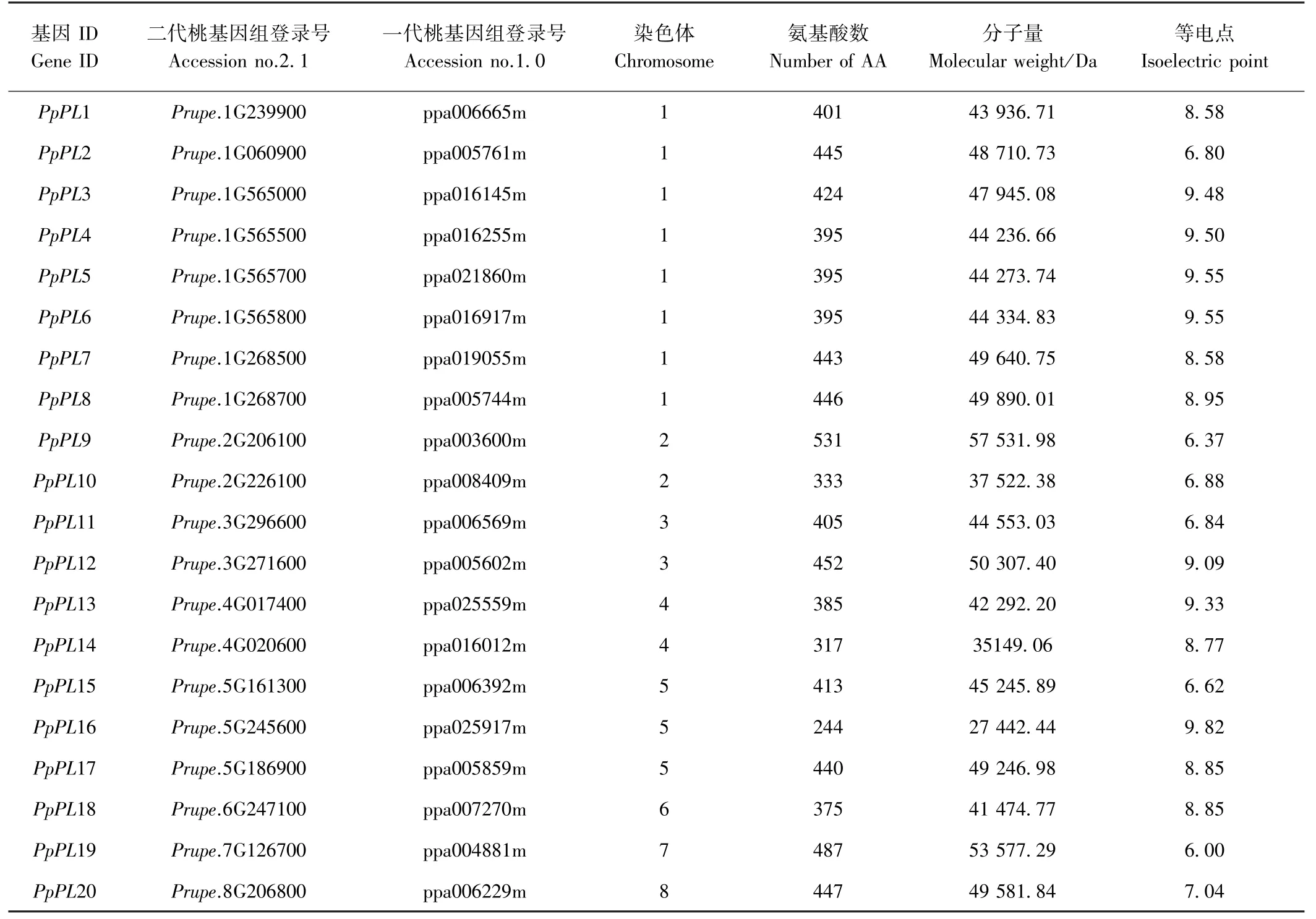
表2 桃基因组中PpPL 蛋白家族的特征Table 2 Characteristics of PpPL proteins family in peach genome
2.2 桃PpPL 基因家族的系统发育关系和基因结构分析
利用MEGA 7.0 软件对20 个桃PpPL基因构建进化树(图2),聚类分析发现桃PpPL基因可以分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ共5 个亚家族,每个亚家族分别含有7、4、2、5 和2 个PL基因。 基因结构分析表明,各个基因所含有的内含子数从1 到6 不等,桃PpPL基因在Ⅰ亚族都含有7 或4 个外显子,Ⅱ亚族都含4 个外显子,Ⅲ和Ⅳ亚族基因缺失了起始的上游序列,含有4 或5 个外显子,Ⅴ亚族都含有5 个外显子。
2.3 桃PpPL 基因家族的亲缘关系分析
对桃(20 个)和拟南芥(26 个)、番茄(22 个)、香蕉(1 个)PL 蛋白序列构建系统进化树(图3),发现这4 个物种的69 个PL基因可以分为5 个亚家族,分别命名为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ。 第Ⅰ和第Ⅱ亚族都含有12个PL 蛋白,第Ⅲ、Ⅳ、Ⅴ组分别含有9、16、20 个PL 蛋白。 其中,与软化相关的番茄SLPL 蛋白和香蕉CAA63496 蛋白都分布在第Ⅰ亚家族。

图1 桃PpPL 蛋白家族多序列比对Fig.1 Multiple sequence alignments of peach PpPL proteins family
2.4 桃PpPL 基因在溶质型和硬质型桃果实成熟过程中的表达
由图4 可知,PpPL基因在桃果实成熟过程的表达差异明显,根据其表达量不同可分为3 组,分别为高表达组、次高表达组和低表达组。 高表达组包含的3个PpPL基因分别为PpPL1、PpPL2、PpPL15,其中PpPL2 和PpPL15 在溶质型黄金蜜3 号、PpPL1 在硬质型桃有名成熟过程中表达量很低,而在溶质型桃黄金蜜3 号成熟过程中高表达,说明PpPL1 基因与桃果实的成熟软化相关。 次高表达组包含4 个PpPL基因,分 别 为PpPL9、PpPL10、PpPL18 和PpPL19,其 中PpPL9、PpPL10 和PpPL19 在果实成熟过程中表达恒定,不同溶质型果实之间未见显著差异,而PpPL18 在硬质型桃有名成熟过程中呈现出更高的表达。 低表达组包含13 个PpPL基因,这些基因在两种溶质型桃果实成熟软化过程中均低表达。
将桃PpPL1 蛋白序列与番茄SLPL 蛋白序列进行对比,发现桃PpPL1 与经过功能验证的果实软化相关的番茄SLPL 序列相似度高达72.8%,都包含了完整的PL 蛋白结构域Pec-Lyase-C,且2 个蛋白都含有5个相同的β-螺旋结构(图5)。

图2 桃PpPL 的进化关系和基因结构Fig.2 Gene structure and phylogenetic relationship of peach PpPL

图3 桃和其他物种PL 蛋白家族的系统进化树Fig.3 Phylogenetic analysis of PL proteins family from peach and other species
2.5 桃PpPL1 基因在桃果实成熟软化过程中的表达分析
以溶质型桃黄金蜜3 号和硬质型桃有名在不同成熟期的果实为试验材料,采用q-PCR 对PpPL1 基因表达进行验证。 由图6 可知,在桃果实成熟过程中,PpPL1 基因在硬质型桃有名中的表达量均远低于在溶质型黄金蜜3 号中的表达量,这与转录组结果一致。
为进一步验证PpPL1 基因与桃成熟软化的关系,本试验选取溶质型桃湖景蜜露和硬溶质型桃夏之梦为试验材料,检测了桃果实采后软化过程中的质地变化及PpPL1 在对应期间的表达变化。 由图7 可知,随着采后贮藏时间的延长,硬质型桃夏之梦的硬度下降缓慢,与之相对应PpPL1 基因在整个贮藏过程中的表达量都很低;而溶质型桃湖景蜜露果实在采后2 d 开始急剧软化,与此相关的PpPL1 基因在软化开始前呈现出高表达,此后相对表达量开始下降,贮藏4 d 以后表达量变化不明显。
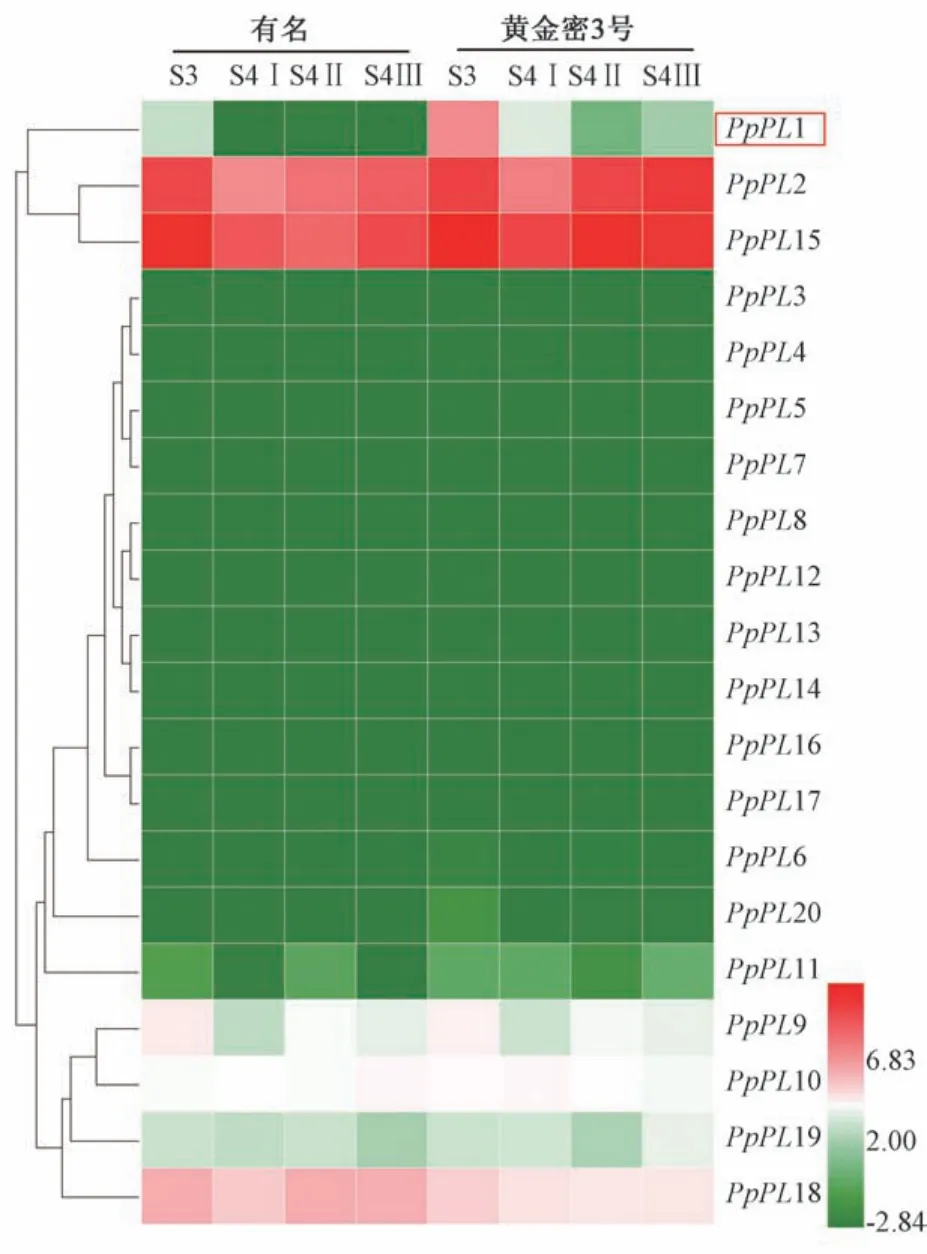
图4 桃PpPL 基因在黄金蜜3 号和有名桃果实各成熟阶段的表达量分析Fig.4 Expression of PpPL genes in Gold honey 3 and Yu myeong peach fruits at the different maturity stages
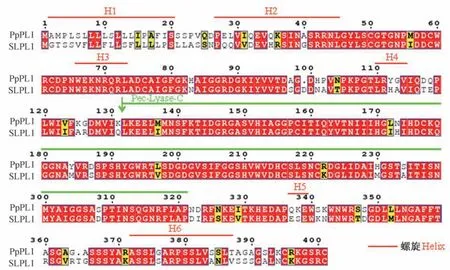
图5 桃PpPL1 与番茄SLPL 蛋白多序列比对及二级结构分析Fig.5 Multiple sequence alignments and secondary structure of peach PpPL1 and tomato SLPL proteins
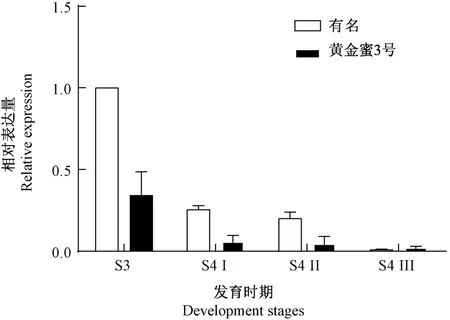
图6 PpPL1 基因在黄金蜜3 号和有名桃果实不同发育期的表达Fig.6 Expression profile of peach PpPL1 gene during fruit ripening of Gold honey 3 and Yu myeong peach fruits were sampled at the different development stages
3 讨论
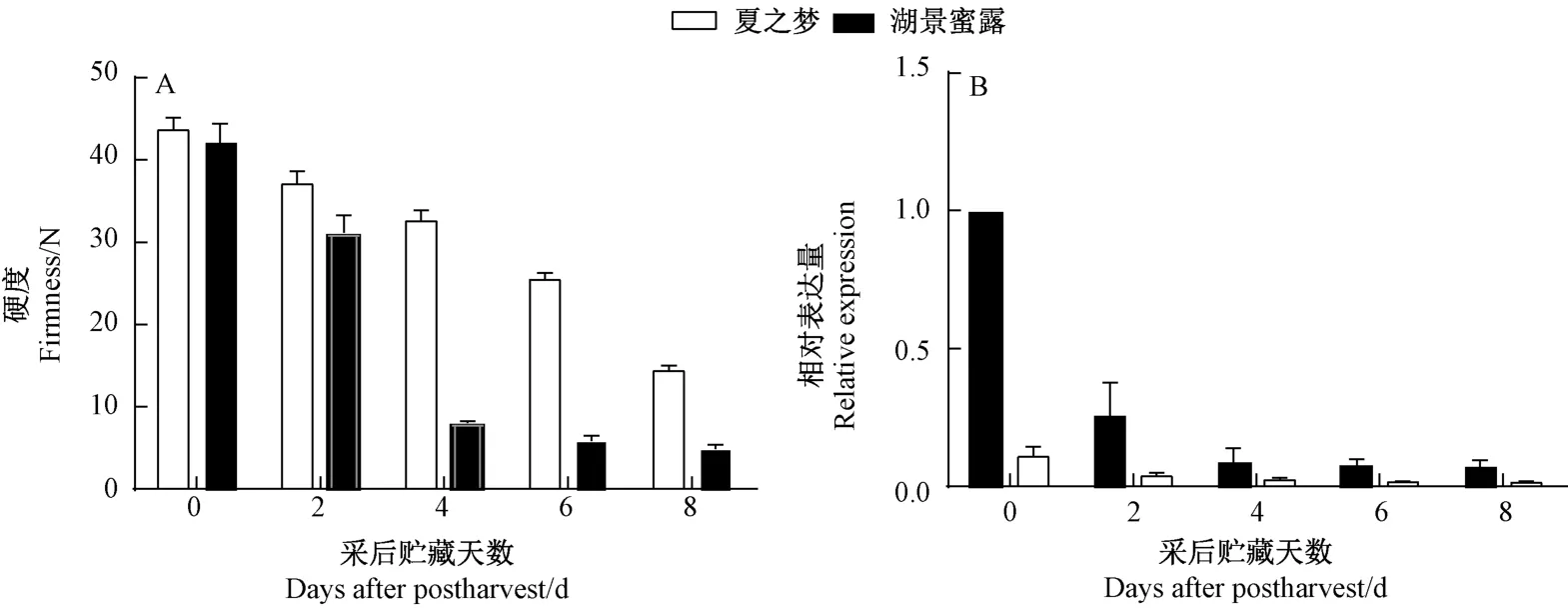
图7 采后贮藏过程中湖景蜜露和夏之梦果实硬度变化和PpPL1 基因的表达Fig.7 Firmness and PpPL1 gene expression of Hujing Milu and Xia Zhimeng during postharvest storage
本研究通过对桃基因组进行分析,共分离鉴定出20 个PL基因。 序列分析发现,所有的PL 蛋白都含有Pec-Lyase-C 结构域,但只有PpPL7、PpPL8、PpPL12 和PpPL17 含有Pec-Lyase-N 结构域,说明Pec-Lyase-N结构域可能是执行果胶裂解功能所必须的功能团,而Pec-Lyase-C 结构域可能与执行某些特异性的功能有关。 此外,20 个桃PL基因被不均匀地分布在8 条染色体上。 系统发育进化树分析表明,桃PL 蛋白可以分为Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ共5 个亚家族,每个亚家族的基因结构具有相似性,这与其他植物亚家族分类特性相同[17,26],揭示了PL基因在植物进化过程中的保守性和基因功能上的多样性。
研究表明,果胶裂解酶在果实成熟软化过程中发挥了重要的作用,在番茄和草莓中通过抑制果胶裂解酶基因表达显著延缓果实软化,达到延长果实贮藏期的目的[11,16-18]。 为研究PL基因在桃果实成熟软化中的作用,本试验利用转录组数据比较PL基因在溶质型桃黄金蜜3 号和硬质型桃有名中的表达差异,鉴定出3个高表达PL基因:PpPL1、PpPL2、PpPL15。PpPL2 和PpPL15 在溶质型和硬质型果实二次快速生长期(S3)和成熟期(S4I、S4Ⅱ和S4Ⅲ)都维持高表达,表明这2 个基因可能主要参与果实的发育而非软化过程;PpPL1 基因在溶质型桃黄金蜜3 号的快速生长期(S3)高表达,当进入成熟期(S4)后表达虽有下降但仍维持在较高的水平,而该基因只在硬质型桃有名快速生长期表达,进入成熟期后表达明显降低。 果实的发育过程是细胞分裂与细胞生长共同作用的结果,在细胞生长发生之前,首先需要使细胞壁变松散,然后才能完成细胞体积的增长,该过程与果实的软化类似,都需要细胞壁结构酶的作用。PpPL1 基因在2 种不同溶质型桃快速生长期都高表达而在软化阶段显著差异表达,说明PpPL1 基因可能既参与桃果实早期发育,又参与成熟后期的软化过程。 蛋白质序列比对揭示PpPL1 与番茄中软化相关的果胶裂解酶基因SLPL高度相似(72.8%),在Pec-Lyase-C 结构域及二级结构上高度保守[27],而遗传上PpPL1 与番茄SLPL基因同属果胶裂解酶Ⅰ亚家族,说明PpPL1 基因可能是参与桃果实成熟软化的主要基因。 为证明这一推断,本研究选取溶质型桃湖景蜜露和硬质型桃夏之梦为试验材料,验证PpPL1 基因表达与采后果实软化过程的相关性。 结果表明,PpPL1 在硬质桃夏之梦整个采后过程中表达量很低,而在溶质型桃湖景蜜露开始软化前高表达而后降低,表明PpPL1 基因表达与桃软化高度相关。
本研究结果表明,虽然PpPL1 基因在硬质型桃有名软化过程中未表达,但硬质型桃仍然有轻微的软化发生[19],表明桃的软化可能是多种细胞壁结构酶共同作用的结果。 Endo-PG 被认为是桃软化的主效基因,Endo-PG 在硬质型桃软化过程中仍然维持了低表达量,而这个低表达量也可能是导致硬质型桃轻微软化的原因[6]。 此外,Zhu 等[28]研究发现3 个果胶甲酯酶PME和5 个PMEI基因在溶质型桃果实中的表达显著高于硬溶质型桃,表明它们可能也与桃果实的软化相关。 Hayama 等[29]研究发现,乙烯在转录水平上调控PpPG、PpARF/XYL、PpExp3 等基因的表达,证明这些基因与桃果实成熟软化高度相关。 未来将利用外源乙烯及其抑制剂1-MCP 处理,进一步鉴定桃果实中受乙烯调控表达的PL基因,并通过反义基因沉默或基因编辑技术来抑制关键PL基因的表达,进而延缓果实软化进程,延长果实贮藏期。
4 结论
本研究分离鉴定了20 个桃PL基因,并对其在果实成熟与软化过程中的表达进行了分析。 结果显示,PpPL2 和PpPL15 可能参与了果实的发育过程,而PpPL1 可能是影响果实软化的主要基因。

