帕金森病关键基因及通路的筛选及其生物信息学分析
王璐茜 陈志博 郑晓露

[摘要] 目的 通过分析帕金森病患者与健康人基因芯片数据,寻找差异基因及其关键通路。 方法 利用GEO数据库中高通量基因芯片数据库筛选出帕金森病患者与健康对照的芯片。采用GO基因功能注释和KEGG通路富集分析,筛选出帕金森病的特征基因簇和通路,并进行蛋白质相互作用网络可视化分析。 结果 筛选出15个差异基因及7个关键节点蛋白。经差异基因分析后,发现神经丝、网格蛋白包被组装及多巴胺受体信号通路富集程度最高。 结论 本研究利用生物信息学方法,从不同的角度研究帕金森病的遗传学背景,在基因层面为帕金森病的诊断学标志与精准治疗提供新的思路。
[关键词] 帕金森病;差异基因;通路富集分析;生物信息学分析
[中图分类号] R742.5 [文献标识码] A [文章编号] 1673-9701(2020)12-0001-04
[Abstract] Objective To find out the differential genes and their key pathways by analyzing the gene microarray data of Parkinson's patients and healthy people. Methods The high-throughput gene chip database in the GEO database was used to screen the chips of Parkinson's patients and healthy controls. Go gene function annotation and KEGG pathway enrichment analysis were used, the characteristic gene clusters and pathways of Parkinson's disease were screened, and the network visualization analysis of protein interaction was performed. Results 15 differential genes and 7 key node proteins were screened. After differential gene analysis, it was found that neurofilament, clathrin-coated assembly, and the degree of dopamine receptor signaling pathway enrichment were the highest. Conclusion This study uses bioinformatic methods to study the genetic background of Parkinson's disease from different perspectives, and provides new ideas for the diagnostic markers and precise treatment of Parkinson's disease at the genetic level.
[Key words] Parkinson's disease; Differential genes; Pathway enrichment analysis; Bioinformatic analysis
帕金森病(Parkinsons disease,PD)是最常見的神经退行性疾病之一,亦是最为常见的运动障碍疾病。该病在65岁以上人群中患病率约为1%,在80岁以上人群中患病率高达约4%[1,2]。帕金森病的临床特征以运动障碍最为显著,包括运动迟缓、肌强直、姿势反射消失以及静止性震颤[3]。其典型病理特征是中脑黑质多巴胺能神经元的丢失,和残存神经元内异常蛋白包涵体即路易小体(Lewy body,LB)和路易突起(Lewy neurite,LN)的形成。其中,路易小体的主要成分是α-突触核蛋白(α-synuclein,α-syn)[1,4]。PD的病理机制尚未明确,目前最主流的假说认为:在不利因素的诱导下,神经元内的α-syn首先从单体或四聚体聚集为异常寡聚体,而后逐步形成多聚体、淀粉样纤维,最终聚集形成路易小体[5,6]。于此同时,有越来越多的基因被发现与PD尤其是家族性PD的发病有关,包括SNCA、LRRK2、VPS35、EIF4G1、DNAJC13和CHCHD2[7,8]。然而,目前已有的帕金森病相关基因的研究仍未帮助我们找到PD的确切发病机制及有效的病因治疗方法,以左旋多巴为首的药物对症治疗仍是PD的主要治疗手段[7]。因此,本研究旨在通过生物信息学的方法,对不同数据库中的PD基因信息进行整合、分析,从而找到PD中的差异表达基因(differentially-expressed gene,DEG)及其相关通路,为探索PD的遗传学病因和发病机制提供新的证据,现报道如下。
1 资料与方法
1.1 差异表达基因筛选
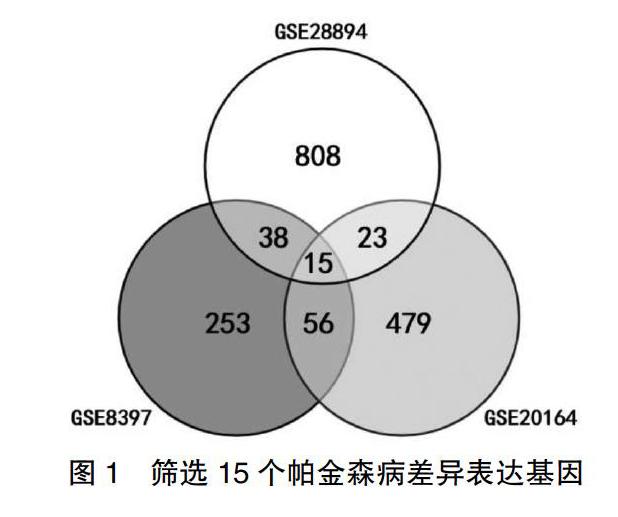
利用NCBI(National center for biotechnology information)平台下的GEO数据库进行DEG筛选。在GEO数据库中以“Parkinsons disease”、“Homo sapiens”、“tissue”为关键词搜索基因序列,排除微小RNA、线粒体DNA、非体内脑组织取材标本等相关数据,最终有3个数据集入选:GSE8397、GSE28894和GSE 20164。其中,GSE8397的数据出自GPL96平台,来源于24例PD患者和13例健康对照的纹状体样本;GSE28894的数据来源于15例PD患者和 15例健康对照的纹状体样本;GSE20164的数据来源于6例PD患者和5例健康对照的纹状体黑质样本。利用在线工具GEO2R(https://www.ncbi.nlm. nih.gov/geo/geo2r/)分析各个数据集,选取P<0.05,|logFC|>1的基因为候选差异基因。三个数据集中选取出的差异基因取交集,筛选出DEG。基因缩写列表见表1。
1.2 基因功能注释与通路富集分析
利用DAVID生物信息资源数据库(https://david.ncifcrf. gov/,版本6.8)中在线分析工具,以人源基因为背景进行GO(Gene ontology)和KEGG(Kyoto encyclopedia of genes and genomes)通路富集,设定P<0.05。
1.3 蛋白相互作用网络分析
利用Cytoscape 3.5.1(版本6.8)的蛋白相互作用网络分析插件MCODE(Version 1.4.2,Bader Lab,University of Toronto)对构建的生物学网络中的区域进行关联度分析。通过分析网络结构,根据关联积分值,可获得整个网络中可能形成的蛋白质簇和关键节点蛋白,并在Cytoscape中進行可视化显示。
2 结果
2.1 帕金森病中差异表达基因的筛选
经过对GEO数据库的检索,以下三个数据集的数据被纳入本研究:GSE8397、GSE28894和GSE20164。通过对该三个数据集中对照组与PD组之间的比较分析,分别确定了362、884和573个DEG,随后从中综合筛选出15个共同差异表达的基因,分别是RALYL、SYNGR3、NEFH、RGS4、HMP19、NEFL、CALY、CHGB、SYT1、INA、SLC18A2、FGF13、NSG1、GABBR2、STMN2。见图1。
2.2 DEG的基因功能注释与通路富集分析
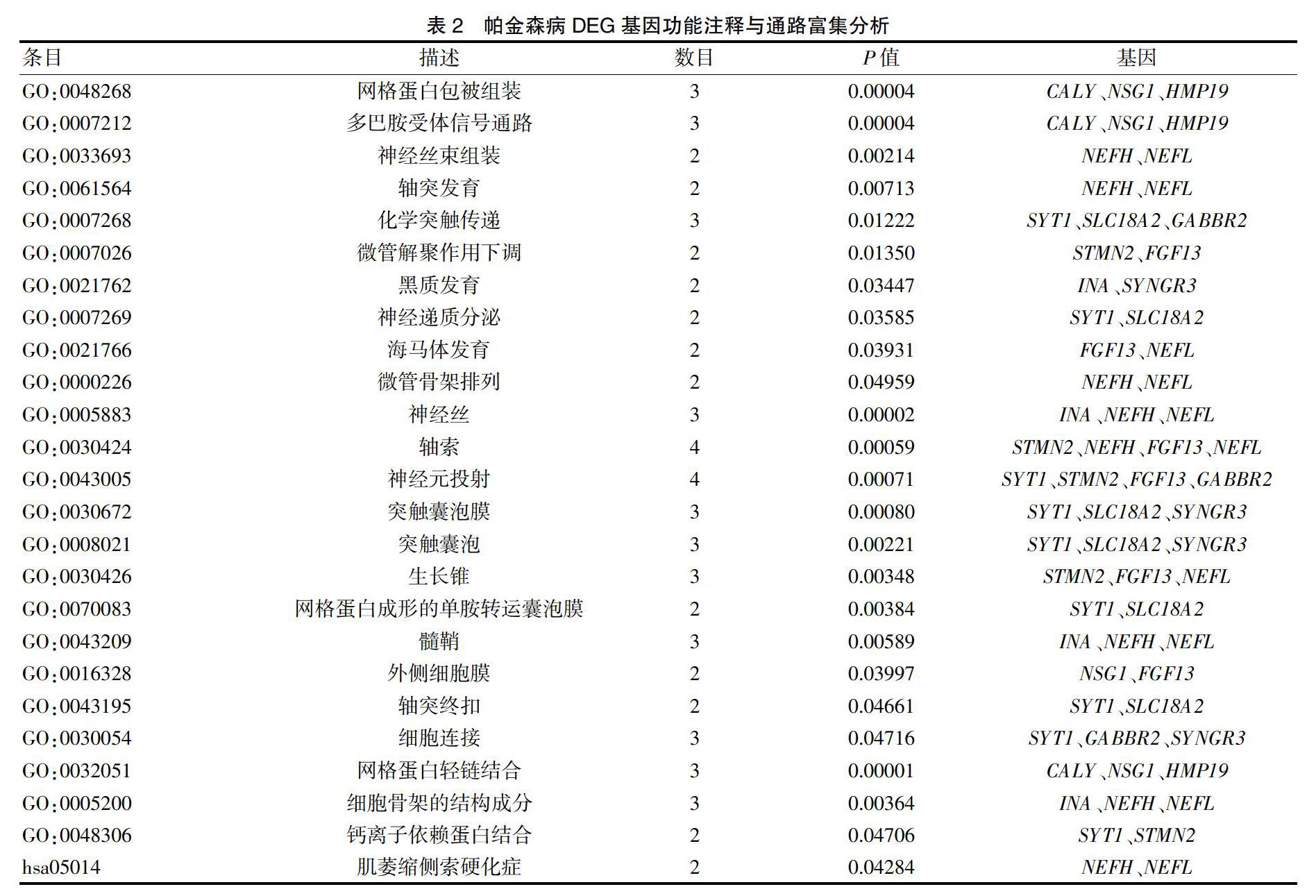
选取“2.1”中所筛选出的DEG,利用DAVID生物信息资源数据库中在线分析工具,以人源基因为背景进行GO(Gene ontology)和KEGG(Kyoto Encyclopedia of genes and genomes)通路富集,得出显著富集的基因功能24项及通路1条(P<0.05)。见表2。其中有3项基因功能富集因子较高、差异最为显著,分别是神经丝、网格蛋白包被组装及多巴胺受体信号通路,见封三图1;其涉及到的基因包括:INA、NEFH、NEFL、CALY、NSG1、HMP19。
2.3 蛋白相互作用网络可视化分析
通过对蛋白-蛋白相互作用进行评分,作出可视化网络,基于前述基因富集通路的蛋白相互作用构建网络。见图 2。从该网络中找出蛋白质簇及其中的关键节点蛋白,分别为NEFL、CALY、RALYL、CHGB、STMN2、SYNGR3、SYT1。见图3。
3 讨论
作为最常见的运动障碍疾病,帕金森病对患者(尤其是疾病晚期患者)的运动功能及生活质量造成了广泛而巨大的负面影响。然而,近几十年对帕金森病的大量研究仍未完全明确该病的发病机制,亦无法提供有效的病因治疗。
本研究通过GEO数据库检索获得了3个数据集中帕金森病患者基因芯片共45例,将其与健康患者进行比较,通过对基因芯片进行表达谱差异分析,基因功能注释和通路富集,最终筛选出帕金森病发病机制中的重要信号通路,并对其蛋白相互作用进行可视化作图。
本研究发现,PD的差异基因在神经丝、网格蛋白包被组装及多巴胺受体信号通路这三项基因功能中富集程度最高、差异最为显著。CALY、NSG1、HMP19这三个差异基因,则同时与多巴胺受体信号通路和网格蛋白包被组装有关。其中,NSG1与CALY(又名NSG3)同属神经元富含核内体蛋白(neuron-enriched endosomal protein)系,参与淀粉样蛋白前体的水解、轴突转运等多种功能[9]。值得关注的是,神经元内的α-突触核蛋白(α-synuclein,α-syn)聚集为异常寡聚体后逐步形成多聚体、淀粉样纤维,最终聚集形成Lewy小体,是目前主流公认的PD发病机制[5]。NSG1与CALY作为PD的差异基因,同时与淀粉样蛋白前体的水解作用有关,提示二者在PD发病过程中可能具有重要作用。另外,CALY亦是本研究中蛋白相互作用网络中的关键节点蛋白。CALY主要位于前额皮质及背侧纹状体区多巴胺D1受体表达的椎体细胞中,参与多巴胺相关通路并与D1受体上的多巴胺活性有关,同时与D1受体存在着直接的相互作用[10,11]。而黑质致密部中多巴胺能神经元的丢失正是帕金森病的基本病理特点之一[1,12]。经查阅,目前PD领域中尚无关于CALY、NSG1基因及其编码蛋白的研究,其在PD发病机制中究竟有何作用,在PD治疗领域有何价值,仍亟待更多的研究证实。
除CALY外,NEFL是本文在基因功能注释与蛋白相互作用网络可视化分析同时找出的另一个PD差异基因。近3年,外周血及脑脊液中NEFL蛋白浓度与帕金森综合征之间的联系逐渐引起了学界的重视。有研究曾对脑脊液NEFL浓度在PD诊断中的作用进行系统分析并发现,PD、帕金森病痴呆(Parkinsons disease dementia,PDD)、路易体痴呆(Dementia with lewy bodies,DLB)这三类病患者的脑脊液NEFL水平与健康人相仿,而多发性硬化(Multiple system atrophy,MSA)、进行性核上性麻痹(Multiple system atrophy,PSP)与皮质基底节变性(Corticobasal syndrome of suspected tau underlying pathology,CBS)这三类疾病患者的脑脊液NEFL水平则有明显升高,因此脑脊液NEFL浓度将有希望用以鉴别PD及其他非典型的帕金森病综合征[13]。另有研究表明,外周血中的NEFL水平具有相似的鉴别诊断作用[14]。与此同时却有研究发现PD患者的外周血NEFL水平与其痴呆水平呈正相关[15-17]。一篇于2019年最新发表的论文更是进一步提出,PD患者的外周血及脑脊液中的NEFL水平均远高于正常人[17]。结合本文结果,尽管NEFL在PD发病过程中的作用并不明确,该蛋白在帮助我们更加精准诊断与治疗帕金森病方面可能存在着巨大的价值。
SYNGR3是本研究筛选出的关键节点蛋白之一,位于神经元中的多巴胺相关转运体,表达于纹状体、海马体、小脑及中脑多巴胺能神经元等部位[18]。在PC12和MN9D细胞中,SYNGR3的表达不仅与多巴胺转运体(dopamine transporter,DAT)活性呈相关性,且可以被囊泡单胺转运体2(vesicular monoamine transporter type2,VMAT2)抑制剂利血平所阻断[19]。有研究发现PD患者和PD小鼠的黑质中SYNGR3都存在着显著的降低[20,21]。
以上2个差异基因与1个关键节点蛋白与PD发病之间的联系已经得到了体内及体外实验数据的支持,而其余差异基因与关键节点蛋白在PD尚无类似的研究,亟待RT-PCR和Western blot实驗在临床样本中进一步验证。受数据库数据所限,本研究也存在一定的局限性。本文采用的GEO数据库仅提供mRNA水平的数据,其蛋白表达与mRNA转录一致性仍有待明确。因此,帕金森病的特征基因仍需更深入的数据支持。
综上所述,本研究利用多种生物信息学方法从不同的角度研究帕金森病的遗传学背景,在基因层面为帕金森病患者的诊断学标志与精准治疗提供新的思路。
[参考文献]
[1] Lees AJ,Hardy J,Revesz T. Parkinson's disease[J]. Lancet (London, England),2009,373(9680):2055.
[2] Lau LMD,Breteler MM. Epidemiology of Parkinson's disease[J]. Proceedings of the Royal Society of Medicine,2006,5(6):525-535.
[3] Thomas B,Beal MF. Parkinson's disease[J]. Human Molecular Genetics,2007,16(R2):R183-R194.
[4] Dehay B,Bourdenx M,Gorry P,et al. Targeting α-synuclein for treatment of Parkinson's disease:Mechanistic and therapeutic considerations[J]. Lancet Neurology,2015, 14(8):855-866.
[5] Shahmoradian SH,Genoud C,Graff-Meyer A,et al. Lewy pathology in Parkinson's disease consists of a crowded organellar membranous medley[J]. bioRxiv,2017.
[6] Lashuel HA,Overk CR,Oueslati A,et al. The many faces of alpha-synuclein:From structure and toxicity to therapeutic target[J]. Nature Reviews Neuroscience,2013, 14(1):38-48.
[7] Kalia LV,Lang AE. Parkinson's disease[J]. Lancet(London,England),2015,386(9996):896-912.
[8] Bras J,Guerreiro R,Hardy J. SnapShot:Genetics of Parkinson's disease[J]. Cell,2015,160(3):570-571.
[9] Muthusamy N,Chen YJ,Yin DM,et al. Complementary roles of the neuron-enriched endosomal proteins NEEP21 and calcyon in neuronal vesicle trafficking[J]. J Neurochem,2015,132(1):20-31.
[10] Lezcano N,Mrzljak L,Eubanks S,et al. Dual signaling regulated by calcyon,a D1 dopamine receptor interacting protein [J]. Science,2000,287(5458):1660-1664.
[11] Bensmann W,Zink N,Arning L,et al. Dopamine D1,but not D2,signaling protects mental representations from distracting bottom-up influences[J]. Neuroimage,2020, 204:116243.
[12] Goedert M,Neurodegeneration. Alzheimer's and Parkinson's diseases:The prion concept in relation to assembled Abeta,tau,and alpha-synuclein[J]. Science(New York,NY),2015,349(6248):1255555.
[13] Andersen AD,Binzer M,Stenager E,et al. Cerebrospinal fluid biomarkers for Parkinson's disease—A systematic review[J]. Acta Neurol Scand,2017,135(1):34-56.
[14] Hansson O,Janelidze S,Hall S,et al. Blood-based NfL:A biomarker for differential diagnosis of parkinsonian disorder[J]. Neurology,2017,88(10):930-937.
[15] Lin YS,Lee WJ,Wang SJ,et al. Levels of plasma neurofilament light chain and cognitive function in patients with Alzheimer or Parkinson disease[J]. Sci Rep,2018,8(1):17368.
[16] Zerr I,Schmitz M,Karch A,et al. Cerebrospinal fluid neurofilament light levels in neurodegenerative dementia:Evaluation of diagnostic accuracy in the differential diagnosis of prion diseases[J]. Alzheimers Dement,2018, 14(6):751-763.
[17] Oosterveld LP,Verberk IMW,Majbour NK,et al. CSF or serum neurofilament light added to α-Synuclein panel discriminates Parkinson's from controls[J]. Mov Disord,2020,35(2):288-295.
[18] Belizaire R,Komanduri C,Wooten K,et al. Characterization of synaptogyrin 3 as a new synaptic vesicle protein[J].J Comp Neurol,2004,470(3):266-281.
[19] Ega?觡a LA,Cuevas RA,Baust TB,et al. Physical and functional interaction between the dopamine transporter and the synaptic vesicle protein synaptogyrin-3[J]. J Neurosci,2009,29(14):4592-4604.
[20] Simunovic F,Yi M,Wang Y,et al. Gene expression profiling of substantia nigra dopamine neurons:Further insights into Parkinson's disease pathology[J]. Brain,2009, 132(Pt 7):1795-1809.
[21] Miller RM,Callahan LM,Casaceli C,et al. Dysregulation of gene expression in the 1-methyl-4-phenyl-1,2,3,6-tetrahydropyridine-lesioned mouse substantia nigra[J]. J Neurosci,2004,24(34):7445-7454.
(收稿日期:2020-01-20)

