丁酸钠对肾草酸钙结石大鼠肠道菌群及炎症因子的影响
崔雅倩, 魏志涛, 曹 月, 张 慧, 李若琳, 王坤杰, 孙 群
(1.四川大学生命科学学院 生物资源与生态环境教育部重点实验室, 成都 610064;2.四川大学华西医院泌尿外科, 成都 610041)
1 引 言
肾结石是一种泌尿外科常见疾病,按照成分分为草酸钙结石、磷酸盐结石、尿酸结石、胱氨酸结石等,肾草酸钙结石是最常见的结石类型,约占肾结石总量的60%-90%.目前其他类型的肾结石成因逐渐明晰,如磷酸铵镁结石、碳酸磷灰石的发生主要与泌尿道菌群紊乱有关,但肾草酸钙结石的成因尚不确定.Miller[1]通过观察肾结石病人的肾脏发现肾乳头下方有Randall斑块,斑块会为肾草酸钙结石的生长提供支撑点,因此Randall斑在肾结石形成中起重要作用.肾脏髓袢局部的炎症反应是Randall斑形成中最可能的使动因素,而肠道菌群及其代谢产物短链脂肪酸、氧化三甲胺、脂多糖等影响着躯体及器官的炎症反应[2-5],所以肾草酸钙结石的形成可能是机体发生炎症的最终反映之一.
研究表明,肠道菌群与2型糖尿病、肥胖、冠心病、高血压等代谢性疾病的发生密切相关[6],而2型糖尿病、肥胖、冠心病、高血压等代谢性疾病患者更容易同时患有肾草酸钙结石[7,8].广西医科大学团队[9]发现,肾草酸钙结石患者和健康人的肠道菌群结构存在明显差异,如肾草酸钙结石患者肠道中促炎性细菌(Megamonas、Phascolarctobacterium、Escherichiacoli、Sutterella)水平显著升高;刘彧等[10]通过对160例中国肾草酸钙结石患者的粪便样本进行测序发现,患者的Blautia、Lachnospiraceae、Eubacteriumhallii、Faecalibacterium以及细菌代谢产物短链脂肪酸的丰度显著降低.Tang R[11]也发现肾草酸钙结石患者体内肠道菌群多样性低于正常人.以上研究均提示着肠道菌群与肾草酸钙结石的发生密切相关.李铎等[12]通过对肥胖人群进行饮食干预,发现高脂饮食肥胖人群拟杆菌门/厚壁菌门比值、Blautia和Faecalibacterium丰度显著低于低脂饮食肥胖人群,且高脂饮食肥胖人群血浆中促炎因子TXB2、LTB4、PGE2显著高于低脂饮食肥胖人群;赵立平等[13]研究发现肠道菌群通过提高短链脂肪酸含量、强化竞争性抑制,减少病原菌的生长,改善了机体炎症及2型糖尿病的发生;Pedret[14]发现肠道菌群双歧杆菌和Akk菌可产生短链脂肪酸,与低度炎症和2型糖尿病的发生呈负相关.以上研究表明肠道菌群可以通过改变其结构及代谢产物,改善躯体及器官的炎症,进而缓解代谢性疾病的发生.所以我们推测肠道菌群可能会影响系统性炎症及组织器官炎症,如肾脏、尿道等泌尿系统的炎症,影响泌尿系统的微生物菌群,进一步影响Randall斑的形成,进而影响肾草酸钙结石的形成.与泌尿系统菌群相比,肠道菌群的调控相对容易,这样可以发现影响肠道菌群的食物或药品或益生元等,间接影响草酸钙结石形成,从而可进一步开发相应的预防或治疗的药物和益生菌,故本研究重点探讨大鼠肾草酸钙结石的形成与肠道菌群的关系.丁酸钠[15]作为肠道菌群的主要代谢产物短链脂肪酸的一种钠盐,目前作为一种制剂应用于养殖业饲料中,可以改善肠道菌群结构,改善肠上皮细胞紧密连接功能,修复肠屏障功能,对维持肠道内稳态有重要的作用.此外,丁酸钠还可以通过激活GPR受体[16]、减少脂多糖受体TLR4[17],以调节IL-1β、IL-6、NF-κB p50等炎症因子的表达,从而抑制机体炎症的发生,进而可能影响与炎症发生相关的肾草酸钙结石的形成.本实验前期通过对肾草酸钙结石大鼠灌胃植物乳杆菌(实验室筛选出的菌株,产丁酸能力强),发现大鼠肾草酸钙结石成石率有所降低,且大鼠肠道内的丁酸含量显著增加,大鼠肠道内产短链脂肪酸及与炎症相关的细菌丰度有所变化,经换算后植物乳杆菌影响肠道菌群产生丁酸的含量为0.5 g/kg/d.丁酸在体内是一种半衰期短、代谢快的物质,本团队中刘彧等人前期通过不同剂量的丁酸钠灌胃肾草酸钙结石大鼠的预实验发现,大鼠在丁酸钠灌胃量为0.5 g/kg/d时死亡率为0.
为了探索作为乳杆菌产物的丁酸单独是否对肾草酸钙结石的形成有影响,结合前期预实验及参考文献[18],本研究通过乙二醇诱导大鼠肾草酸钙结石模型,同时给予丁酸钠干预(0.5 g/kg/d,每天一次),观察大鼠肾草酸钙结石数量、肠道菌群特定菌属数量及炎症相关因子的表达量的变化,初步探索丁酸钠干预大鼠肾草酸钙结石形成的可能机制.
2 材料与方法
2.1 材 料
2.1.1 主要材料与试剂 丁酸钠,乙二醇,4%中性甲醛固定液,乙醇,苏木精,伊红,OMEGA粪便DNA提取试剂盒,天漠RNA提取试剂盒,Prime Script RT reagent Kit With gDNA(Takara).
2.1.2 仪器与设备 Bio-rad CFX connect 荧光定量PCR仪,美国Bio-Rad公司;BA400Digital数码三目摄像显微镜,麦克奥迪实业集团有限公司.
2.2 实验方法
2.2.1 动物实验 8周龄SPF级SD雄性大鼠24只,购于四川省成都达硕生物科技有限公司,许可证号SCXK(川)2015-030,养于SPF级动物房,温度保持在25 ℃左右,湿度保持在60%,光照时间10~12 h.待大鼠适应环境后,将其随机分为对照组、肾草酸钙结石组、丁酸钠组,每组8只.所有大鼠均继续饲养无菌基础饲料,对照组自由饮水30 mL/d;肾草酸钙结石组自由饮水20 mL/d,每天上午固定时间灌胃1%乙二醇10 mL/d;丁酸钠组自由饮水19 mL/d,每天上午固定时间灌胃1%乙二醇10 mL/d及丁酸钠0.5 g/kg/d(0.5 g丁酸钠溶于0.95 mL生理盐水中)[18],每天灌胃一次,4 w后将大鼠处死,解剖取双肾、脾脏、肝脏、胸腺、结肠及盲肠内容物,称重,用液氮迅速冷却后保存于-80 ℃;并及时用4%中性甲醛固定液固定肾组织,以便及时观察.
2.2.2 肾组织切片制作及观察 固定组织经脱水、修剪、包埋、切片、染色、封片等,最后镜检,进行图像采集.每张切片先于40倍下观察全部肾脏组织,观察大体病变,选择要观察的区域采集100倍图片,观察具体病变.
2.2.3 特定菌属的qPCR检测 培养E.coli、Bacteroidesfragilis、Bifidobacterium、Faecalibacteriumprausnitzii、Lactobacillus、Roseburiaspp.、Enterococcusfaecalis,10倍梯度稀释,获得系列菌落数,提取细菌DNA,以此为模板进行qPCR.以qPCR反应的Ct值为纵坐标,菌落数的对数作为横坐标,构建标准曲线.依照粪便DNA提取试剂盒方法提取盲肠内容物总DNA,-20 ℃保存,以便进行实时荧光定量检测.各菌属的扩增引物如表1所示.根据各菌属的标准曲线计算菌落数.

表1 特定菌属qPCR扩增引物
2.2.4 炎症相关因子表达 提取结肠组织总RNA,反转录成cDNA,进行实时荧光定量检测,确定炎症相关因子TLR4、IL-1β、NF-κB p50的mRNA相对表达量.炎症相关因子的扩增引物如表2所示[19,20].用2-△△Ct法计算每个炎症因子相对于内参基因β-actin的mRNA相对表达量.
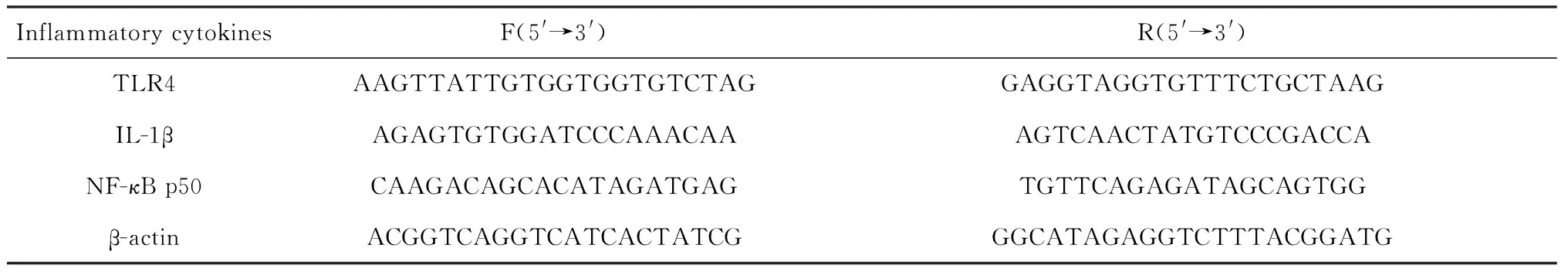
表2 炎症相关因子qPCR引物序列
2.2.5 统计分析 采用SPSS 22.0进行数据平均值、标准误差的计算和统计分析,P< 0.05为具统计学意义.
3 结果与分析
3.1 大鼠体重及脏器指数变化情况
大鼠适应环境后开始进行分组喂养,每周进行体重称量记录.大鼠解剖后取双肾、脾脏、肝脏和胸腺,称重,各组大鼠体重及脏器重量指数如表3所示.

表3 灌胃4周各组大鼠体重及脏器指数(x±SD)
注:不同字母上标代表显著性差异(P< 0.05)
灌胃前3 w各组大鼠体重无明显差异,总体呈上升趋势;第4 w对照组大鼠体重依然保持上升趋势,相较于对照组,肾草酸钙结石组与丁酸钠组大鼠体重显著降低(P< 0.05),丁酸钠组的体重略高于肾草酸钙结石组,但无显著性差异(P> 0.05).结合已有研究表明,乙二醇成石剂的加入对肠粘膜有损伤,可能会使大鼠造成肠炎,进而影响大鼠食欲,使体重降低;加入丁酸钠对大鼠肠道粘膜炎症有所改善,进而影响大鼠体重.各组之间的脾脏、肝脏、胸腺重量无显著差异,加入乙二醇成石剂造模后,大鼠肾脏有肾草酸钙结晶沉淀,增加大鼠肾脏重量,表明造模成功.
3.2 肾组织草酸钙结晶沉积情况的观察和评估
3.2.1 HE染色切片观察 肾组织HE染色切片在光学显微镜下观察,对照组皮质区、髓质区、肾乳头区均未见草酸钙结晶沉积;肾草酸钙结石组皮质区和髓质区可见结晶沉积,部分肾乳头区可见结晶沉积;丁酸钠组部分皮质区和髓质区可见结晶沉积,乳头区几乎未见结晶沉积.

图1 各组肾组织切片HE染色(×100)A:对照组;B:肾草酸钙结石组;C:丁酸钠组 (结晶沉积(↑)肾小管扩张伴上皮扁平(◇)纤维增生(△))Fig.1 HE staining of kidney tissue sections in each group (×100) A: Control group; B: Renal calcium oxalate stone group; C: Sodium butyrate group
由图1可知,对照组(1A)肾脏组织被膜较为完整,皮质和髓质分界较为清晰,未见结缔组织增生及炎性渗出;皮质区肾小球未见毛细血管基底膜或基质增生,无变性、坏死及纤维化;肾曲小管、髓袢及髓质内集合小管偶见上皮细胞空泡变性,管腔内无细胞管型或蛋白管型,间质内无充血及炎细胞浸润;髓质区集合管未见细胞明显变性坏死.肾草酸钙结石组(1B)肾脏组织被膜较为完整,皮质和髓质分界较为清晰;其中2例标本有少量肾小球轻度变性坏死,部分基底膜增厚;7例标本存在肾小管不同程度扩张,部分伴随上皮细胞扁平化,肾小管变性坏死区域间质内见少量纤维组织增生,呈纤维细胞核呈梭形,部分伴有少量炎细胞浸润,主要为淋巴细胞;6例标本的肾皮质和髓质肾小管管腔内少量或散在不着色、带折光性的透明结晶沉积.表明乙二醇成石剂对肾脏造成损伤,且有成石出现,提示造模成功.丁酸钠组(1C)肾脏组织被膜完整,皮质和髓质分界清晰,肾小球结构完整清晰,未见毛细血管基底增厚及炎性渗出,部分切片有带折光性的透明结晶沉积,部分上皮细胞坏死,少量管腔内见细胞残片和炎细胞混合,少量可见细胞管型;间质内少量炎细胞浸润和纤维组织增生.
3.2.2 肾脏损伤评分统计结果 在100倍光镜下观察,至少5个视野(肾皮质区域3个视野,肾髓质和肾乳头2个视野),结晶数量判定方法:0pt,无任何结晶亮点;1pt,有一定散在结晶亮点;2pts,广泛散在结晶亮点,不成堆;3pts,广泛结晶亮点成堆或连接成片.记录每个区域的结晶数量得分,计算肾脏损伤程度.由表4可知,与肾草酸钙结石组相比,丁酸钠组肾脏损伤评分显著降低(P< 0.01),表明丁酸钠加入可减弱乙二醇对肾组织造成的损伤.

表4 肾脏损伤评分统计结果(x±SD)
注:丁酸钠组与肾草酸钙结石组相比,*P< 0.05**P< 0.01.
综上,肾损伤评分统计结果和病理描述可知,肾草酸钙结石组病变,造模成功,丁酸钠组病变减轻,表明丁酸钠的加入可减少肾草酸钙结晶数量,减缓肾损伤.
3.3 肠道菌群特定菌属qPCR检测
通过qPCR分别检测对照组、肾草酸钙结石组及丁酸钠组大鼠盲肠内的总菌、Enterococcus、E.coli、Bacteroidesfragilis、Bifidobacterium、Faecalibacteriumprausnitzii、Lactobacillus、Roseburiaspp .、Bacteroidetes、Firmicutes数量,以各个菌属数量/总菌数表示各个菌属相对丰度.结果表明,三组大鼠盲肠内总菌数无显著差异(P>0.05).如图2所示,三组大鼠盲肠内容物中Bifidobacterium、Faecalibacteriumprausnitzii、Roseburiaspp.相对丰度无显著差异(P> 0.05).与肾草酸钙结石组相比,丁酸钠组的Enterococcus相对丰度显著减少(P< 0.05),革兰氏阴性细菌Bacteroidesfragilis、E.coli相对丰度显著减少(P< 0.05),表明N-1可改善肠道菌群结构,调节肠道菌群紊乱,减少革兰氏阴性细菌的丰度,进而可能会减少其代谢产物脂多糖的产生,减少机体炎症的发生.

图2 各组大鼠盲肠内容物中不同菌属的相对丰度Fig.2 Relative abundance of different bacterial species in the cecum contents of rats
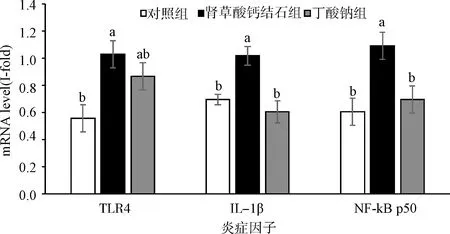
图3 各组大鼠TLR4、IL-1β、NF-κB p50的mRNA表达水平Fig.3 The expression levels of mRNA of TLR4, IL-1β, and NF-κB p50 in rats
3.4 结肠炎症相关因子qPCR检测
TLR4可以识别革兰氏阴性菌代谢产物脂多糖(LPS),并通过TLR4-MyD88-NF-κB或TLR4-MyD88-MAPK等通路激活下游的炎症因子.如图3所示,肾草酸钙结石组TLR4、IL-1β、NF-κB p50的mRNA表达量显著高于对照组(P< 0.05),表明肾草酸钙结石大鼠的结肠有炎症发生;与肾草酸钙结石组相比,丁酸钠组的IL-1β、NF-κB p50的mRNA表达量显著降低(P< 0.05),TLR4的mRNA表达量降低但无显著差异(P> 0.05).提示丁酸钠的加入可能会减少脂多糖的含量,使脂多糖受体TLR4有减少趋势,进而抑制下游促炎因子IL-1β、NF-κB p50的表达,抑制结肠组织炎症的发生,减少结肠炎症因子透过肠屏障循环入血,缓解机体及肾脏等器官炎症的发生.
4 讨 论
肾结石是泌尿外科常见疾病,目前常用的治疗方法是手术疗法,但面对肾结石的高发生率和高复发率,仅仅依靠肾结石形成后进行手术治疗并不是长久之计,更关键的是找到干预肾结石形成的有效方法.二十世纪三四十年代,Randall发现以他名字命名的Randall斑的存在,之后人们开始在肾结石患者中广泛的观察到Randall斑,而Randall斑的形成很大程度受炎症的影响,人体内的肠道菌群又与躯体器官组织的炎症状态紧密相连,其通过影响肠道菌群结构和肠道菌群代谢物影响肠屏障功能及局部、系统性炎症发生.所以推测,肾草酸钙结石的形成是肠道菌群结构紊乱,系统性炎症的最终体现.丁酸钠是短链脂肪酸的一种钠盐,已有研究证明其可调节肠道菌群,缓解机体炎症.Xu等[15]通过对糖尿病小鼠进行丁酸钠干预,调节了小鼠的肠道菌群结构,改善肠屏障功能,改善糖尿病小鼠的炎症.Xu J等[21]发现丁酸钠可增加初生仔猪肠道菌群多样性,调节IL-6、IL-8、IFN-γ、IL-10、TGF-β、HDAC等炎症因子,提示口服丁酸钠有益于初生仔猪的健康.目前肾草酸钙结石无有效的临床干预手段,鲜少有人研究丁酸钠对肾草酸钙结石形成的影响,故本实验应用乙二醇造肾草酸钙结石大鼠模型,通过观察丁酸钠对大鼠肾草酸钙结石数量、肠道菌群及炎症相关因子的影响,探索其干预肾草酸钙结石形成的可能机制.
人体的健康与肠道菌群结构息息相关,正常情况下有益菌、有害菌和中性菌结构稳定,与宿主、环境保持动态平衡[4].机体发生病变如肾草酸钙结石时,肠道菌群结构紊乱,如革兰氏阴性细菌E.coli、Bacteroidesfragilis数量增多,产生的内毒素增多,使肠屏障功能下降,刺激细胞炎症因子,诱发局部或全身炎症,这一结果与Soares的研究相似[22].本实验中丁酸钠的加入可以减少E.coli、Bacteroidesfragilis含量,同时减少机会感染菌Enterococcus的含量,可能会抑制炎症的发生.
TLR4是脂多糖受体,是常见的激活炎症信号通路的蛋白质分子.IL-1β、IL-6、NF-κB等是脂多糖刺激TLR4后作出应答的主要促炎因子,本实验中IL-1β、NF-κB p50的mRNA表达水平在肾草酸钙结石组显著增加(P< 0.05),在丁酸钠组显著下降(P< 0.05).Chen等[16]通过丁酸钠改善了LPS引起的炎症反应和肠上皮屏障功能障碍,具体是通过减少TLR4的表达,抑制AKT和NF-κB p65信号通路产生影响,本研究结果与之相似.
综上所述,丁酸钠可减少肾草酸钙结石大鼠肠道菌群E.coli、Enterococcus、Bacteroidesfragilis相对丰度,改善肠道菌群失衡;影响结肠炎症相关因子IL-1β、NF-κB p50的mRNA表达,抑制炎症的发生,从而减少肾草酸钙结晶数量.关于丁酸钠如何通过大鼠肠道菌群代谢产物影响炎症发生,推测与脂多糖、短链脂肪酸有关,有待进一步研究.

