TGF-β1在放射性颌骨骨髓炎发病过程中对骨髓间充质干细胞的影响及其分子机制的体外研究
贾骏麒 赵路 陈媛丽 张哲儒 宗春琳 田磊
放射性颌骨骨髓炎(osteoradionecrosis of jaws, ORNJ)是颌面部恶性肿瘤放射治疗的最严重并发症之一,发病率高达5%~40%[1-2],并在放疗后拔牙的患者中发病率显著升高[3]。ORNJ可导致创口不愈、死骨形成、骨面外露、皮肤黏膜瘘道形成等后果;且病变不具有自限性,一旦发生迁延不愈进而造成病理性骨折,影响颌面部功能和容貌,严重者甚至造成死亡[4]。ORNJ的发病机制至今尚未完全阐明,近年来较为广泛接受的放射性纤维萎缩学说[5]认为其是一种放射所导致的以局部组织肌成纤维细胞(myofibroblasts,MFB)分化、胶原基质分泌等为主要特征的放射性纤维化疾病[6]。
在前期研究中我们发现下颌骨局部骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs),BMSCs是ORNJ中MFB的来源之一,转化生长因子β1(transforming growth factor-β1,TGF-β1)可能在这一过程中起到一定作用[7-8],TGF-β1表达的升高与组织纤维化具有重要关系[9]。还原型烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)氧化酶NOX家族亚型NOX4在肝纤维化疾病过程中可介导成纤维细胞向MFB发生分化[10]。本实验围绕放射线对BMSCs的作用,以TGF-β1为研究靶点,对TGF-β1在ORNJ发病过程中的作用及其与NOX4表达合成之间的关系进行研究,为ORNJ的防治提供理论参考。
1 资料与方法
1.1 细胞来源、鉴定及分组
原代BMSCs取自2 周龄雄性SD大鼠,麻醉处死后分离股骨,剪断两端骨骺后用加压冲洗骨髓腔,细胞待传至P3代后备用。显微镜下观察细胞形态,并用流式细胞技术检测细胞表面标志物CD34、CD44、CD45进行鉴定。
接种细胞至6 孔板中,待生长稳定后设置细胞分组为:空白对照组:P3代BMSCs不做任何干预; 实验组1:BMSCs+辐照; 实验组2:BMSCS+TGF-β1中和抗体(sigma,美国)+辐照; 实验组3:BMSCS+外源性TGF-β1(BioVision,美国); 实验组4:BMSCs+siNOX4+辐照;实验组5:BMSCs+siNOX4+外源性TGF-β1。
1.2 射线来源及参数设置
放射线来源于陕核工业咸阳第二一五医院放疗科CX5762型放射治疗机(VARIAN,美国),射线性质属高能X射线,设置射线能量为6 MeV,剂量率为4 Gy/min,单次照射剂量为4 Gy。
1.3 siNOX4转染及效率鉴定
构建对NOX4的转录具有沉默作用的小分子RNA(small interfering RNA, siRNA)siNOX4: 5′-GCUUCUACCUAUGCAAUAA-3′(正义链)、 3′-CGAAGAUGGAUACGUUAUU -5′(反义链)(广州锐博生物)。对P3代BMSCs细胞按试剂盒说明书,进行转染24 h后进行qPCR检测NOX4基因表达水平,并加入外源性TGF-β1, 7 d后免疫荧光法检测NOX4合成水平鉴定转染效率。
1.4 细胞生长活性以及ORNJ相关蛋白表达测定
倒置显微镜对各组细胞形态进行观察,在第 1、 2、 3、 4、 5、 6、 7 天进行CCK8(Thermo Fisher Scientific,美国)染色,酶标仪读取A值并绘制生长曲线。Western-blot法检测各组中TGF-β1以及MFB特异性标志蛋白α-SMA 合成情况。
1.5 统计学分析
采用SPSS 19.0软件进行ANOVA分析,P<0.05时认为差异具有统计学意义。
2 结 果
2.1 细胞形态观察
空白对照组细胞呈短梭形,形态较完整。射线和外源性TGF-β1可造成细胞形态不规则、密度减小,并可观察到大量破碎的细胞结构。TGF-β1中和抗体和siNOX可以明显减轻细胞形态的破坏(图 1)。
2.2 细胞生长能力
绘制细胞生长曲线(图 2)观察细胞生长能力变化。可见空白对照组细胞在接种初期短暂适应后于第3 天开始明显增殖,于第5 天左右生长明显放缓,达到平衡状态。射线和外源性TGF-β1在干预后第3 天开始造成细胞生长的明显抑制,在第7 天细胞生长几乎停滞。TGF-β1中和抗体、siNOX4的应用可以在一定程度上保护细胞的增殖能力。
2.3 TGF-β1合成水平的检测
射线可引起细胞TGF-β1合成的升高,并无法通过抑制NOX4表达降低TGF-β1的合成。中和抗体对TGF-β1具有较好的中和效果(图 3)。
2.4 NOX4合成的检测
射线和外源性TGF-β1可造成细胞NOX4合成的明显升高,应用TGF-β1中和抗体可部分降低NOX4的合成水平(图 4)。
2.5 α-SMA合成的检测
射线和外源性TGF-β1均可以造成α-SMA合成量的增加,TGFβ1中和抗体和siNOX4的应用可以显著降低α-SMA的合成,但后者的抑制合成作用低于前者(图 5)。
3 讨 论
对BMSCs施加4Gy剂量的X线照射后出现了MFB特异性蛋白α-SMA合成分泌的增多,以及细胞增殖能力下降等现象,与ORNJ的疾病行为及病理表现相契合,验证了本实验所用细胞辐照模型较强的科学性与适用性。TGF-β1是一种广泛存在于多种病理生理过程中的细胞因子,免疫细胞化学研究表明TGF-β1是放射性纤维化中最主要的细胞因子[11]。NOX家族则是通过过表达产生大量活性氧从而引起氧化压力增加,与机体多种疾病的发生紧密相关,诱导了多种疾病的发生、发展,其中NOX4 被广泛认为是多种纤维化疾病发生过程中的重要环节[12-13]。本实验通过对体外培养的 BMSCs 施加适合剂量的放射线,观察到TGF-β1和NOX4的合成水平较对照组显著升高,进一步证实了TGF-β1是BMSCs 对放射线电离辐射作用的产物;同时,NOX4表达的升高也提示了氧化应激损伤可能是导致ORNJ纤维化发生的重要因素。
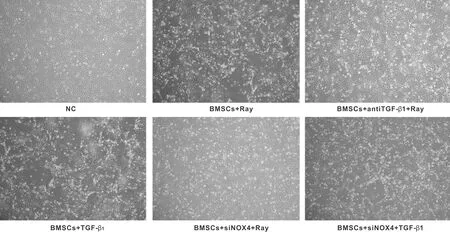
图1 射线、 TGF-β1、TGF-β1中和抗体、 siNOX4对细胞形态的影响 (倒置显微镜,×40)
Fig 1 The effects of radiation, TGF-β1, TGF-β1neutralizing antibody and siNOX4 on cell morphology (Inverted microscopy, ×40)

图2 射线、TGF-β1、TGF-β1中和抗 图 3 射线、中和抗体及siNOX4对TGF-β1合成水平的影响体、siNOX4对细胞增殖的影响
Fig 2 The effects of radiation, TGF - β1, Fig 3 The effects of radiation, neutralizing antibody and siNOX4 on TGF - β1neutralizing antibody TGF-β1synthesis level and siNOX4 on cell proliferation

图 4 射线、 TGF-β1对NOX4合成水平的影响 (×100)
Fig 4 The effects of X-ray and TGF-β1on the synthesis level of NOX4 (×100)
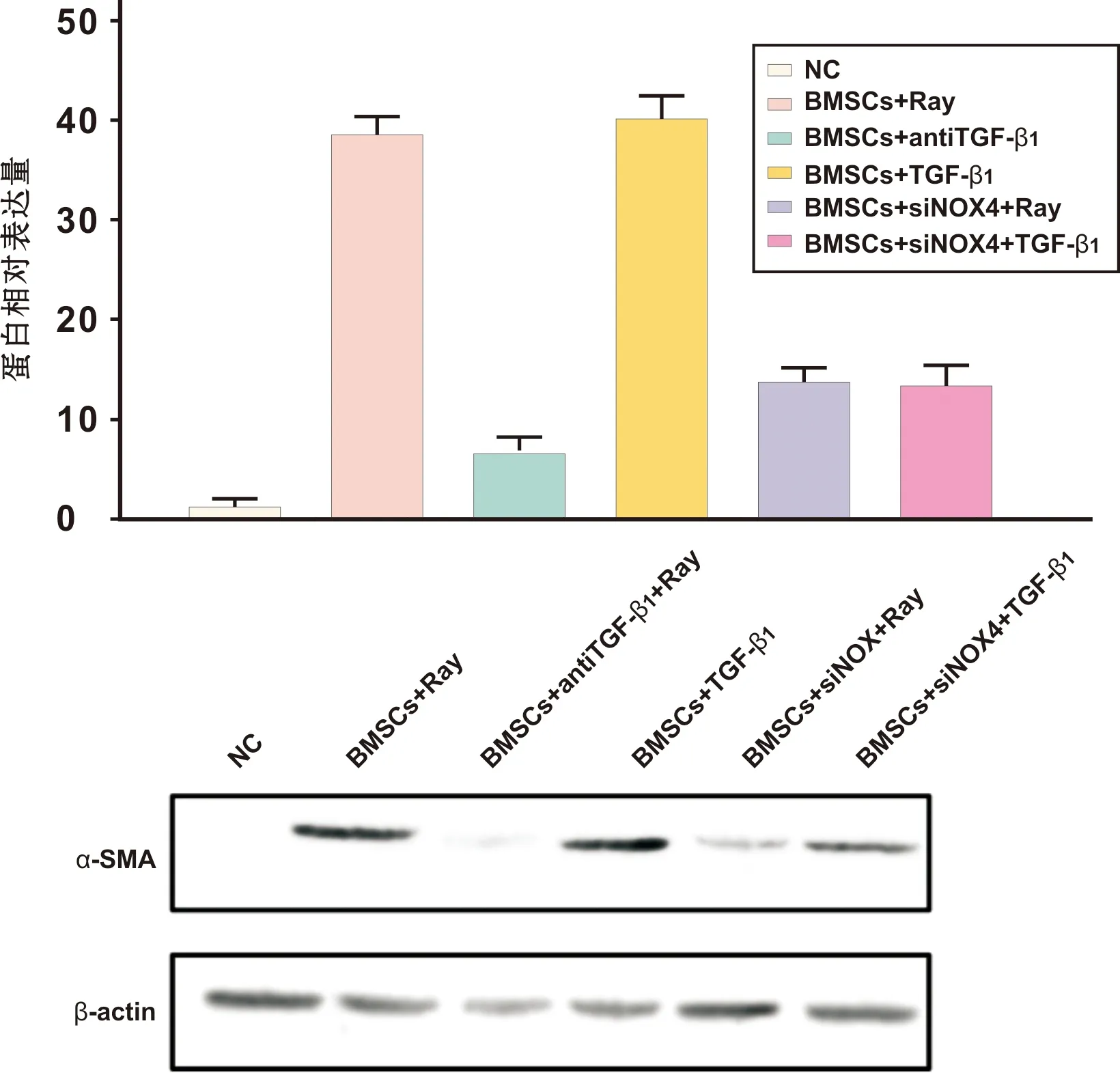
图 5 射线、TGF-β1及siNOX4对α-SMA合成量的影响
Fig 5 The effects of radiation, TGF-β1and siNOX4 on α-SMA synthesis
为揭示TGF-β1在ORNJ疾病发展中的作用,本研究对BMSCs进行外源性TGF-β1的干预,观察到与射线对BMSCs的作用效果相似的NOX4、α-SMA合成的增多、细胞增殖能力下降等一系列现象,证实TGF-β1导致BMSCs中α-SMA合成的增多作用与放射线的电离辐射损伤高度类似,且TGF-β1极有可能是导致NOX4表达升高的重要因素。同时,用抗体中和TGF-β1的作用,观察到放射线的促BMSCs中NOX4与α-SMA合成作用以及抑制细胞增殖的作用减弱。上述实验结果表明TGF-β1合成的增多可能是放射线对BMSCs的作用中NOX4与α-SMA合成增多、细胞增殖能力下降的关键环节。用siRNA抑制NOX4表达后对细胞进行的照射实验中,观察到α-SMA水平较单纯照射组有一定下降。说明NOX4在一定程度上参与了射线对BMSCs向MFB分化的过程。此外,抑制NOX4的表达还可以缓解射线对细胞增殖的抑制作用,提示NOX4也参与了是射线电离辐射对BMSCs的细胞损伤作用。
对siNOX4转染后的BMSCs进行辐照,其TGF-β1合成水平较单纯照射组无明显改变,说明NOX4未参与射线对BMSCs的促TGF-β1合成作用。有研究表明NOX 4可以介导TGF-β1对内皮细胞的凋亡和表型变化[14],那么对于ORNJ中的BMSCs是否也有类似的作用?为进一步明确TGF-β1与NOX4这两种重要细胞损伤产物之间可能存在的关系,将外源性TGF-β1作用于siNOX4转染的BMSCs。观察到抑制NOX4表达合成后,除α-SMA的表达合成部分下降外,细胞形态损伤、生长抑制等现象均得到一定缓解。上述现象说明NOX4可能是TGF-β1诱导BMSCs中细胞损伤和增殖抑制的重要分子机制之一,并部分参与了TGF-β1的促MFB分化作用。
综合上述系列实验结果可以得出结论:放射线作用于BMSCs后首先诱导了TGF-β1合成水平的升高,进而诱导了BMSCs向MFB发生分化,并导致细胞结构破坏、细胞增殖抑制等现象的发生。在这一过程中,NOX4 作为重要中间环节,参与了TGF-β1对BMSCs的细胞破坏和增殖抑制作用,并部分参与了TGF-β1的促MFB分化作用。本实验结果提示抑制TGF-β1的表达和/或合成可能是防治ORNJ的有效途径。但由于TGF-β1是体内的一种关键细胞因子,其作用广泛而复杂,牵涉众多细胞和器官的功能。为避免抑制TGF-β1所带来的全身其他负面影响,将NOX4作为防治靶点也可有效缓解射线带来的组织细胞坏死、纤维化形成等后果,具有较高的临床指导意义。

