六种蛋白质与生物纳米磁珠的吸附性能研究
王萌慧 高瑛 李家璜,2 华子春,2
(1. 南京大学生命科学学院 医药生物技术国家重点实验室,南京 210023;2. 江苏省产业技术研究院医药生物技术研究所 常州南京大学高新技术研究院,常州 213164)
生物纳米磁珠是由复合铁氧体强磁核、磁核外层的高分子壳层材料构成的磁性微球,又称磁珠。磁珠表面能够包裹功能基层,如各种离子、抗体、抗原、核酸和酶等,被应用于靶向药物载体、细胞分离、核酸和蛋白生物大分子的分离、免疫检测、微生物检测、固定化酶等多个生物领域[1-4]。近年来,磁珠以其分散性良好、对生物分子的结合快速有效、絮凝可逆可控等优点,在生物技术和生物医学领域受到了广泛关注[5-6]。
利用磁珠表面的功能基层与蛋白质的特异性吸附,可以进行蛋白质的富集纯化或者用于免疫检测[7-9]。以表面经过特殊修饰的磁珠作为工具,对蛋白质进行分离浓缩,是一种简便快捷的蛋白质纯化技术。Lin等[10]合成氨基苯硼酸修饰的磁珠,用以吸附和提纯糖蛋白;Uygun等[11]制备了磁性纳米珠,用于从鸡卵清蛋白中纯化溶菌酶,纳米珠对溶菌酶的吸附能力良好。表面包裹抗体或抗原的免疫磁珠可用于免疫检测,利用免疫磁珠的生物标记对肿瘤的生物标志物进行检测,近年来已经引起研究者们很大的研究兴趣。Feng等[12]使用免疫磁珠可快速检测前列腺特异性抗原;Pan等[13]用固定化癌胚抗原抗体的磁性纳米颗粒作为免疫传感器,可以检测人血清中的癌胚抗原。
无论对于蛋白质的分离纯化还是免疫检测等,磁珠表面与蛋白质的非特异性结合都是不利的。一方面,非特异性吸附会影响纯化蛋白的纯度和磁珠载量;另一方面,非特异性吸附容易干扰免疫检测的结果,导致检测结果的假阳性。例如,林梅双[14]利用磁珠吸附浓缩乙型肝炎表面抗原(HBsAg)阳性血清中的HBsAg,虽然提高了抗原浓度,但是洗脱液中有较多的与磁珠非特异性吸附的杂蛋白;石若冰等[15]使用Cu2+螯合的磁性微球纯化大肠杆菌表达的镇痛抗肿瘤多肽,用200 mmoL/L的咪唑溶液可完全洗脱多肽,但同时也包含了与磁珠非特异性吸附的杂蛋白;田晶晶等[16]为避免由于非特异性吸附造成检测结果的假阳性,研究不同的偶联缓冲液,从而改善蛋白与磁珠的非特异吸附程度。纳米磁珠对蛋白质的非特异性吸附是一直存在的问题。
为研究蛋白质与磁珠的非特异性吸附,本实验选取两种无功能基层的普通纳米磁珠,分析6种不同的蛋白质与磁珠吸附的行为,探讨蛋白质理化性质及结构与非特异性吸附之间的关联。选取的磁珠A和磁珠B均为二氧化硅包被的四氧化三铁磁性纳米颗粒,磁珠A的粒径为500 nm,磁珠B的粒径为400 nm。在水溶液中,磁珠的二氧化硅表面会形成大量羟基,这类磁珠可以用来特异性提取核酸,而不会与蛋白质等其他杂质结合,进而用来研究磁珠与蛋白质的非特异性结合。依据蛋白与磁珠吸附的特异性、蛋白结构、蛋白实用性及蛋白大小,本实验选取了6种蛋白。选取的磁受体蛋白(dMagR)是为数不多的可以与磁珠特异性结合的蛋白[17-18],选取磁受体蛋白突变体(dMagR mutant)作为与磁珠特异性吸附的阴性对照。此外,考虑到蛋白的二级结构及实验室中的实用性,选取了人膜联蛋白A5(Annexin A5)和人肿瘤坏死因子 -α(TNFα)。考虑到蛋白大小,选取了基于上述2种蛋白的融合蛋白——磁受体蛋白-红色荧光蛋白(dMagR-RFP)和人膜联蛋白A5-增强绿色荧光蛋白(Annexin A5-EGFP)。分析该6种蛋白与磁珠的吸附作用,并采用计算机分析蛋白质的结构与性质,探讨蛋白质的性质和结构与磁珠非特异性吸附的关系,旨为纳米磁珠在生物医学中的应用提供一定的借鉴意义。
1 材料与方法
1.1 材料
1.1.1 菌株 于南京金斯瑞公司合成dMagR的基因序列,将其活性位点的3个半胱氨酸突变为3个丙氨酸成为dMagR mutant,RFP基因片段来自于本实验室,使用pET28a(+)质粒,构建表达不同蛋白的BL21菌株(表1)。所有菌株均为卡那霉素抗性。
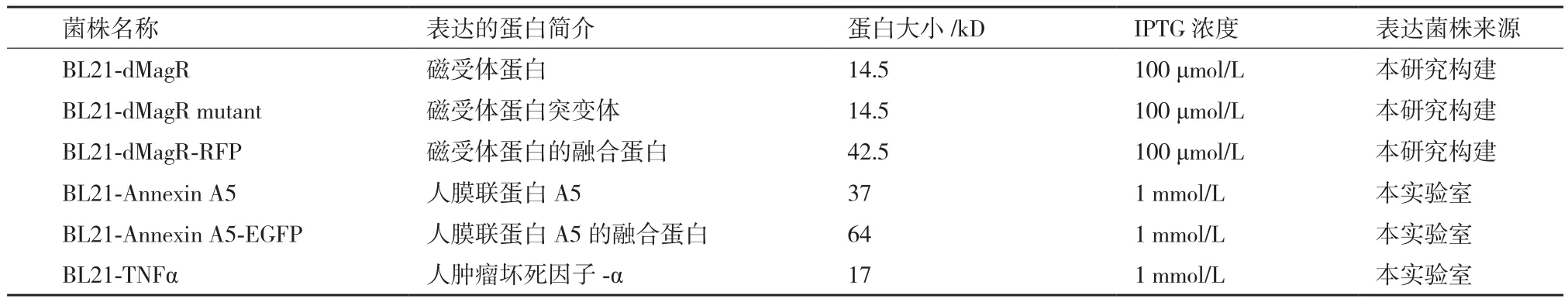
表1 表达不同蛋白的菌株
1.1.2 试剂与仪器 纳米磁珠A(二氧化硅包被的四氧化三铁磁性纳米颗粒,粒径500 nm)和纳米磁珠B(二氧化硅包被的四氧化三铁磁性纳米颗粒,粒径400 nm),大肠杆菌表达菌株BL21(DE3),卡那霉素(K+),异丙基-β-D-硫代半乳糖苷(IPTG),恒温摇床,磁力吸附架,高压细胞破碎机(永联生物科技公司,上海),MOE2019软件(Chemical computing Group ULC,加拿大),Discovery Studio 2.55软件、Discovery Studio 2017R2客户端软件(BIOVIA公司,美国)。
1.2 方法
1.2.1 蛋白表达 将上述菌株以1%接种量,接种于LB培养基中,先37℃,220 r/min于摇床中培养至OD600为0.6-0.8,再降温至20℃,转速降低至150 r/min,按照表1添加诱导剂,诱导表达16-18 h后收菌,用一定体积的TBS缓冲液(20 mmol/L Tris,150 mmol/L NaCl,pH 8.0)重悬,保证不同菌株的重悬裂解液OD值相同,用高压细胞破碎机裂解细菌获得菌体裂解液,用于后续磁珠吸附实验。
1.2.2 磁珠吸附 将10 mg/mL的磁珠溶液200 μL与500 μL的表达不同蛋白的菌体裂解液(磁珠孵育液)混匀,使磁珠过饱和,室温孵育30 min,然后使用磁力吸附架吸附磁珠,弃去上清液,使用TBS缓冲液1 mL洗涤样品6次,随后使用50 μL 1×电泳缓冲液重悬磁珠沉淀,煮沸样品15 min,洗脱分离和磁珠沉淀结合的蛋白,离心取上清10 μL样品,进行SDS-PAGE电泳检测,使用Image J进行灰度分析,计算磁珠的蛋白吸附率。公式如下:

1.2.3 蛋白结构及理化性质分析 人源Annexin A5、人 TNFα、RFP和 EGFP的3级结构来源于Protein Data Bank(https://www.rcsb.org/),分别为 :2XO3、6RMJ、3M22和2WSN;果蝇dMagR的序列从 Uniprot获取(https://www.uniprot.org/,序列号Q8T3X9),以序列相似性(positives)为62%,来源于大肠杆菌(E.coli)的SufA 蛋白质晶体结构(PDB ID:1R98)为模板,利用MOE2019软件构建果蝇dMagR的三级结构,分析各个蛋白结构,并计算各蛋白质的性能,包括可及表面、亲疏水性、理论等电点。利用Discovery Studio 2.55软件构建了融合蛋白结构,并分析蛋白质的二级结构。采用Discovery Studio 2017R2客户端软件对蛋白质结构作图展示。
1.2.4 数据处理 采用 GraphPad Prism 软件进行数据的显著性差异分析,P< 0.05 表示具有显著性统计学差异。
2 结果
2.1 突变体dMagR mutant和磁珠有非特异性吸附
本研究将dMagR作为蛋白质与磁珠特异性吸附的阳性对照。同时,将dMagR中与铁硫簇结合的活性中心3个半胱氨酸(Cys)突变为丙氨酸(Ala)——突变体dMagR mutant,使其丧失与铁硫簇结合的能力,从而不能与磁珠特异性吸附,作为阴性对照。利用磁珠A和B分别对dMagR及其突变体dMagR mutant进行吸附。无论是用磁珠A还是磁珠B进行吸附,吸附后均可获得单一蛋白条带(图1-A,图1-C)。突变体dMagR mutant在两种磁珠中均有吸附,吸附量均低于野生型dMagR,磁珠A对两种蛋白质的吸附率均高于磁珠B(图1-B,图1-D)。
2.2 磁珠的非特异性吸附与蛋白的结构性质有关
为了探讨蛋白质的自身性质对非特异性吸附的影响,除了dMagR mutant,本研究还另外选取两种不会与实验所用磁珠发生特异性吸附的蛋白——人肿瘤坏死因子-α(TNFα)和人膜联蛋白A5(Annexin A5),分别与两种磁珠吸附,SDS-PAGE分析,3种蛋白与磁珠均有不同程度的非特异性吸附,磁珠A对蛋白的吸附量均要高一些。磁珠A和磁珠B可以从细菌裂解液中吸附蛋白获得单一条带,分别对不同磁珠吸附所得的同一张电泳图中的条带进行灰度值分析,得出不同磁珠吸附蛋白的吸附率。研究发现不论磁珠A还是磁珠B,3种蛋白质与磁珠的非特异性吸附量呈现相同的趋势:TNFα> dMagR mutant >Annexin A5(图2-A,图2-B)。

图1 不同磁珠吸附dMagR及突变体dMagR mutant蛋白的SDS-PAGE分析及蛋白吸附率
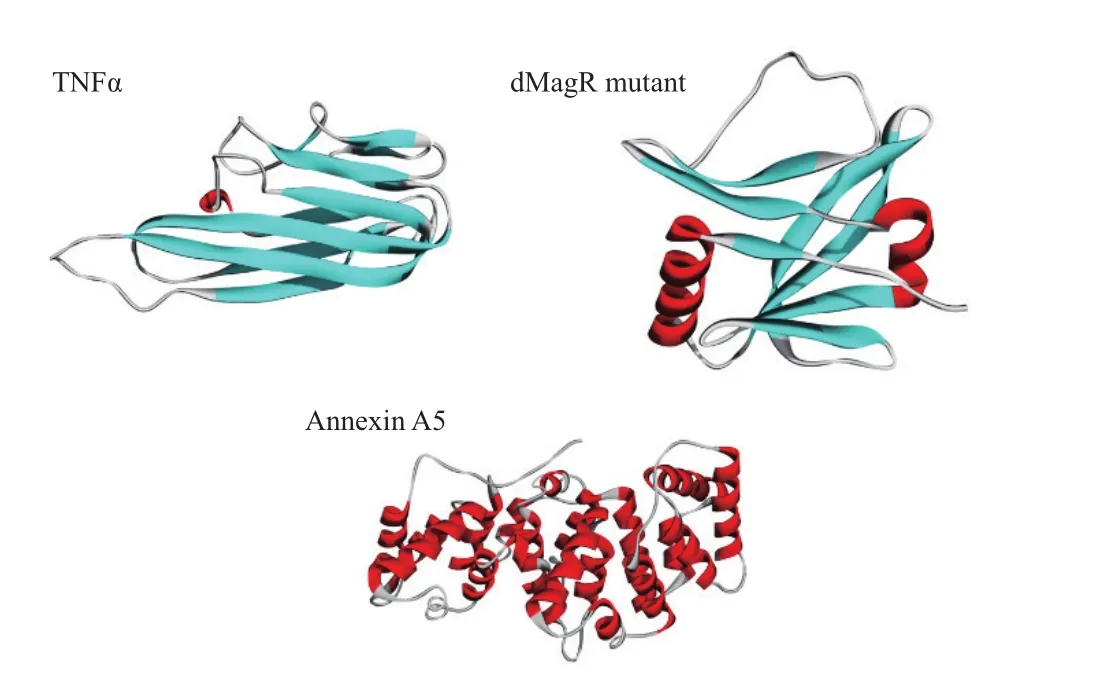
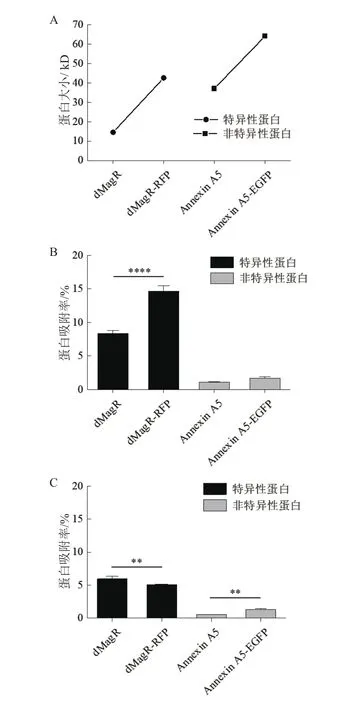
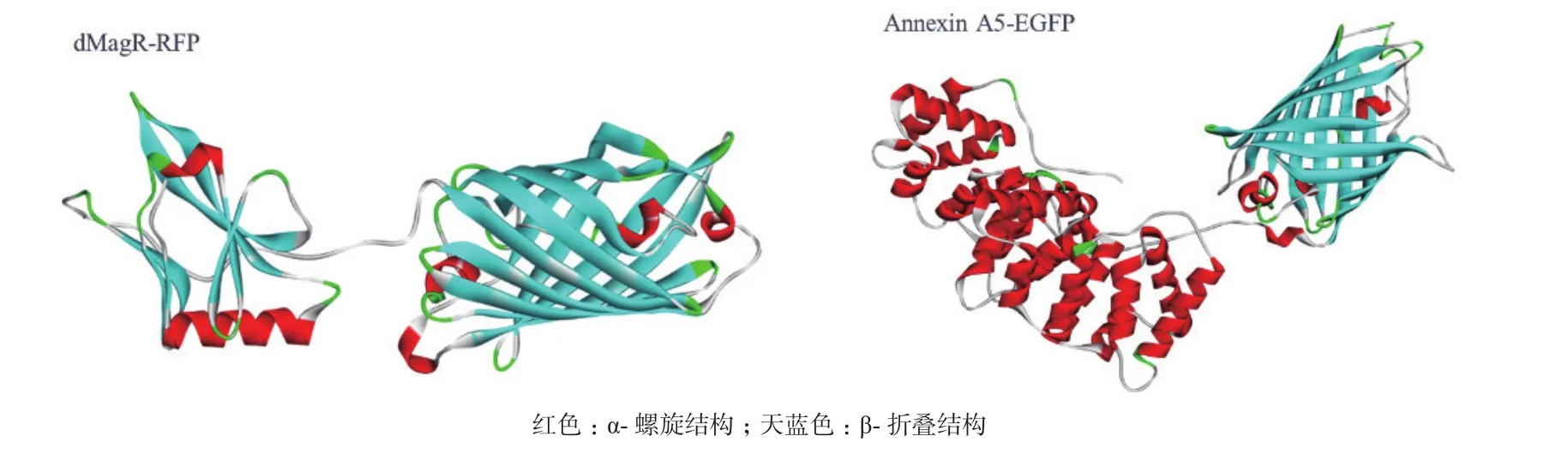
进一步对蛋白质的结构和性质进行分析。软件分析上述3种蛋白质的二级结构(图3)并计算TNFα、dMagR mutant 和Annexin A5的分子量、可及表面、亲水表面性比例,蛋白质电荷以及二级结构比例(表2)。3种蛋白质的分子量与可及表面比较:dMagR mutant< TNFα 图2 不同磁珠吸附不同蛋白的吸附率比较 图3 TNFα、dMagR mutant和Annexin A5的结构 值得注意的是蛋白质的二级结构,TNFα的二级结构以β折叠为主,dMagR mutant 蛋白质的结构是β 折叠+α 螺旋混合,而Annexin A5的二级结构全部是α-螺旋。对β折叠比例比较可知:TNFα > dMagR mutant > Annexin A5,与蛋白质在磁珠上的吸附趋势相一致,结果表明蛋白质中β折叠比例大小与蛋白的非特异性吸附量呈正相关,α螺旋比例大小则与蛋白质吸附量呈负相关。 为了验证蛋白质大小及二级结构比例对蛋白与磁珠吸附的影响,分别将能够特异性吸附的dMagR蛋白及其融合体dMagR-RFP及其融合体dMagRRFP、非特异性吸附蛋白Annexin A5及其融合蛋白Annexin A5-EGFP进行磁珠吸附实验发现,两种融合蛋白在磁珠A吸附量较原来的蛋白均有所增加,磁珠B中Annexin A5-EGFP吸附量也高于Annexin A5,但是对dMagR-RFP的吸附与dMagR相比略有减少(图4-B和图4-C)。对两种融合蛋白的结构进行分析(图5),与dMagR及Annexin A5融合的蛋白均为β折叠为主的蛋白。对二级结构比例进行计算(表3),非特异性吸附蛋白Annexin A5融合EGFP后,蛋白大小增加(图4-A),β折叠比例升高,与磁珠的非特异性吸附增加,且两种磁珠显示的结果一致(图4-B,图4-C)。而对于特异性吸附的蛋白dMagR而言,在融合RFP后,分子量增加(图4-A),β折叠比例略有升高,与磁珠A的吸附明显增加,但与磁珠B的吸附略有减少(图4-B和图4-C)。 表2 不同蛋白质的结构性质参数 图4 不同磁珠对不同大小的融合蛋白的吸附分析 为了探究不同蛋白质与生物纳米磁珠的特异性与非特异性吸附,本研究使用了2种纳米磁珠、6种不同的蛋白质来探讨纳米磁珠和蛋白质的特异性与非特异性吸附。已有研究报道细菌裂解液中的磁受体蛋白dMagR可以与磁珠特异性吸附,进而可以获得单一dMagR蛋白条带[17]。此外,将dMagR与酶连接,利用dMagR与磁珠的特异性吸附,只需一步就可以将酶从细菌裂解液中纯化并固定[18]。因此,选取磁受体蛋白dMagR作为特异性吸附的阳性对照,突变dMagR的活性中心获得dMagR mutant作为特异性吸附的阴性对照。由于突变体dMagR mutant中的半胱氨酸Cys被突变成丙氨酸Ala,不能与[2Fe-2S]铁硫簇结合[17],丧失与磁珠特异性吸附的性质,使得理论上突变体dMagR mutant蛋白与磁珠不具有吸附能力。然而,本研究发现dMagR mutant蛋白与磁珠仍然具有吸附能力,分析其原因,认为是蛋白与磁珠的非特异性吸附导致的。此外,不仅dMagR mutant蛋白与磁珠具有非特异性吸附,TNFα与磁珠的非特异性吸附更强,利用该非特异性吸附的性质可以将蛋白从细菌裂解液中纯化,获得目的蛋白,且条带单一、纯度较高。吴明珲等[19]以羧基修饰的聚苯乙烯磁珠作为载体,包裹人血清白蛋白抗体,可以纯化人血清白蛋白。而本研究利用蛋白质与磁珠的非特异性吸附,无需使用包裹特殊功能基团的生物纳米磁珠即可纯化获得单一条带的目的蛋白,是一种简单可行的蛋白纯化方法,可为以后的蛋白纯化技术提供一种新思路。 图5 dMagR-RFP和Annexin A5-EGFP的结构 表3 不同蛋白结构的性质参数 为了研究蛋白与磁珠产生非特异性的原因,本研究重点关注了不同蛋白的基本理化性质和蛋白二级结构。TNFα、dMagR mutant 和 Annexin A5这3种蛋白的非特异性吸附能力为:TNFα > dMagR mutant> Annexin A5。由于dMagR mutant蛋白分子量最小,Annexin A5分子量最大,TNFα分子量居中,因此蛋白大小与其非特异性吸附能力无明显的关联。本研究对二级结构分析发现,随着蛋白与磁珠非特异性能力的增强,蛋白的β折叠比例增加,α螺旋比例降低,这说明蛋白与磁珠非特异性吸附的能力与蛋白β折叠结构的比例呈正相关。Vertegel等[20]研究发现当蛋白质接近纳米颗粒表面时,相互作用变强,将促使蛋白质的α螺旋结构减少,蛋白质活性变弱。Norde[21]依据热力学分析发现在许多条件下,蛋白与磁珠的吸附是由熵增加驱动的。当蛋白与纳米磁珠表面接近时,蛋白α螺旋结构含量的减少,会导致沿多肽链的旋转自由度的增加,随之而来的熵增可以促进蛋白质与磁珠的吸附[21]。上述研究显示,α螺旋结构可能不利于蛋白质与纳米磁珠的吸附。这可能是α螺旋结构比例低、β折叠结构比例高的蛋白质易于与磁珠吸附的原因之一。 对于TNFα、dMagR mutant 和 Annexin A5这3种蛋白,磁珠A和磁珠B的吸附能力差异较大,磁珠A吸附力强于磁珠B。其主要差异为粒径的差异,磁珠A的粒径大于磁珠B。Vertegel等[20]研究发现,较大的纳米颗粒有较大的吸附作用,粒径大的颗粒表面会有多层吸附,进而导致吸附量的增加。磁珠A粒径为500 nm,磁珠B粒径为400 nm,因此会导致磁珠A对蛋白的吸附力强于磁珠B。此外,磁珠的表面粗糙度也会影响磁珠对蛋白的吸附能力[22],增大磁珠的表面粗糙度,会导致蛋白吸附量的提高,这也可能是两种磁珠对蛋白吸附能力不同的原因。 对于分子量增大的融合蛋白,特异性蛋白dMagR融合RFP后,β折叠比例升高,与不同磁珠吸附有不同的结果,吸附率有升高也有降低,这可能是由于蛋白本身性质及磁珠性质导致的。dMagR蛋白与磁珠的吸附既有特异性吸附也有非特异性吸附,因此蛋白的β折叠比例升高不一定导致总吸附量的增加。磁珠的粒径和分散性,也会导致不同的蛋白吸附量[23]。磁珠A的粒径大于磁珠B,磁珠A对蛋白的吸附力大于磁珠B,磁珠表面的粗糙度也会影响蛋白与磁珠的吸附能力,从而导致dMagRRFP蛋白与两种磁珠的吸附能力不同。而非特异性蛋白Annexin A5融合EGFP后,β折叠比例升高,与磁珠的非特异性吸附率升高。这与本研究上述的研究结果相一致,β折叠比例与蛋白的非特异性吸附能力呈正比,因此β折叠比例升高的Annexin A5-EGFP蛋白与磁珠的非特异性吸附能力增强。 蛋白质大小不是影响磁珠吸附蛋白能力的决定性因素,磁珠对蛋白的非特异性吸附能力与蛋白的β折叠结构比例呈正相关,蛋白质的二级结构对蛋白质与磁珠之间的非特异性吸附有重要影响。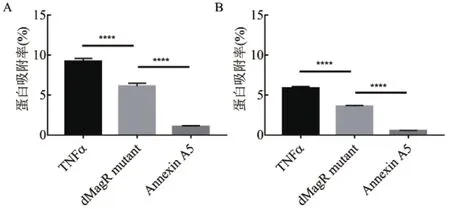
2.3 融合蛋白与磁珠的特异性及非特异性吸附

3 讨论

4 结论

