不同干燥方式对甘薯叶片水分迁移、微观结构、色泽及复水性能影响的比较
季蕾蕾,木泰华*,孙红男
(中国农业科学院农产品加工研究所,农业农村部农产品加工综合性重点实验室,北京 100193)
甘薯(Ipomoea batatas (L.) Lam)为旋花科(Convolvulaceae)一年或多年蔓生草本植物,原名番薯,又名红芋、红薯等,16世纪末传入中国[1]。作为一种重要的粮食作物和淀粉资源,甘薯目前为我国第5大粮食作物,产量仅次于水稻、玉米、小麦和马铃薯,种植面积占世界种植总面积的36.65%,占亚洲种植总面积的84.90%,产量占世界总产量的63.84%,占亚洲总产量的90.49%,居世界首位[2]。其叶片是甘薯的地上蔓生部分,一年可多次采收,与地下部分的甘薯块根产量相当,远高于其他种类的绿叶蔬菜,具有抗旱、抗台风和洪水、抗病虫侵害等特点,能在恶劣条件下生长[3]。大量的研究表明甘薯叶片富含营养及功能成分,如蛋白质、糖类物质(膳食纤维、可溶性多糖、还原糖)、维生素和矿物质、黄酮类化合物、绿原酸、类胡萝卜素、激活剂和抑制剂、挥发性化学成分(棕榈油、亚麻酸等)[4-6]。美国已将甘薯叶片列为极具开发前景的保健蔬菜之一,德国称之为“蔬菜皇后”,日本称之为“长寿食品”[7-8]。
目前,我国也加大了对甘薯叶片的研究和利用,如Liu Jiang等利用响应面法优化了甘薯叶片中黄酮化合物的提取工艺[9];吕巧枝等通过单因素和正交试验优化了甘薯叶片中可溶性蛋白的提取工艺[10];Sun Hongnan等研究了甘薯叶多酚的抗氧化活性及不同pH值、温度、光照处理对其影响[11];Xi Lisha等采用超声波辅助乙醇溶剂提取结合AB-8大孔吸附树脂纯化法得到甘薯茎叶多酚,并采用反相高效液相色谱法明确了甘薯茎叶多酚的组成及各组分含量[12];李卫林等利用正交试验法确定了紫薯叶芦荟叶复合保健醋的最佳发酵工艺[13]。上述研究主要集中在甘薯叶片营养成分的测定、功能成分的提取与分析、功能产品开发等方面。然而,除了极少部分作为新鲜蔬菜在农贸市场、超市流通外,大部分甘薯茎叶都被用作饲料或被直接丢弃,造成了严重的资源浪费。随着近年来人们对于甘薯叶片的重新认知,甘薯叶片的开发利用势必会受到重视,而季节性较强的甘薯叶片在加工、贮藏、运输过程中均受到一定的限制。将甘薯叶片干燥加工成复水蔬菜、原料粉、固体饮料等成品或半成品,可有效提高甘薯叶片的加工特性、延长贮藏时间、降低运输成本,具有较好的市场前景。
本研究采用低场核磁共振技术,解析4 种常用的干燥方式(热风干燥(hot-air drying,HAD)、真空冷冻干燥(vacuum freeze drying,VFD)、微波真空干燥(microwave vacuum drying,MVD)、远红外干燥(far-infrared drying,FID))干燥甘薯叶片的传质传热过程,比较分析4 种不同干燥方式的优劣,以期为甘薯叶片干燥工艺的优化和物料干燥数学模型的建立提供依据。
1 材料与方法
1.1 材料与试剂
新鲜甘薯叶片(‘薯绿1号’) 北京农业技术推广站;戊二醇(分析纯) 国药集团化学试剂有限公司。
1.2 仪器与设备
FD5-3真空冷冻干燥仪 美国SIM公司;CR-400色彩色差计 日本柯尼卡美能达株式会社;C21-WK2102电磁炉 广东美的生活电器制造有限公司;MJ33快速水分测定仪 瑞士梅特勒-托利多公司;BGP-9240A精密热风干燥箱 上海一恒科学仪器有限公司;ZNJZW-R001微波真空干燥设备、ZNJYHW-R001远红外干燥设备 北京中农加科技发展有限公司;MesoMR23-060H-I型核磁共振分析系统 上海纽迈电子科技有限公司;S-3400扫描电子显微镜 日本株式会社日立制作所。
1.3 方法
1.3.1 原料处理
用清水将甘薯叶片表面泥沙冲洗干净后用吸水纸吸取表面多余水分,备用。
1.3.2 干燥方法
HAD:通过预实验考察了总干燥时间、干燥后叶片色泽和水分质量分数,确定甘薯叶片干燥参数,将叶片平铺于干燥网格框中,彼此不重叠,设置干燥温度为50 ℃,干燥2.5 h。
VFD:将甘薯叶片摆放干燥盘中于-40 ℃冰箱中预冻24 h,将冷肼温度降至-50 ℃后放入预冻好的干燥盘,打开真空泵使真空度迅速下降到100 mTorr。干燥期间的冷肼温度为-57 ℃,真空度为3 mTorr,干燥18 h。
MVD:通过预实验考察了总干燥时间、干燥后叶片色泽和水分质量分数,确定甘薯叶片的干燥参数,设置微波功率350 W,真空度-0.98 MPa,干燥温度上、下限分别为45 ℃和50 ℃,将甘薯叶片平铺于干燥网格框内,彼此不重叠,干燥1.25 h。
FID:通过预实验考察了总干燥时间、干燥后叶片色泽和水分质量分数,确定甘薯叶片的干燥参数,将叶片平铺于干燥网格框中,彼此不重叠,设置干燥温度为50 ℃,干燥1.25 h。
1.3.3 干燥曲线绘制
通过前期预实验确定了甘薯叶片不同干燥过程中取样时间,分别为:HAD每30 min取样一次;VFD每3 h取样一次;MVD每15 min取样一次;FID每15 min取样一次。每次取样后迅速测定所取样叶片的水分质量分数,当取样叶片水分质量分数在3%~7%之间时适时选为干燥终止点。以取样时间为横坐标,以取样时叶片的水分质量分数为纵坐标,得到干燥曲线图。
1.3.4 水分分布、组成及迁移分析
使用MesoMR23-060H-I核磁共振分析及成像系统测定,结合李侠[14]和Wang Lin[15]等的方法适当修改,取样时间依照1.3.3节,设备设置参数如下:共振频率为21.3 MHz,磁体强度0.55 T,线圈直径60 mm,磁体温度32 ℃。采用核磁共振分析软件中的CPMG(Carr-Purcell-Meiboom-Gill)脉冲序列测定样品中的横向弛豫时间T2。将准确称量5 g未经干燥的鲜叶以及1.3.3节中经不同方式干燥不同时间的甘薯叶片放入永磁场中心位置的射频线圈中心,进行T2采集,然后将得到的信号通过核磁共振T2反演软件进行反演,得到T2反演谱。CPMG脉冲序列参数为:质子共振频率SF为23 MHz,接收机带宽SW为250 kHz,采样起始点控制参数RFD为0.005 ms,偏移频率O1为290.697 18 kHz,90°脉冲宽度P1为17 μs,180°脉冲宽度P2为38 μs,采样点数TD为312 524,重复时间TW为3 000 ms,累加次数NS为4 次,回波个数NECH为5 000。
1.3.5 扫描电子显微镜观察
将固定液(戊二醇)移入1.5 mL尖头离心管中,固定液与样品体积比需大于20∶1,确保固定液充分有效,在轻柔冲洗干净的新鲜甘薯叶片上避开主叶脉取3 mm×7 mm左右的叶片,迅速放入事先准备好的固定液中,平行取样6~8 片,室温避光固定48 h以上,移入4 ℃冰箱中保存备用;干燥后的甘薯叶片避开主叶脉直接取3 mm×7 mm左右的叶片,取样过程需轻柔,避免所取叶片碎裂,平行取样6~8 片备用。取固定好的新鲜甘薯叶片以及不同干燥方式干燥后的甘薯叶片各6 片,分别以三正面三背面方式依次固定于显微镜观测台上,喷金厚度15 nm,于10 kV加速电压下观测。
1.3.6 色泽的测定
分别取不同干燥方式处理过程中的甘薯叶片(HAD:分别在0.5、1.0、1.5、2.0、2.5 h从热风干燥箱中取出甘薯叶片;VFD:分别在3、6、9、12、15、18 h从真空冷冻干燥机取出甘薯叶片;MVD:分别在0.25、0.50、0.75、1.00、1.25 h从微波真空干燥设备中取出甘薯叶片;FID:分别在0.25、0.50、0.75、1.00、1.25 h从远红外干燥设备中取出甘薯叶片),参照鞠栋[16]的方法,并稍作修改,用校准后的CR-400色差计测定,L*值表示亮度,黑色为0,白色为100。坐标原点的颜色为无色(a*=0,b*=0)。在水平轴方向,a*值为正表示颜色为红色,a*值为负表示颜色为绿色,在纵轴方向,b*值为正表示颜色为黄色,b*值为负表示颜色为蓝色,白板校正值为L*值94.89、a*值-0.43、b*值3.73。
1.3.7 复水率的测定
参照杨薇等[17]的方法,并稍作修改,取适量干燥完成后的甘薯叶片(HAD:干燥2.5 h取样;VFD:干燥18 h取样;MVD:干燥1.25 h取样;FID:干燥1.25 h取样),称质量,然后在沸水中煮5 min,移出,用吸水纸轻柔吸除表面水分,再次称质量;复水率以样品复水后质量和干燥后质量的比值表示,按下式计算。
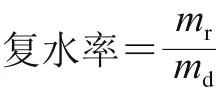
式中:mr为复水后质量/g;md为干燥后取样质量/g。
1.4 数据统计与分析
所有实验均重复测定3 次,实验结果以平均值±标准差表示。利用SAS 9.4软件对结果进行方差分析,P<0.05时认为差异显著,利用Excel 2010及OriginPro 8.5软件作图。
2 结果与分析
2.1 干燥特性及传质传热过程
新鲜甘薯叶片不同干燥方式的干燥曲线如图1所示,4 种不同干燥方式的特点和干燥速率各有不同,干燥曲线上任一点的切线斜率即为该点的干燥速率,典型的干燥曲线包括恒速阶段以及降速阶段,两个阶段之间存在十分明显的临界点[18],从图1的4 条干燥曲线中均可以看到明显的临界点,在临界点之前甘薯叶片内部的湿度远高于环境湿度,干燥速率较快,在临界点之后由于甘薯叶片内部湿度接近环境湿度,干燥速率降低,水分质量分数趋于稳定。
VFD是将含水物料冻结后,在真空环境下受热升华从而进行干燥[19],VFD的干燥速率随干燥仓内外温差的增大而加快,传质(排除蒸汽)速率随蒸汽压差增大而加快[20]。因本实验冷冻干燥过程中甘薯叶片的受热仅靠室温和干燥设备之间的温度差来传热,传热方向由外到内,甘薯叶片与冷肼之间的蒸汽压力差为传质的驱动力,传质方向由内到外,即传热与传质方向相反,又因形成足够大的蒸汽压力差需要一定时间,故VFD的干燥速率明显低于其他3 种,干燥时间明显长于其他3 种(图1)。HAD由干燥设备提供热量来源,风机将热量吹送至设备内各处,热量循环在甘薯叶片周围,由甘薯叶片表面逐渐向甘薯叶片内部扩散完成传热,干燥终止前甘薯叶片内部的湿度高于外部,此湿度的梯度差即为干燥传质的驱动力,导致水分由内向叶表面扩散直至蒸发,虽然HAD的传热方向与传质方向相反,但HAD预热时间短,可以忽略不计,且甘薯叶片为多纤维物料,干燥阻力较小,故干燥速率较快,干燥时间较短。FID利用辐射元件发射远红外辐射能量,具有穿透性,物料在吸收能量后从内部产生热能[21],因此采用FID干燥甘薯叶片时,热量由甘薯叶片内部产生向甘薯叶片表面扩散,即传热方向由内向外,甘薯叶片内外湿度梯度差导致传质方向由内向外,故FID的传质传热方向一致,干燥速率高于HAD,干燥时间比HAD短。MVD是磁控管产生的微波传输到干燥设备的负压腔体内[22],从不同方向对甘薯叶片辐射引起表面产生热量进行干燥,且微波穿过甘薯叶片内部引起内部产生大量热量,使甘薯叶片水分经叶表面蒸发而出[23]。即MVD干燥甘薯叶片的传热方向由甘薯叶片内部及表面向干燥设备腔体扩散,传质方向因湿度梯度由甘薯叶片内部向干燥设备腔体扩散,传热传质方向一致,又因MVD加热特点是甘薯叶片内部和表面同时升温,且伴随干燥腔体真空度升高水的沸点降低,故MVD的干燥速率要快于FID。
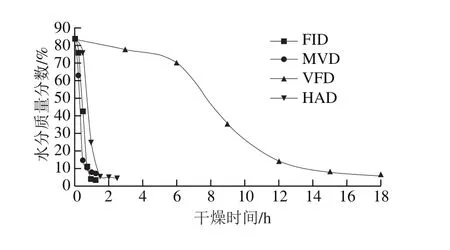
图1 不同干燥方式甘薯叶片的干燥曲线Fig. 1 Drying curves of sweet potato leaves during different drying processes
2.2 水分分布、组成及迁移分析结果
为了研究甘薯叶片干燥过程中的水分状态,利用CPMG脉冲序列测定甘薯叶片干燥过程中弛豫特性,得到弛豫时间T2及其相应的质子密度,T2的大小代表了水分流动性的强弱,可以反映物料中水分的自由度,T2越小,代表水分与非水组分结合得越紧密,越不容易排出;T2越大,代表水分的自由度大,越容易排出[24]。如图2所示,T2与信号强度的关系曲线可以间接反映出甘薯叶片中水分的含量、状态和移动方式,弛豫时间与其对应的质子密度代表的含义是一致的,在核磁共振技术中,弛豫时间与其相对应的质子密度的变化趋势是一致的,T2弛豫谱呈现出多组分特征,利用甘薯叶片的弛豫特性对不同水分进行区分,宋朝鹏等[25]对烘烤过程中烟叶进行T2弛豫谱分析,烟叶包括结合水、半结合水及自由水,烟叶主脉包括半结合水和自由水;张绪坤等[26]对胡萝卜片干燥过程进行T2弛豫谱分析,胡萝卜片包括结合水、半结合水、自由水;要世瑾等[27]对小麦植株进行T2弛豫谱分析,小麦包括结合水、自由水。本研究将T2弛豫时间13.67 ms作为分界点,可分为结合水T21(0.06~13.67 ms)、自由水T22(13.67~580.52 ms),水分分布状态因样品不同而存在一定差异,具体可以根据T2曲线特征进行区分。如表1所示,结合水峰面积A21与自由水峰面积A22可反映甘薯叶片内水分的组成情况,A21越大代表结合水比例越高,A22越大代表自由水比例越高,在4 种干燥方式干燥过程中,随干燥时间延长,4 种干燥方式的A21从(12.20±0.25)%逐渐增大至100%后稳定,A22皆从(87.80±0.02)%逐渐降低至0%,即在甘薯叶片内,随干燥时间延长自由水逐渐被除去,导致结合水比例逐渐升高,其中MVD和FID的A22下降速率最快,在干燥时长达1 h时A22消失。随干燥时间延长,4 种干燥方式的T21、T22均逐渐降低,结合A21、A22的变化和图2可知,结合水部分被排除的同时其曲线峰有向左移动趋势,这是由于结合水与甘薯叶片组织间的结合更为紧密;自由水大部分被排除的同时其曲线峰同样有向左移动的趋势,代表有少部分自由水向结合水迁移。
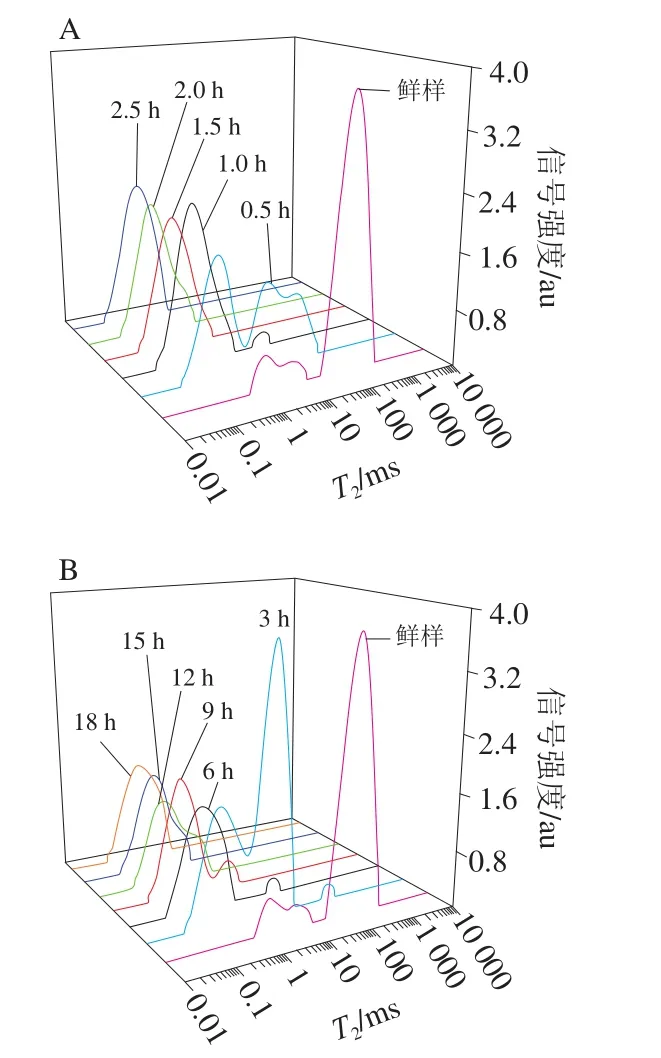
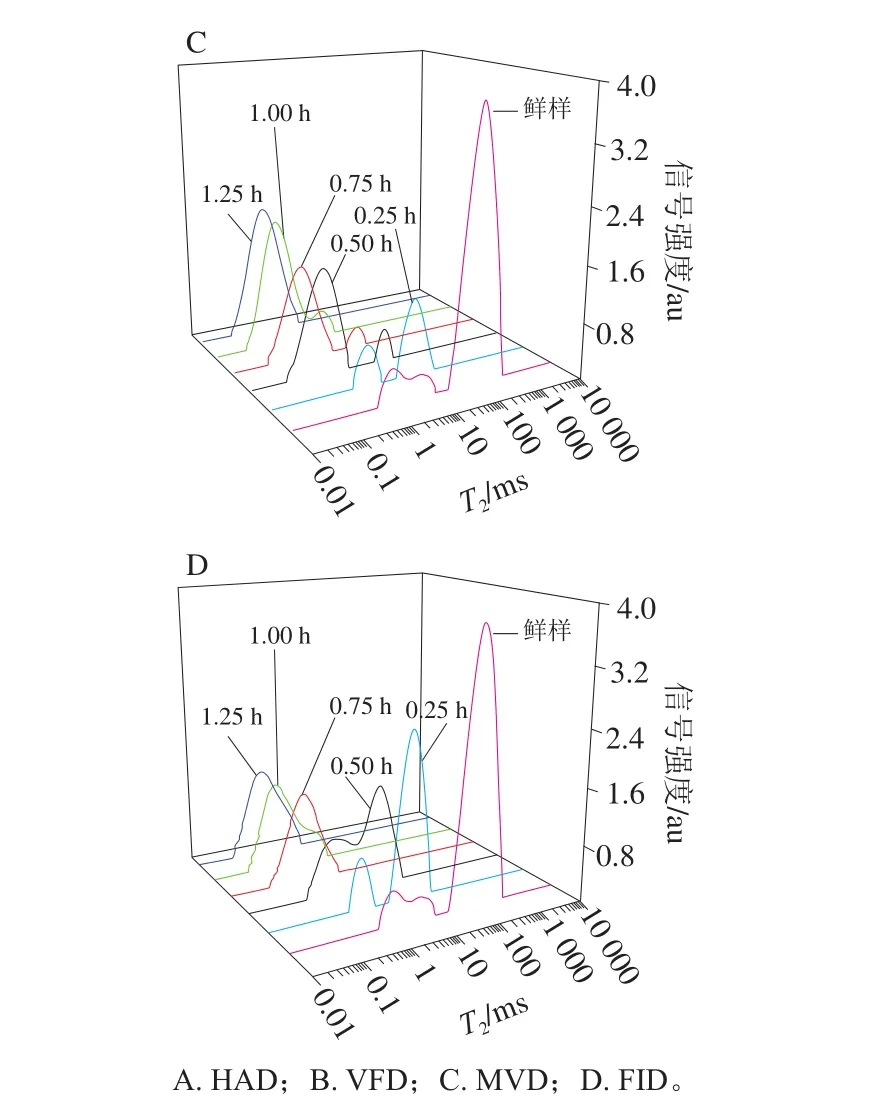
图2 干燥方式对甘薯叶片干燥过程中横向弛豫时间T2的影响Fig. 2 Effect of drying methods on transverse relaxation time T2 of sweet potato leaves during drying process

表1 甘薯叶片的水分分布在不同干燥方式下随干燥时间的变化Table 1 Changes of water distribution in sweet potato leaves during different drying processes
2.3 扫描电子显微镜观察结果
甘薯叶片的上下表皮均有密度不一的气孔分布,由图3可以看出,甘薯叶片气孔由两个肾形的保卫细胞组成,可以张开或者关闭,是植物蒸腾失水的“门户”,也是气体交换的“窗口”,保卫细胞控制气孔开闭,甘薯叶片正面的气孔数目明显少于背面,这是适应干旱的陆地环境的一种生理特征[28-29]。如图3所示,新鲜甘薯叶片在离开植株后,气孔全部呈现出关闭状态,以降低自身的水分散失,正、反面气孔保卫细胞表面光滑无褶皱;HAD过程中导致甘薯叶片正面个别气孔呈微张状态,开口大小5~10 μm,反面气孔全部张开,开口大小45 μm左右,正反面气孔保卫细胞表面均呈褶皱状;VFD过程中甘薯叶片正面气孔无明显变化,反面气孔全部张开,开口大小10~20 μm不等,正反面气孔保卫细胞表面均光滑无褶皱;MVD过程中导致甘薯叶片正反面气孔部分呈张开状态,开口大小5~12 μm不等,气孔保卫细胞表面均呈微褶皱状,褶皱程度低于HAD;FID过程中甘薯叶片正面气孔呈闭合状态,有轻微糊化现象,反面气孔均呈张开状态,开口大小10~50 μm不等,正面气孔保卫细胞表面均呈微褶皱状,褶皱程度低于HAD,反面保卫细胞表面均呈褶皱状,褶皱程度高于其他干燥方式得到的甘薯叶片;综上,结合图1干燥曲线可以看出在最大可能保持甘薯叶片原状情况下,MVD速率最快。
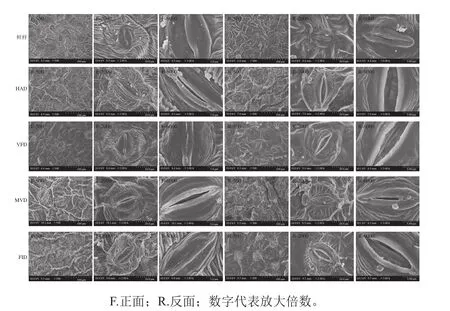
图3 不同方法干燥后的甘薯叶片微观结构Fig. 3 Microstructure of sweet potato leaves dried by different drying methods
2.4 干燥过程中甘薯叶片颜色变化
新鲜甘薯叶片的色泽,以及经不同干燥方式处理过程中的甘薯叶片的色泽变化如表2所示。与新鲜甘薯叶片L*值(39.86±0.44)相比,除了VFD开始阶段L*值无明显差异外,其余干燥方式的各干燥阶段L*值均有不同程度增加;HAD甘薯叶片随干燥时间的延长L*值总体先增后减,VFD、MVD、FID甘薯叶片随干燥时间延长L*值逐渐增加,其中MVD 1.25 h组甘薯叶片L*值最高(45.25±0.32),这点从图4中可以很直观地看出。
表2中a*值均为负值,表明所有样品均偏绿色,对比4 种干燥方式中a*值的变化规律,只有MVD的甘薯叶片a*值随干燥时间的延长其绝对值逐渐增加,其余干燥方式的a*值绝对值总体均呈下降趋势,结合图4可知,经MVD干燥最终得到的甘薯叶片具有最绿的颜色(a*=-15.27±0.51);表1中b*值均为正值,代表所有样品颜色偏暖色,与新鲜甘薯叶片b*值(15.35±0.27)相比,不论何种干燥方式均不同程度地使甘薯叶片b*值增加,即甘薯叶片颜色黄色增加,这可能是由于随干燥时间延长甘薯叶片水分含量逐渐降低,FID最终得到的甘薯叶片相较于其他干燥方法b*值(21.96±0.41)最大,颜色最偏黄,并且在图4中可以很清晰地看到经FID干燥得到的甘薯叶片体积缩小程度最大,呈明显枯萎状,这是由于FID过程的辐射能量产热快,且热量在甘薯叶片上聚集,不能及时扩散,叶片局部温度过高导致叶绿素分解。
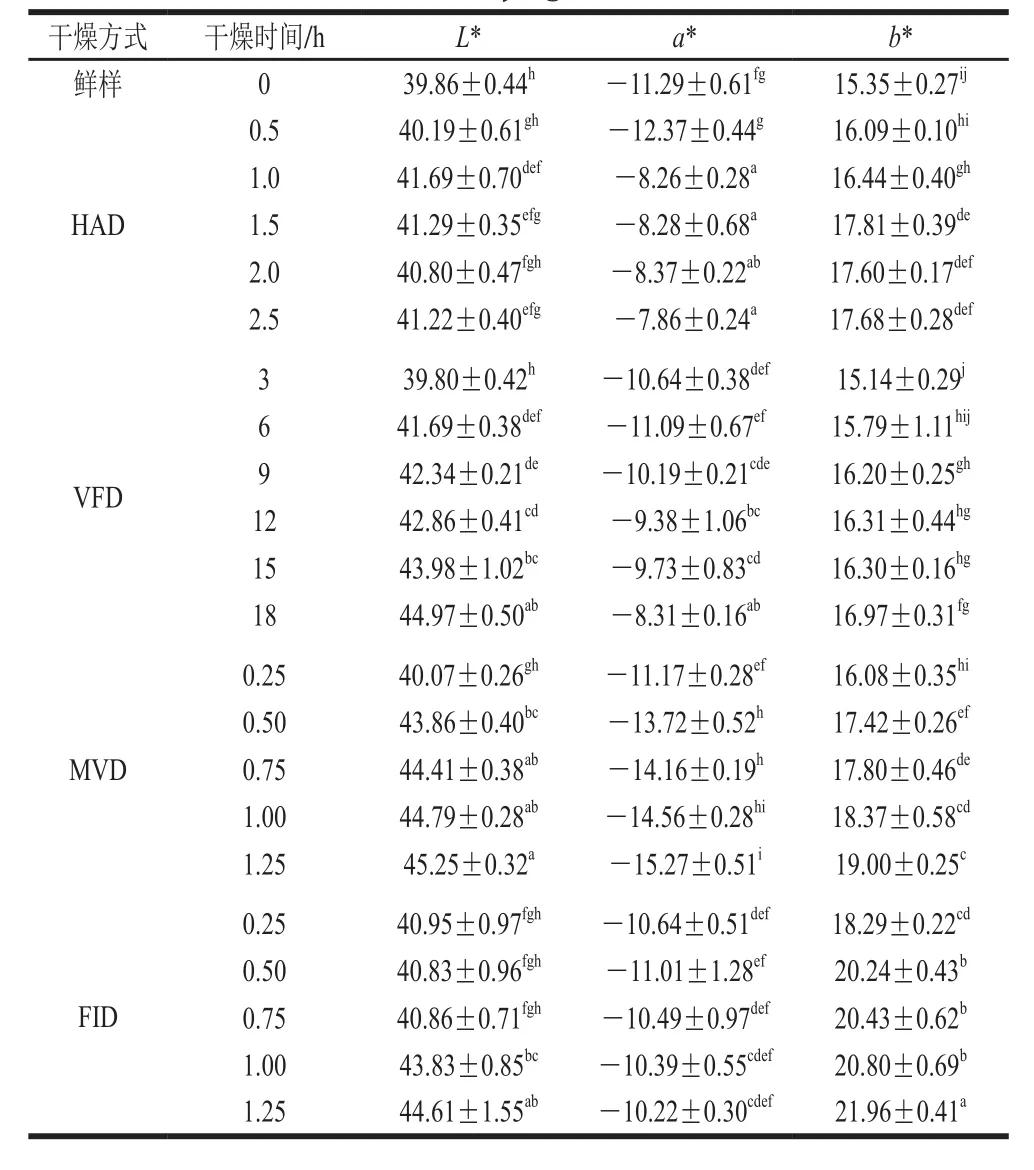
表2 甘薯叶片色泽在不同干燥方式下随干燥时间的变化Table 2 Color changes of sweet potato leaves with drying time using different drying methods
甘薯叶片在4 种干燥方式中表现出不同的色泽变化,很大程度上是由于4 种干燥方法的原理不同,MVD过程是在真空和无光的密闭环境内进行,HAD和FID过程是在有光和氧的环境中进行,且本实验使用的VFD设备仓是透明的,虽然整个过程在真空环境中但整个VFD过程也是在有光的环境中进行,而光和氧气皆会导致离开活体的叶绿素分解引起色泽的变化[30]。

图4 不同方法干燥前后的甘薯叶片外观Fig. 4 Appearance of sweet potato leaves before and after drying by different drying methods
2.5 干燥后甘薯叶片复水率
在干燥终止时,不同干燥方得到的甘薯叶片的复水率如表3所示。VFD得到的甘薯叶片复水率(6.81±0.81)最高,代表复水能力最强;FID得到的甘薯叶片复水率(4.92±0.73)最低,说明该方式干燥甘薯叶片复水能力最差,导致此结果的原因是由于FID过程中甘薯叶片表面局部温度过高,甘薯叶片气孔褶皱程度大,且闭合的气孔表面及开口的气孔内部均有糊化现象出现(图3),降低了气孔的复水能力;HAD、VFD、MVD得到的甘薯叶片复水率没有显著性差异(P>0.05),代表此3 种干燥方法得到的甘薯叶片复水能力相似。

表3 不同干燥方式处理后甘薯叶片的复水率Table 3 Rehydration capacity of sweet potato leaves dried by different drying processes
3 结 论
综上所述,干燥过程中可将甘薯叶片内部水分为两部分,结合水T21(0.06~13.67 ms)和自由水T22(13.67~580.52 ms),在整个干燥过程中,自由水随干燥时间的延长大部分被排出,部分向结合水迁移,致使甘薯叶片内结合水的比例逐渐增加,直至稳定,与甘薯叶片组织之间结合得更为紧密。MVD干燥甘薯叶片的传质传热方向一致,甘薯叶片内部及表面同时升温,且整个干燥过程都处于一定真空环境中,致使MVD干燥速率最高。对比其他3 种方式干燥后的甘薯叶片气孔结构、色泽、复水性,MVD得到的甘薯叶片能较好地保持原始状态,干燥过程中甘薯叶片正反面气孔均呈现张开状态,利于干燥的完成,并且干燥终止时叶片呈现出最好的亮绿色,无明显变黄现象,复水能力与HAD得到的甘薯叶片并列最佳。综上所述,MVD可作为干燥甘薯叶片的首选方法。

