不同蛋白酶酶解对蚕豆蛋白生物活性的影响
乔杨波,韩丽娟, 2,王树林,院珍珍,秦艳婷
(1.青海大学 农牧学院,西宁 810016; 2.青海大学 省部共建三江源生态与高原农牧业国家重点实验室,西宁 810016)
蚕豆(ViciafabaL.)种植面积和产量均居于我国食用豆类之首,广泛分布于云南、青海、甘肃等地[1-2]。青海作为我国春蚕豆的主产区之一,以生产大粒型品种为主,生产的蚕豆以粒大、色泽鲜亮、无虫蛀而闻名[3-4]。蚕豆中蛋白质含量可达25%~30%,仅次于大豆,远高于水稻、小麦及其他作物,同时因蚕豆中淀粉含量丰富,脂肪含量较低,故可将其作为人类理想的植物蛋白质来源[5-9]。随着近年来研究不断深入,越来越多的研究表明植物源多肽在人体生理调节过程中起着十分重要的作用,可以显著提高人体免疫力,提高机体的抗氧化及抗衰老能力[10-12]。蚕豆在我国食品行业中的应用主要利用其所含淀粉作为食品加工的重要原料,却鲜少利用其中的蛋白质进行食品工业生产,这不仅导致资源的大量浪费,同时也致使蚕豆多肽的研究始终处于初步阶段[12]。
目前,主要以化学合成法、分离提取法、基因重组法及酶解法等制备植物源多肽[13]。酶解法因操作简单,制备过程反应条件温和,且酶解后蛋白质多肽得率高等优点而被广泛采纳[14-15]。因此,为了更全面利用蚕豆资源,更深入地利用蚕豆蛋白,发挥其最大的生物利用价值,本文通过选用不同蛋白酶酶解蚕豆蛋白,对比酶解产物多肽得率、抗氧化活性及对α-葡萄糖苷酶活性的影响,为酶法制备高质量、高活性的蚕豆多肽奠定一定的理论基础,从而实现蚕豆蛋白及多肽的综合利用。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
蚕豆,产自青海西宁;酸性蛋白酶、菠萝蛋白酶、胃蛋白酶,南京都莱生物技术有限公司;L-酪氨酸标准品、干酪素标准品、考马斯亮蓝G-250、标准牛血清白蛋白、福林酚、α-葡萄糖苷酶、ABTS试剂、DPPH试剂,北京索莱宝科技有限公司;VC,江苏采薇生物科技有限公司;阿卡波糖,拜耳医药保健有限公司;丙氨酸、甘氨酸、苏氨酸、丝氨酸、缬氨酸、亮氨酸、异亮氨酸、半胱氨酸、脯氨酸、甲硫氨酸、天冬氨酸、天冬酰胺、色氨酸、谷氨酸、酪氨酸标准品,美国Sigma公司;碳酸钠、氢氧化钠、浓盐酸、柠檬酸、柠檬酸钠、磷酸二氢钾、磷酸氢二钾、无水乙醇、磷酸等均为分析纯。
1.1.2 仪器与设备
QP2010 plus气相色谱-质谱联用仪,日本岛津公司;KC-130小型粉碎机,浙江武义鼎藏日用金属制品厂;UV-2600紫外可见分光光度计,岛津企业管理有限公司;真空干燥箱,上海一恒科学仪器有限公司;电热鼓风干燥箱,上海一恒科学仪器有限公司;GS55-9冷冻干燥机,基因有限公司。
1.2 实验方法
1.2.1 蚕豆蛋白的提取
蚕豆蛋白的提取参考文献[16]并略作改动,通过测定蚕豆蛋白等电点,采用等电点沉淀法提取蚕豆蛋白。取干燥、粉碎后的蚕豆粉末,加蒸馏水溶解,取上清液调节至不同pH(3.8、4.0、4.2、4.4、4.6、4.8、5.0、5.2),通过考马斯亮蓝法确定蚕豆蛋白等电点为4.8。以蚕豆为原料,经干燥、粉碎,加蒸馏水,调节pH至8左右,使得蚕豆蛋白溶解,取上清液将pH调节至蚕豆蛋白等电点,过滤取沉淀进行真空冷冻干燥即得到蚕豆蛋白。
1.2.2 蛋白酶活力测定
参考文献[17]采用福林酚法绘制L-酪氨酸标准曲线。以吸光度(y)与L-酪氨酸标准品质量浓度(x)进行线性回归,得回归方程y=0.009 6x+0.023 5,R2=0.999 7,按下式计算蛋白酶活力。
蛋白酶活力=A×(4/10)×N
式中:A为对照标准曲线得出的L-酪氨酸释放量,μg/mL;10为酶解反应总时间,min;4为酶解反应试剂总体积,mL;N为酶液稀释倍数(本实验N为100)。
1.2.3 蚕豆蛋白酶解
将提取的蚕豆蛋白制为4%的酶解底物,调节pH至各蛋白酶酶解所需pH(酸性蛋白酶3.0、胃蛋白酶3.0、菠萝蛋白酶7.5),分别加入酸性蛋白酶、菠萝蛋白酶、胃蛋白酶,同时控制酶活力均为3 066.44 U/g,未处理组调节pH至中性但无蛋白酶添加。将处理组与未处理组均置于40℃恒温水浴锅中恒温水浴4 h,取出立即煮沸10 min灭酶,得到酶解液。离心取上清液,得到蚕豆蛋白酶解产物。
1.2.4 蛋白质质量浓度的测定
参考文献[18]采用考马斯亮蓝法绘制蛋白质标准曲线。以吸光度(y)与牛血清白蛋白标准品质量浓度(x)进行线性回归,得回归方程y=0.006 7x+0.076,R2=0.999 1。根据标准曲线计算蛋白质质量浓度。
1.2.5 多肽得率测定
参考文献[19]采用双缩脲法绘制双缩脲标准曲线。以吸光度(y)与牛血清白蛋白标准品质量浓度(x)进行线性回归,得回归方程y=0.056 5x-0.002 3,R2=0.999 1。根据标准曲线计算蚕豆蛋白酶解产物中多肽质量浓度,按下式计算多肽得率。
多肽得率=C×V/M×100%
式中:C为酶解产物中多肽质量浓度,mg/mL;V为酶解产物总体积,mL;M为蚕豆蛋白质量,mg。
1.2.6 氨基酸含量测定
1.2.6.1 样品前处理
取蚕豆蛋白酶解产物于10 mL水解管中,加入6 mol/L的盐酸,100℃酶解12 h。旋蒸除去盐酸后,加入正丁醇100℃孵育1 h,旋蒸蒸干,50℃三氟乙酸酐乙酰化10 min。取等量的标准品采用同样的方法进行衍生。加水终止反应,二氯甲烷萃取,进行GC-MS分析。
1.2.6.2 GC-MS条件
GC条件:RXI-5SIL MS色谱柱(30 m×0.25 mm×0.25 μm);程序升温条件为起始温度60℃,以4℃/min升温至280℃,保持5 min;进样口温度250℃;检测器温度250℃;载气为氦气,流速1 mL/min。
MS条件:离子源温度200℃,接口温度230℃,延迟2 min,扫描范围(m/z)43~400,扫描速度769 u/s,检测时间2~56 min。
1.2.7 DPPH自由基清除率测定
将蚕豆蛋白酶解产物用蒸馏水稀释至不同蛋白质质量浓度(96、48、24、16、12 μg/mL),分别与DPPH溶液、无水乙醇混合(体积比1∶1),静置30 min,于517 nm处测定吸光度,以相应质量浓度的VC为阳性对照,按下式计算DPPH自由基清除率。
DPPH自由基清除率=[1-(Ai-Aj)/Ac] ×100%
式中:Ai、Aj、Ac分别为样品与DPPH、无水乙醇与样品、DPPH与无水乙醇的吸光度。
1.2.8 ABTS自由基清除率测定
将蚕豆蛋白酶解产物用蒸馏水稀释至不同蛋白质质量浓度(96、48、24、16、12 μg/mL),与ABTS溶液混合(体积比1∶20)后于室温下反应6 min,在734 nm处测定吸光度,以相应质量浓度的VC为阳性对照,按下式计算ABTS自由基清除率。
ABTS自由基清除率=(1-A样品/A空白)×100%
1.2.9α-葡萄糖苷酶活性抑制率测定
将蚕豆蛋白酶解产物用蒸馏水稀释至不同蛋白质质量浓度(48、24、12、6、3 μg/mL),参考文献[20]分别测定样品组、样品空白组、阴性对照组和空白组的吸光度,以相应质量浓度的阿卡波糖为阳性对照,按下式计算α-葡萄糖苷酶活性抑制率。
α-葡萄糖苷酶活性抑制率=[(A3-A4)-(A1-A2)]/(A3-A4)×100%
式中:A1、A2、A3和A4分别为样品组、样品空白组、阴性对照组和空白组的吸光度。
1.2.10 数据处理
所有的实验均重复3次,数据均表示为“X±SD”,采用SPSS21.0软件进行单因素方差分析,以P<0.05表示显著性差异,P<0.01表示极显著性差异。
2 结果与讨论
2.1 蛋白酶活力
利用福林酚法分别测定酸性蛋白酶、胃蛋白酶、菠萝蛋白酶活力,结果见表1。
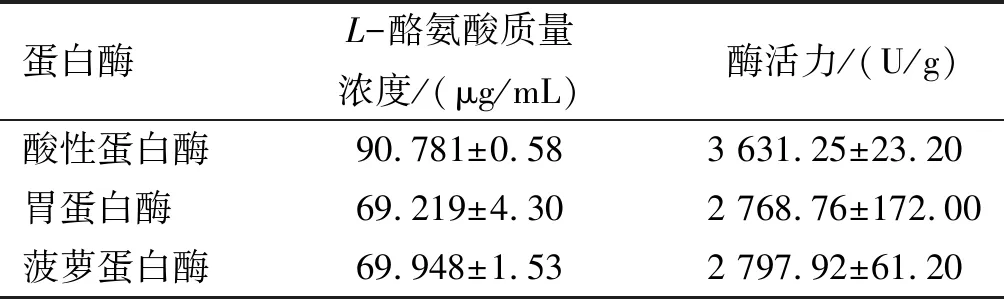
表1 不同蛋白酶活力
2.2 蚕豆蛋白多肽得率的比较
采用双缩脲法进行蛋白多肽得率测定,结果如图1所示。
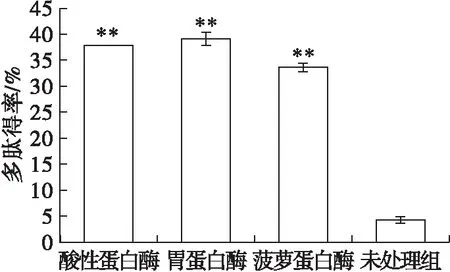
注:与未处理组比较*P<0.05,**P<0.01。 图1 蚕豆蛋白多肽得率比较
由图1可知,经蛋白酶酶解后,蚕豆蛋白多肽得率呈现大幅度上升的趋势(P<0.01),上升幅度大小依次为胃蛋白酶>酸性蛋白酶>菠萝蛋白酶。其中,胃蛋白酶处理后的蚕豆蛋白多肽得率高达39.14%,是未经蛋白酶处理蚕豆蛋白多肽得率的9.05倍。不同酶催化酶解蚕豆蛋白时所断裂的肽键数目不同,致使蚕豆蛋白酶解程度存在差异[21],不同蛋白酶酶解位点不同,也会使酶解生成氨基酸的种类、数目及多肽链的空间结构发生差异,最终影响蛋白质的多肽得率。
2.3 酶解前后蚕豆蛋白氨基酸含量的比较
采用GC-MS对酶解前后蚕豆蛋白的氨基酸组成及含量进行测定,对蚕豆蛋白酶解产物定量分析了15种氨基酸成分,结果如表2所示。
由表2可知,未处理组蚕豆蛋白中共检出10种氨基酸,经菠萝蛋白酶、酸性蛋白酶、胃蛋白酶酶解后分别检出12、12、11种氨基酸。经蛋白酶酶解后,异亮氨酸在蚕豆蛋白酶解产物中未被检出,缬氨酸与半胱氨酸被检出。此外,经菠萝蛋白酶酶解后,谷氨酸被检出,且除天冬酰胺与酪氨酸外,其他氨基酸含量均较未处理组有一定上升,其中以亮氨酸含量增加最为明显,达到10.65%。经酸性蛋白酶酶解后,甲硫氨酸与色氨酸被检出,与未处理组相比,酶解产物中异亮氨酸与酪氨酸未被检出。此外,除缬氨酸、半胱氨酸、谷氨酸、酪氨酸外,其余氨基酸含量较其他处理组明显上升。经胃蛋白酶酶解后,与未处理组相比,除缬氨酸、半胱氨酸、亮氨酸外,其余各氨基酸含量均较未处理组显著降低,其中又以酪氨酸含量降低最为明显,为13.53%。因此,经菠萝蛋白酶和酸性蛋白酶酶解后可以明显增加蚕豆蛋白中氨基酸的种类和含量。

表2 酶解前后蚕豆蛋白氨基酸组成及含量 %
注:“-”为未检出。
2.4 蚕豆蛋白酶解产物抗氧化活性
2.4.1 DPPH自由基清除率(见图2)
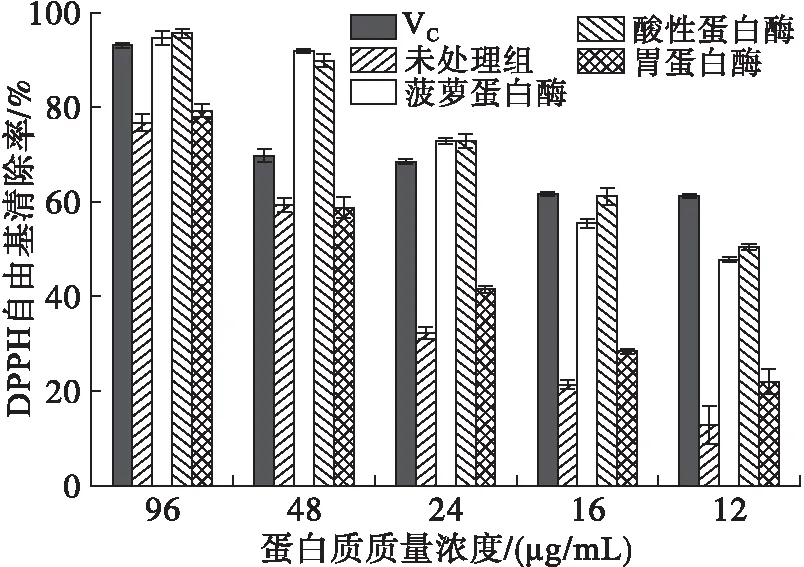
图2 不同蛋白酶酶解产物对DPPH自由基的清除率
由图2可知,3种蛋白酶处理后的蚕豆蛋白酶解产物对DPPH自由基清除率的大小总体依次为酸性蛋白酶>菠萝蛋白酶>胃蛋白酶。经酸性蛋白酶处理后的蚕豆蛋白酶解产物,在蛋白质质量浓度为96 μg/mL时,对DPPH自由基的清除率最高,达95.71%,超过阳性对照VC,并与菠萝蛋白酶处理后的蚕豆蛋白酶解产物对DPPH自由基的清除率(94.66%)相近;此外,经酸性蛋白酶、菠萝蛋白酶酶解后的蚕豆蛋白酶解产物对DPPH自由基的清除率明显高于经胃蛋白酶处理后的蚕豆蛋白酶解产物,且清除率随蛋白质质量浓度的升高呈现稳步上升的趋势。除蛋白质质量浓度为48 μg/mL外,经3种酶处理后的蚕豆蛋白酶解产物,相较于蚕豆蛋白,对DPPH自由基的清除率都有显著提升(P<0.05),说明小分子的肽、氨基酸等物质,相较于大分子蛋白质,对于DPPH自由的基清除具有明显优势,具有很强的抗氧化能力,值得进一步深入研究。
2.4.2 ABTS自由基清除率(见图3)
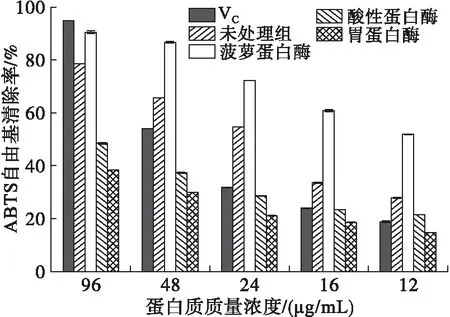
图3 不同蛋白酶酶解产物对ABTS自由基的清除率
由图3可知,经不同蛋白酶处理后的蚕豆蛋白酶解产物相较于蚕豆蛋白,对ABTS自由基的清除率呈现极显著性差异(P<0.01)。同一蛋白质质量浓度下,经菠萝蛋白酶处理后的蚕豆蛋白酶解产物对ABTS自由基的清除率明显高于酸性蛋白酶与胃蛋白酶处理后的蚕豆蛋白酶解产物,当蛋白质质量浓度为96 μg/mL时,对ABTS自由基的清除率最高可达90.53%,ABTS自由基清除率相比于VC较低,但随着其质量浓度的不断降低,ABTS自由基清除率明显高于VC,说明经菠萝蛋白酶处理后的蚕豆蛋白酶解产物具很强的抗氧化能力且具有稳定性。
2.5 蚕豆蛋白酶解产物对α-葡萄糖苷酶的活性抑制率
研究表明,α-葡萄糖苷酶抑制剂可竞争性抑制小肠内α-葡萄糖苷酶的活性,延缓或抑制葡萄糖在肠道的吸收,从而有效降低餐后高血糖[22]。因此,开发对于α-葡萄糖苷酶具有抑制效用的药物成为治疗糖尿病食品或药品的研发热点。本文考察了蚕豆蛋白酶解产物对α-葡萄糖苷酶的活性抑制率,结果如图4所示。
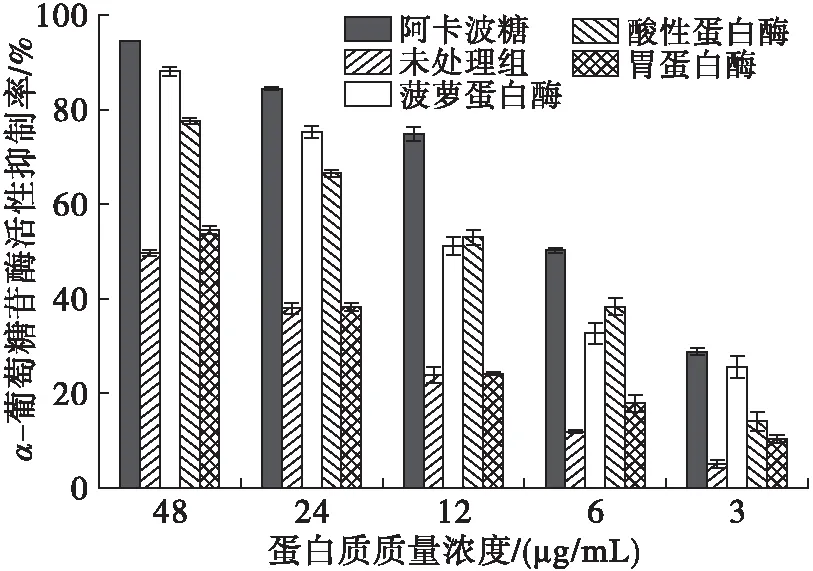
图4 不同蛋白酶酶解产物对α-葡萄糖苷酶的活性抑制率
由图4可知:经菠萝蛋白酶处理后的蚕豆蛋白酶解产物,在蛋白质质量浓度为48 μg/mL时,对α-葡萄糖苷酶的活性抑制率可达88.10%,与阳性对照阿卡波糖(94.42%)相近,同时是未酶解蚕豆蛋白的1.78倍(P<0.01);酸性蛋白酶、胃蛋白酶处理所得蚕豆蛋白酶解产物对α-葡萄糖苷酶的活性抑制率较未处理组也有较大提升,在蛋白质质量浓度为48 μg/mL时,对α-葡萄糖苷酶的活性抑制率分别达到77.63%与54.58%。根据氨基酸检测结果(见表2),推测可能是由于不同蛋白酶酶解所产生的氨基酸含量差异造成的。经菠萝蛋白酶酶解后的蚕豆蛋白酶解产物,异亮氨酸、甲硫氨酸、色氨酸未被检出,但缬氨酸、半胱氨酸含量与其他组相比达到最大值。另外,除天冬酰胺与酪氨酸外,其余氨基酸含量较未处理组有一定增长,同时在菠萝蛋白酶酶解产物中有谷氨酸检出。故此推测,可能是由于以上几种氨基酸对α-葡萄糖苷酶的活性具有一定影响,进而致使菠萝蛋白酶酶解产物对α-葡萄糖苷酶的活性抑制率高于其他蛋白酶处理后的酶解产物,但具体作用机制还有待进一步深入研究。
3 结 论
本文就不同蛋白酶酶解对蚕豆蛋白的生物活性进行比较,研究发现,经不同蛋白酶酶解后的蚕豆蛋白多肽得率极显著升高,作用效果依次为胃蛋白酶>酸性蛋白酶>菠萝蛋白酶。经菠萝蛋白酶和酸性蛋白酶酶解后可明显增加蚕豆蛋白中氨基酸的种类和含量;经菠萝蛋白酶处理后的蚕豆蛋白酶解产物对ABTS自由基的清除率最大可达90.53%,对α-葡萄糖苷酶的活性抑制率可达88.10%,经酸性蛋白酶处理后的蚕豆蛋白酶解产物对于DPPH自由基清除率最大可达95.71%。因此,酶解蚕豆蛋白可以增强蚕豆蛋白自身的生物活性,显著提高其抗氧化能力,有助于发挥其最大的生物价值。

