法舒地尔通过调控糖酵解通路对原代小胶质细胞的影响
张 婧,王玉银,,魏文悦,郭敏芳,杨德兵,马存根,*,尉杰忠,3*
(1.山西中医药大学神经生物学研究中心,山西太原 030024;2.山西大同大学脑科学研究所,山西大同 037009;3.山西大同大学附属第一医院,山西大同 037009)
许多研究表明小胶质细胞在阿尔茨海默病(Al⁃zheimer disease,AD)等多种认知功能障碍的疾病过程中发挥重要作用。小胶质细胞通过吞噬清除和提供营养来维持脑内稳态平衡。激活的小胶质细胞具有2种完全相反的状态及机制[1]:一方面小胶质细胞会产生大量的促炎因子如白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleu⁃kin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis fac⁃tor-α,TNF-α)等,并产生活性氧ROS和一氧化氮合酶(inducible nitric oxide synthase,iNOS)从而损害神经元和大脑组织;另一方面小胶质细胞会在脑内清除吞噬Aβ,减少神经损伤,发挥神经保护的作用[2]。因此,小胶质细胞最近已经成为AD发病机制研究中的关键角色。
研究表明法舒地尔(fasudil)可减轻免疫炎症反应,恢复神经功能,改善AD疾病模型的学习认知能力[3],还可以促进神经元再生,减少脑内Aβ-42的生成[4],通过侧脑室注射还可促进锥体突触伸长[5]。
基于以上研究,我们通过脂多糖(LPS)激活原代小胶质细胞来研究法舒地尔对细胞炎症水平的影响,以及对Aβ的吞噬作用,并研究其可能的作用机制。结果发现法舒地尔可以降低原代小胶质细胞的促炎因子水平,提高原代小胶质细胞的Aβ吞噬能力,下调小胶质细胞HIF-1α的转录活性来降低糖酵解过程相关酶的相对表达量,抑制糖酵解的过程,从而增加ATP的产生,提示法舒地尔是治疗AD的潜在药物。
1 材料与方法
1.1 材料
原代小胶质细胞由山西大同大学脑科学研究所分离培养。DMEM(Gibco)培养基购自Life Tech⁃nologies Corporation,胰酶及胎牛血清购自Biologi⁃cal Industries,盐酸法舒地尔注射液购自天津红日药业股份有限公司,蛋白酶抑制剂cocktail购自Selleck公司,Aβ(6E10)抗体购自Covance(SIG-39320),RNA提取试剂Trizol reagent购自Thermal,One-Step gDNA Removal and cDNA Synthesis Super⁃mix购自全式金生物技术有限公司,染料法荧光定量PCR试剂盒ultra SYBR MIX(with ROX)购自康为世纪生物技术有限公司,ATP试剂盒CellTiter-Glo@ Luminescent Cell Viability Assay购自Pro⁃mega。PCR引物由primer bank以及在线Primer 3.0软件设计并订购于Life Technologies公司。
1.2 原代细胞培养
新生小鼠(出生后1~3d)剥离出大脑内海马组织,剪碎后转移到培养皿,加入0.25%胰蛋白酶(BI)和10 μL DNAse I (10 mg/mL),置于37 ℃细胞培养箱消化20 min后,加入10%FBS的DMEM培养基中和,4 ℃800 r/ min离心5 min。弃上清,加入1 mL原代培养基重悬细胞,将细胞稀释后种到包被的培养皿中每3 d更换1次培养基,敲除下来即为的原代小胶质细胞。
1.3 细胞外ATP检测
实验前1 d将敲下来的原代小胶质细胞种到96孔细胞培养板,细胞密度介于50%~70%。细胞贴壁后,于检测前12 h将LPS及法舒地尔加入细胞内。在检测时间每孔取25 μL PBS加入25 μL ATP检测试剂,弃上清,按照试剂盒操作将配置好的工作液加入96孔板内,静置10 min。上清转移至白板用酶标仪检测,然后弃所有上清,细胞加入50 μL细胞裂解液提取蛋白。总ATP量比总蛋白量得到细胞分泌ATP的能力。
1.4 细胞Aβ吞噬实验
实验前1 d将敲下来的原代小胶质细胞种到96孔避光黑色细胞培养板,细胞密度介于50%~70%,并将Aβ单倍体放置于37 ℃摇床寡聚过夜。按设置时间加入药物,于检测前4 h将Aβ寡聚体加入,在检测时间吸出上清,加入100 μL PBS后用酶标仪检测发光度。Cyto D为阴性对照,而NaR为阳性对照[6]。
1.5 荧光定量PCR
取1 mg RNA作为模板,反转录按One-Step gDNA Removal and cDNA Synthesis Supermix进行PCR扩增,定量反应在荧光定量PCR仪上进行。
1.6 统计学分析
数据采用GraphPadPrism 7.0统计软件进行处理。检测指标多组间比较采用One-Way ANOVA分析,两两比较采用Dunnett’sT检验。P<0.05表示差异有统计学意义。
2 研究结果
2.1 法舒地尔对LPS刺激的原代小胶质细胞炎症水平的影响
结果显示,与对照组相比,经过10 μg/mL法舒地尔处理后,iNOS在LPS刺激6、12 h后的mRNA表达水平明显下降,同时TNF-α在LPS刺激3 h时表达水平下降最为显著,而IL-6的整体mRNA表达水平均明显下降,见图1。

图1 经法舒地尔处理后的原代小胶质细胞在LPS刺激下促炎因子变化
2.2 法舒地尔对原代小胶质细胞Aβ吞噬作用的影响
研究表明,在原代小胶质细胞经过不同浓度的法舒地尔处理后,与对照组相比,法舒地尔浓度为5 μg/mL时增加最显著,而法舒地尔浓度为10 μg/mL时Aβ吞噬能力有明显增加,见图2。
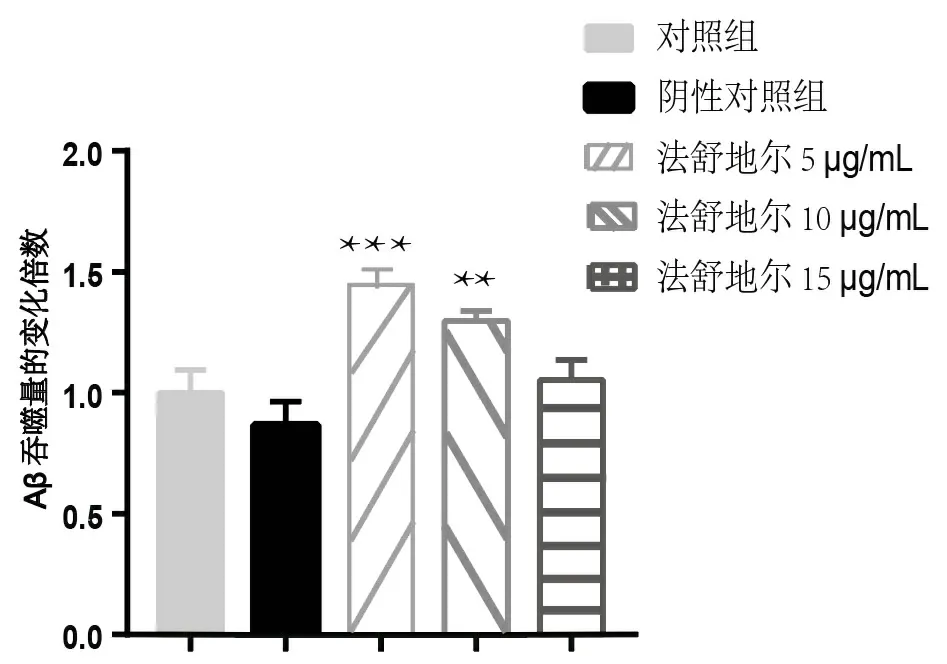
图2 原代小胶质细胞在不同浓度的药物处理后Aβ吞噬量变化
2.3 法舒地尔对原代小胶质细胞新陈代谢功能的影响
结果显示,在药物处理后,与空白对照组相比,法舒地尔浓度为10 μg/mL时的总ATP量与总蛋白量的比值明显升高,法舒地尔浓度为5 μg/ mL时增加最为显著(图3)。而在10 μg/mL法舒地尔处理后,糖酵解过程的相关酶己糖激酶1(HK1)、丙酮酸脱氢酶激酶1(PDK1)、磷酸甘油酸激酶1(PGK1)、乳酸脱氢酶(LDHA)以及缺氧诱导因子-1α(HIF-1α)的mRNA表达水平均有不同程度的下降,其中以HK1和PGK1的下降最为显著,见图4。
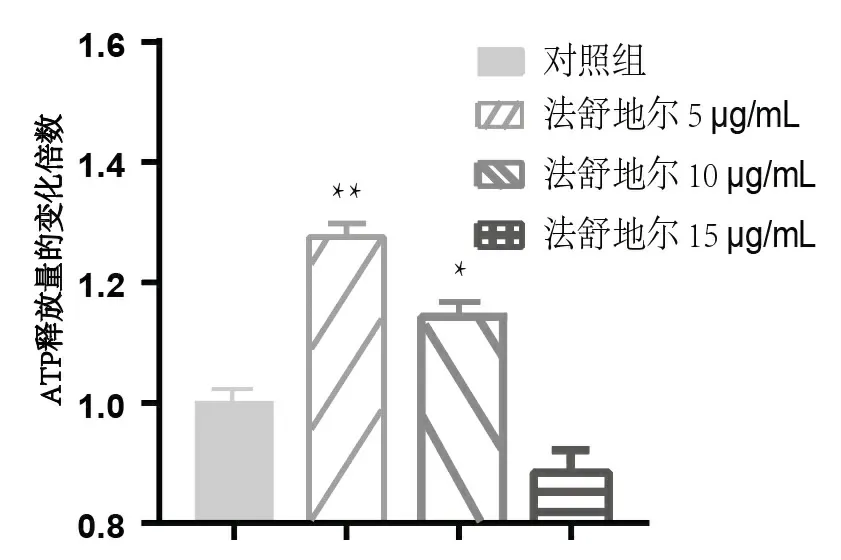
图3 在不同药物浓度下原代小胶质细胞总ATP产量
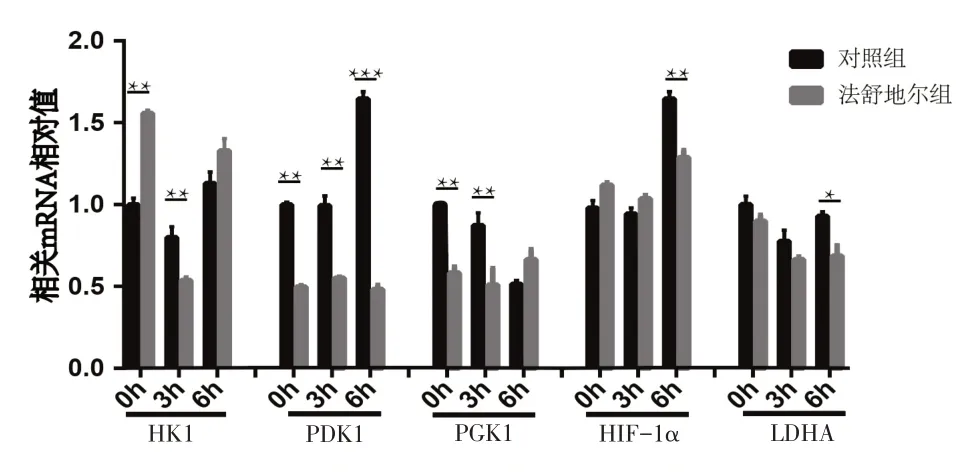
图4 原代小胶质细胞在法舒地尔处理、LPS刺激后糖酵解相关酶的mRNA变化
3 讨论
免疫系统介导的神经炎症在AD中发挥着巨大的作用[8]。我们首先构建细胞炎症模型,激活原代小胶质细胞。研究发现用法舒地尔处理后激活原代小胶质细胞明显使促炎因子IL-6、TNF-α和iNOS表达水平下降。这表明,法舒地尔在原代小胶质细胞激活后,减少了炎症反应。法舒地尔还可以显著促进原代小胶质细胞的吞噬作用,并可能通过这一途径减少脑内Aβ,成为治疗AD的潜在药物。
研究表明维持小胶质细胞的新陈代谢,对清除Aβ至关重要[9-10]。我们观察了药物对原代小胶质细胞代谢功能的影响,结果显示原代小胶细胞在经过不同浓度的法舒地尔处理后,细胞分泌ATP的能力明显增加,说明加入药物后细胞新陈代谢能力明显增加。我们进一步用脂多糖(LPS)刺激原代小胶质细胞来构建细胞炎症模型,发现小胶质细胞糖酵解过程的相关酶HK1、PDK1、PGK1、LDHA以及HIF-1α的mRNA水平均有不同程度的下调,说明小胶质细胞的糖酵解过程明显减少。有研究显示NFκB信号通路的活化可上调HIF-1α的转录活性[7]。HIF-1α被报道是细胞能量代谢的关键调控因子,而高表达的HIF-1α能够激活糖酵解相关酶的转录水平[11],因此HIF-1α减少可以减少糖酵解相关酶的激活从而减弱糖酵解过程。小胶质细胞是脑内固有免疫细胞,而体内免疫细胞介导炎症反应主要通过糖酵解提供能量[12]。我们的研究结果表明法舒地尔能使小胶质细胞的糖酵解过程明显减少,从而减少细胞炎症的能量供给使LPS刺激的原代小胶质细胞内的炎症水平下降。
总之,我们的研究表明法舒地尔可能通过下调小胶质细胞HIF-1α的转录活性来降低糖酵解过程相关酶的表达,抑制糖酵解过程从而增加ATP的产生,从而维持小胶质细胞的新陈代谢来减轻炎症反应,增加吞噬作用。

