利用NASH大鼠原代肝细胞与原代Kupffer细胞共培养建立NASH原代细胞模型*
吴 霞, 张玉蓉, 朱晓宁, 汪 静
(1. 西南医科大学中西医结合学院, 四川 泸州 646000; 2. 西南医科大学附属中医医院肝胆病科, 四川 泸州 646000)
非酒精性脂肪性肝炎(nonalcoholic steatohepatitisv,NASH)是一种以肝细胞损伤、炎症细胞浸润和肝细胞气球样变性为特征的炎症性肝病[1]。肝脏主要是由肝实质细胞和肝非实质细胞组成,其中非实质细胞占40%,主要包括肝窦内皮细胞、肝Kupffer细胞、肝星状细胞、胆管细胞和多种免疫细胞。在饮食诱导的NASH模型中已经发现肝Kupffer细胞数量显著增加,Xiong等人[2]利用单细胞RNA测序技术发现NASH肝脏中的细胞结构发生显著的变化,Kupffer细胞在其中起到重要作用。Kupffer细胞是肝细胞受到损伤时的第一反应细胞,其可以诱导肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)、趋化因子和单核细胞的募集[3],进而激活肝细胞炎症信号通路,触发肝损伤[4],所以抑制kupffer细胞的炎症反应有助于NASH的治疗。目前肝脏研究中,肝病理切片应用较广,但是其无法动态观察细胞变化,所以细胞研究成为机制研究的主角。目前很多研究在肝细胞中加入肝非实质细胞进行共培养以观察细胞之间的相互作用关系[5],所以对肝实质细胞与非实质细胞的分离与纯化研究对于体外肝脏细胞模型研究具有重要的意义。本研究的目的在于分离并提纯NASH大鼠原代肝细胞以及原代肝Kupffer细胞进行共培养,建立NASH大鼠体外细胞模型,为之后的NASH相关药物研究提供技术支持。
1 材料与方法
1.1 实验动物
选择SPF级雄性SD大鼠40只,体质量( 180±20) g,实验动物由西南医科大学实验动物中心提供(实验动物生产许可证,SCXK(川)2018-17),适应性饲养一周后(实验动物使用许可证,SYXK(川)2018-065),随机分为NASH组和对照组,每组各20只,NASH组大鼠采用高脂饲料(88%基础饲料+10%猪油+ 2%胆固醇,由成都达硕实验动物公司提供)饲养,对照组大鼠采用普通饲料(由西南医科大学实验动物中心提供)饲养,造模开始8周末,随机从两组中抽取2只大鼠,观察肝组织病理变化,根据肝组织病理结果判断是否造模成功,NASH评分系统见下表1。
1.2 试剂
ALT,AST试剂盒(南京建城生物工程研究所,C 009-2,C 010-2)、油红O染色试剂盒(Solarbio,G 1261-2),TNF-α(Abcam,ab6671)、MCP-1(Abcam,ab25124)和IL-1β(Abcam,ab9722)抗体,Percoll(Solarbio,P8370-100ml),DMEM高糖培养基(GIBCO,C11995500BT),胎牛血清(PAN),青链霉素溶液(100X)(beyotime,C0222),氢化可的松(Solarbio,G8450-5g),EDTA.2Na(Solarbio,E8030-100g),4-(2-羟乙基)-1-哌嗪乙磺酸(HEPES)(solarbio,H8090-25g),胶原酶Ⅳ(Solarbio,C8160-100mg),RIPA裂解液(bioteke,PP1901)。
1.3 实验溶液的配制
Krebs Ringer Buffer(KRB):NaCl 、NaHCO3、KCl、HEPES、D-Glucose,调pH至7.2~7.4,4℃保存。Buffer I: KRB中加入EDTA,调节pH至7.2~7.4, 0.22 μm过滤保存。Buffer II: 30 mg IV型胶原酶加入100 ml KRB配成0.03%的IV型胶原酶灌注液,再加入1.2 mmol/L CaCl2激活胶原酶。percoll 细胞分散液:100%分散液: 10×PBS: percoll(瑞典GE Healthcare)原液=1∶9;50%分散液: 100%分散液利用1×PBS等比稀释;25%分散液: 50%分散液利用1×PBS等比稀释;4℃保存备用。
完全培养基:10%胎牛血清、1%青链霉素溶液、500 U/L 胰岛素、氢化可的松,DMEM高糖培养基。
1.4 原代肝细胞以及原代Kupffer细胞分离方法
动物准备以及胶原酶原位灌注方法均参考彭孟云等实验方法[6]。
原代肝细胞分离: 经过消化得到的细胞悬液,通过70 μm组织过滤筛将细胞悬液过滤到50 ml离心管中,700 r/min离心3 min,分离上清与沉淀,上清用于kupffer细胞分离,细胞沉淀加入10 ml完全培养基,取15 ml离心管两支,分别按照细胞悬液:50%percoll细胞分散液=3∶4加入离心管中,1 500 r/min 离心5 min,弃上清,重悬并合并细胞悬液, 1 000 r/min离心3 min,弃上清,加入培养基,台盼蓝鉴定细胞活性,计数后按照2×105的细胞密度于6孔细胞培养板中培养,6 h后首次换液。
原代Kupffer细胞分离:上述步骤中得到的上清利用1 500 r/min离心5 min得到细胞沉淀,弃上清,加入8 ml完全培养基,重悬,准备两支15 ml离心管,第一层缓慢加入50%percoll分散液,第二层缓慢加入25%percoll分散液,第三层缓慢加入细胞悬液,2 500 r/min离心15 min,离心管中的液体一共分为四层,第一层为脂肪沉淀以及死亡的细胞,第二层为培养基,第三层为絮状,位于50%percoll分散液和25%分散液之间,该层为丰富的kupffer细胞,第四层为红细胞以及肝细胞,小心吸取第三层细胞悬液,于1 500 r/min离心5 min,弃上清,得到原代kupffer细胞,细胞计数后按照1×105细胞密度于6 cm培养皿中培养,2 h后首次换液。
1.5 原代肝细胞以及原代Kupffer细胞鉴定
原代肝细胞以及原代Kupffer细胞分别利用免疫荧光CK-18以及CD68进行鉴定:弃培养基,PBS洗3次,10%多聚甲醛固定15 min,0.5%TritonX-100室温通透20 min,10%山羊血清封闭30 min。一抗(1∶200稀释)4℃孵育过夜,荧光二抗(1∶500稀释)孵育1 h,DAPI孵育10 min,荧光显微镜下观察并拍照。
吞墨实验进一步鉴定Kupffer细胞的吞噬能力:Kupffer细胞培养24 h后,利用PBS轻柔洗两次,于含1%浓度碳素墨水培养基中孵育6 h,PBS洗3~5次,显微镜下观察。
1.6 建立细胞共培养体系
细胞培养48 h后,细胞活力>90%时以原代肝细胞∶原代Kupffer细胞=6∶1比例进行两种细胞共培养,共培养48 h后可收集细胞及上清液。
1.7 原代肝细胞脂质沉积及肝功能的鉴定
倒去培养液后利用PBS清洗1~2次,10%中性甲醛固定30 min,油红染色10 min,60%异丙醇脱色,苏木素染核2~5 min,显微镜观察。异丙醇脱色利用酶标仪对油红O染色进行定量分析。原代肝细胞AST、ALT测定利用ALT,AST试剂盒(南京建城生物工程研究所,C 009-2,C 010-2),根据试剂盒使用说明书进行测定。
1.8 Western blot检测原代Kupffer细胞炎症因子表达情况
细胞于冰上裂解30 min, SDS-PAGE法分离裂解物,将其转移到PVDF膜上,抗体(1∶1 000)孵育后,再与抗兔抗体或抗鼠抗体(1∶5 000)共同孵育,增强化学发光系统检测蛋白质条带,ImageJ软件进行分析。
1.9 统计学处理
2 结果
2.1 NASH大鼠模型的建立
根据HE染色结果,对照组大鼠肝组织结构完整,肝细胞排列整齐,细胞内未见脂肪空泡,NASH组肝组织结构欠完整,细胞排列不整齐,细胞明显肿胀,细胞内可见大小不等的空泡(图1),经过NASH评分脂肪变+小叶内炎症+气球样变≥4 分,NASH造模成功。
2.2 NASH大鼠原代肝细胞、kupffer细胞的分离和提纯
本次实验采用胶原酶原位灌注分离NASH大鼠原代肝细胞和原代Kupffer细胞,该方法可以一次获得原代肝细胞以及原代Kupffer细胞,同时获得原代肝细胞数量约为1~2×107-8cells/ml,原代Kupffer细胞数量约为1~2×105-6cells/ml,在倒置光学显微镜下观察到肝细胞为不规则铺路石样连接(图2D),利用CK-18免疫荧光进行鉴定,CK-18呈现阳性表达,均匀分布于原代肝细胞细胞质内,几乎未见其他肝非实质细胞表达(图2E);Kupffer细胞在光学显微镜下观察可见细胞呈圆形和不规则形,呈贴壁生长(图2A),吞墨实验可见Kupffer细胞吞噬墨汁后呈现黑色(图2C),CD68免疫荧光鉴定为Kupffer细胞(图2B)。
2.3 NASH大鼠原代细胞脂质沉积以及细胞炎症鉴定
原代肝细胞培养48 h后利用油红O染色检测细胞脂质沉积情况,发现NASH大鼠原代肝细胞脂质沉积情况明显多于对照组(图3),同时利用ALT/AST试剂盒检测原代肝细胞,与对照组相比,NASH组肝细胞ALT、AST明显升高,细胞存在明显的损伤(P<0.05,表2),另外Kupffer细胞相关炎症因子TNF-α、MCP-1以及IL-1β明显高于对照组(P< 0.05,表3,图4)。
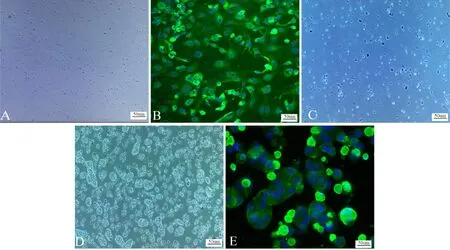
Fig. 2 Primary Kupffer cells (A)(×100), primary Kupffer cells CD68 Immunofluorescence staining (B)(×200), Kupffer cell swallowing experiment (C)(×100), primary hepatocytes (D)(×100), primaryhepatocytes CK-18 immunofluorescence staining (E)(×200)
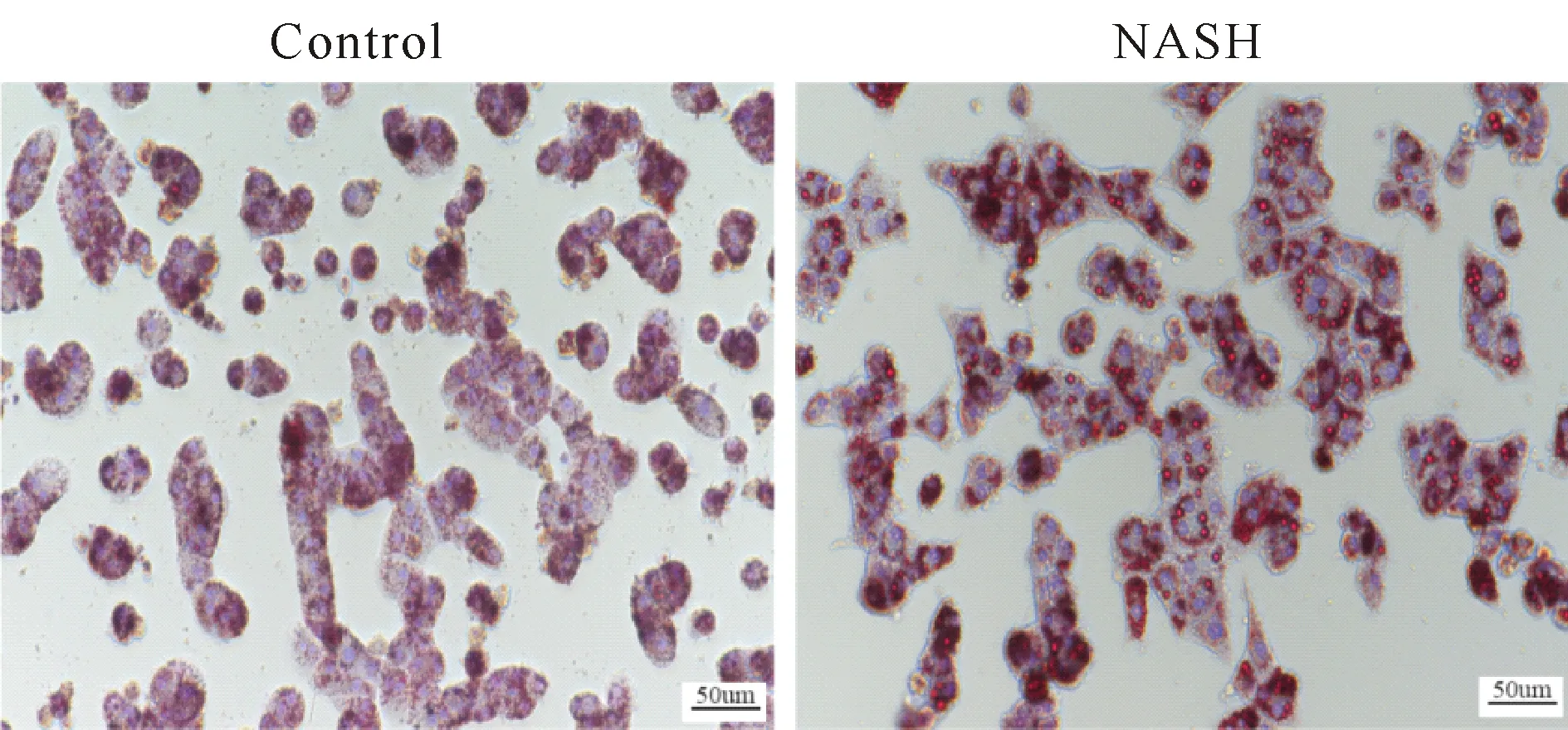
Fig. 3 Normal primary hepatocytes and NASH primary hepatocytes observed by oil red O staining(×200)

Tab. 2 The contents of AST and ALT in primary hepatocytes(U/L, n=5)

Tab. 3 Protein expressions of TNF-α,IL-1β,and MCP-1 in kupffer cells ( n=3)
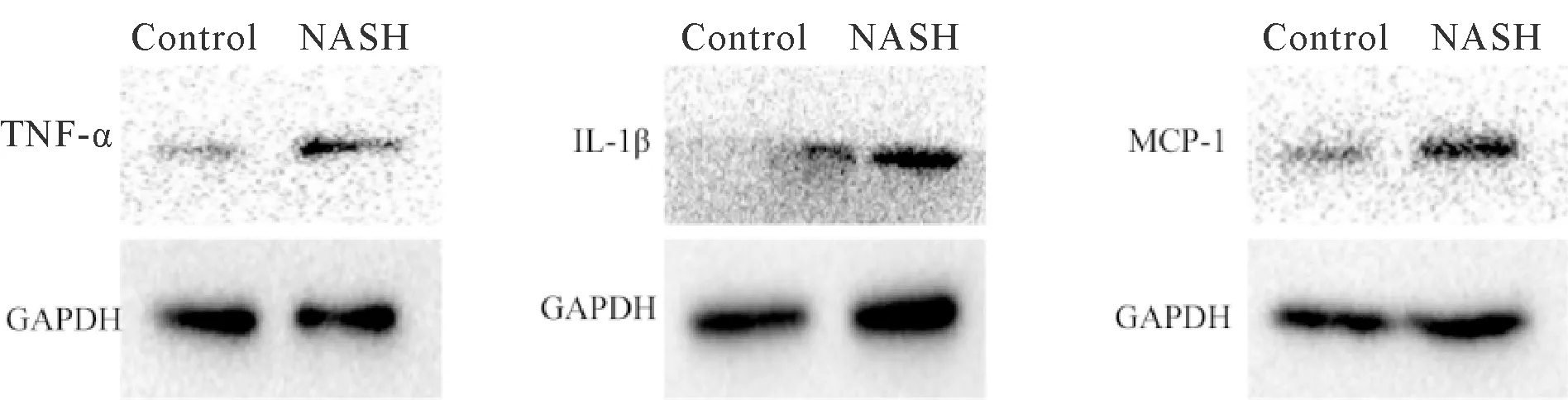
Fig. 4 The levels of cytoinflammatory factors TNF-α, IL-1β and MCP-1 in kupffer cells detected by Western blot
2.4 原代肝细胞与原代Kupffer细胞共培养状态
原代肝细胞与原代Kupffer细胞按照6∶1的比例进行共培养,培养48 h后,光学显微镜下可以观察到原代肝细胞互相链接成小岛状,细胞分裂出新的肝细胞,同时原代Kupffer细胞与肝细胞缝隙中生长(图5),两种细胞共培养生长状态良好,共培养体系建立成功。

Fig. 5 co-culture of the primary hepatocytes and Kupffer cells(×100)
3 讨论
细胞培养以其培养简单、易操作、费用低、可以大量应用等优点在生物学与组织学中得到广泛的应用,但由于脱离了机体内环境,细胞功能受到一系列理化因素的影响,与人体内环境存在一定的差距[7]。而细胞共培养则能够弥补单层细胞培养的缺陷,可以更好观察细胞与细胞、细胞与培养环境之间的相互作用,以维持细胞功能,更加接近人体内外生理和病理模型[8,9,10]。曹勇军等[11]认为细胞共培养能够很好地模拟机体内部生理结构关系,为细胞信号交流提供条件。而在体外细胞模型中,将肝脏非实质细胞与肝细胞进行共培养,对于药物开发以及代谢性疾病的研究具有重要的作用。
在本次研究中,证实一种从NASH模型SD大鼠中分离原代肝细胞以及原代Kupffer细胞并进行体外共培养的方法,该方法简便、易操作,获得的细胞纯度高,存活率好,可用于后续NASH相关细胞机制研究。大鼠肝内原代细胞的分离方法众多,包括胶原酶消化法、梯度密度离心法、磁珠分选法、差速离心法、贴壁法等[12,13,14],而目前众多实验研究均采用胶原酶消化法与梯度密度离心法相结合的方法进行细胞分离[15],如孟香红等[16]利用该方法成功分离并培养SD乳鼠原代心肌细胞。胶原酶原位灌注消化肝脏能够明显降低酶的使用浓度,节约成本。而percoll梯度密度分离提取肝细胞以及肝Kupffer细胞的技术已经得到大量的研究证实,利用细胞大小的不同,采用percoll密度离心法分离肝内细胞效率高、纯度好。另外,肝内不同细胞贴壁时间的不同,可以进一步对细胞进行提纯,如Kupffer细胞因自身粘附性强,能在2 h内贴附于玻璃或者塑料的表面[17,18],通过换液和PBS冲洗可以进一步提纯细胞。目前针对大鼠原代细胞的分离与培养已经有众多的文献报道,但是对于NASH模型大鼠原代细胞的分离以及共培养细胞技术报道较少[19]。NASH是临床上较为常见的一种疾病,其中肝Kupffer细胞在细胞损伤以及炎症方面具有重要的作用[20]。本研究利用高脂饮食喂养SD大鼠建立NASH大鼠模型,从NASH大鼠中分离并提纯原代肝细胞以及原代Kupffer细胞,我们发现,NASH模型大鼠分离获得的原代Kupffer细胞与正常大鼠相比可分泌大量的TNF-α、IL-1β以及MCP-1炎症因子。同时原代肝细胞中可见大量脂质沉积以及AST、ALT的升高,可见在损伤细胞模型中,炎症因子的升高水平与肝细胞的损伤程度是呈密切关系。本次研究采用比例直接接触共培养的方法对原代肝细胞和原代Kupffer细胞进行共培养,这种方法能够接触式培养保留细胞连接信息,使得培养的细胞更加接近体内自然状态。本研究分别对原代肝细胞与Kupffer细胞的共培养比例进行探究,分别采用1∶1,2∶1,3∶1,5∶1,6∶1等比例,由于原代Kupffer细胞的分裂和增殖速度明显高于原代肝细胞,所以本次研究发现当比例为6∶1时,细胞生长状态最好,细胞活性高,能够达到后续实验要求的存活时间。利用原代肝细胞与原代Kupffer细胞进行共培养可以进一步在细胞水平上研究NASH的发生发展机制以及后续的药物研究。本次研究仍然存在一定的局限性,如本研究只探讨了肝细胞与Kupffer混合培养,但是并未进一步观察传代后肝细胞的脂肪变性是否会消失等,有待在接下来的实验中进一步观察研究。

