耕作模式对甘肃天水马铃薯根内微生物多样性的影响
康利娟,金 明,张彩虹,魏玉树,单卫星,强晓玉
(西北农林科技大学 农学院,陕西杨凌 712100)
植根于土壤中的植物会直接与丰富多样的土壤微生物相互作用、相互适应,利用“植物-微生物”互作实现互惠互利[1]。一方面,微生物可将营养物质转化,供植物直接吸收和利用;另一方面,微生物可通过根系分泌物从植物中获得营养和能源物质(单糖、多糖、氨基酸、有机酸和蛋白质等)[2]。有益的土壤微生物还有助于植物抵抗病原体、保持水分并合成促进生长的激素[3]。研究表明,根部相关的微生物互作可能比在土壤中大部分微生物的互作更加复杂,并且大多数互作都是积极的,说明根际具有更大的互作潜质[4]。
近年来,高通量测序的发展为不同的植物微生物群落的组成和结构提供了新的见解。Peiffer等[5]在不同的田块,对种植有随机排列的27个品种的玉米自交系地块,进行田块土壤以及玉米根际土的细菌16s rRNA基因测序分析,结果表明,玉米自交系的根际土壤微生物多样性低于田间土壤微生物多样性,但是玉米根际微生物具有显著的遗传变异特性,并且发现,在不同地块的同一自交系之间具有更大的遗传变异; Keark等[6]对抗青枯病具有显著差异的两个番茄品种(Hawaii7996:抗病品种;Moneymaker:感病品种)的根际微生物进行宏基因组测序分析,发现在抗病品种Hawaii7996的根际含有比感病品种更丰富的黄杆菌基因组,通过进一步的功能验证,黄杆菌TRM1能够有效地抑制感病番茄品种青枯病害的发生。
根部内生菌生存于宿主植物根部组织中,与宿主之间有密切的相互作用。内生菌能够促进宿主植物从周围环境中获取营养物质并促进其生长[7],提高宿主植物对干旱、低温等非生物逆境的适应能力[8]。同时,内生菌还能够协助宿主植物抵抗病、虫害等生物迫害,例如,印度梨形孢Piriformosporaindica是最早从印度沙漠的灌木根部分离获得的根部内生真菌,其具有广泛的寄主范围,能够定殖于植物的根部细胞,进而促进植物的生长以及抗逆性;同时,印度梨形孢对植物根部的定殖还可增强寄主植物的诱导系统抗性,从而有效抵御叶部病原菌对寄主植物的侵染[9-10]。
不同的耕作模式会形成不同的土壤环境,影响土壤微生物的数量与结构,进而影响地上植物的生长发育。土壤微生物是维持土壤肥力的重要组成部分,也是土壤物质循环的主要推动者。同时,土壤环境的变化,例如作物类型、施肥、灌溉、覆盖及种植模式等因素的变化,会对土壤微生物的数量和结构产生显著影响,进而影响土壤养分的转化与释放[11]。通过玉米-大豆间作[12]、大豆连作[13]、小麦-豌豆轮作[14]等不同的耕作模式的研究表明,不同的耕作模式会影响土壤微生物的数量与分布,从而影响土壤肥力与植物的生长。一个典型的关于太子参耕作模式对于土壤微生物影响的研究表明[15],连作导致太子参根际土壤细菌和好气性自生固氮菌数量极显著下降,相反,真菌、放线菌、厌气性纤维素分解菌数量极显著增加,而硝化细菌数量变化不显著;与太子参-水稻轮作的土壤相比,太子参连作的土壤细菌种(属)略有减少,其中致病菌和病原菌种(属)增多,并出现一些具有拮抗功能的链霉菌属(种);真菌种(属)则表现出上升的趋势,然而,不同的耕作模式是否直接或间接地影响植物根内微生物的多样性特征及群落组成尚有待深入研究。
马铃薯(SolanumtuberosumL.)属茄科1a生草本植物,是继水稻、小麦、玉米之后的第四大主粮作物。而我国近年来种植面积600万 hm2左右,占世界的近1/3,在农村经济发展中发挥越来越重要的作用。西北地区为我国马铃薯主产区,然而该地区普遍缺水少肥,生产条件差,病虫害发生严重,平均单产仅为15000kg/hm2,只有发达国家的1/3,使得粮食生产特别是薯类生产处于紧平衡状态。因此,马铃薯产业可持续发展和农民脱贫致富能力受到严重制约。目前,关于马铃薯的研究主要集中在马铃薯抗病基因挖掘和病原菌效应蛋白-靶标蛋白互作等机理的解析[16],而不同耕作模式下的根系微生物多样性特征及其如何影响和调控马铃薯的生长和抗逆性尚不明确。
本研究选取甘肃省天水马铃薯-小麦轮作模式为典型代表,以马铃薯-小麦轮作田块的土壤特性和不同生长发育期的根内微生物群落作为试验组,以马铃薯单一连作田块的土壤特性和马铃薯不同生长发育期的根内微生物群落为对照组,借助高通量测序技术比较分析不同耕作模式下,马铃薯主栽品种‘天薯11号’的根内微生物多样性特征,并进一步明确不同耕作模式下的马铃薯根内核心菌群,为推进西北旱区马铃薯的绿色高效生产提供理论依据。
1 材料与方法
1.1 材 料
试验在国家马铃薯产业技术体系天水综合试验站的马铃薯育种田和繁种田进行,选取具有代表性的耕作模式地块,分别于2018年7月和8月在马铃薯生长期和块茎膨大期进行了田块土和马铃薯根样品的采集,采样地块分别为:连作3 a的马铃薯地块和“马铃薯-小麦”轮作5 a的马铃薯地块。
马铃薯品种为‘天薯11号’,样品缩写如下:GCB表示连作种植马铃薯地块,生长期根样品;GRB表示轮作种植马铃薯地块,生长期根样品;GCC表示连作种植马铃薯地块,块茎膨大期根样品;GRC表示轮作种植马铃薯地块,块茎膨大期根样品。
1.2 方 法
1.2.1 采样方法 依据5点取样法分别在两个地块各取5个样方作为生物学重复,每个样方中依据“S”型采样法取地下10~15 cm土壤,10个点混合在一起作为1个样方,即为田块土的1个生物学重复;在每个样方中随机选取 3~4株马铃薯植株连根拔起,轻轻抖落掉根上的大块土壤,将根剪下放进无菌塑封袋,用冰盒将土壤和根样品运回实验室,根样品保存至-80 ℃以待后续 测序。
田块土壤一部分用于土壤含水量的测定,另一部分用于其他性质的检测。室温风干一周,研磨后分别过1 mm和0.15 mm筛,依据四分法装于50 mL的离心管中,每个样品装两管,一管备用,室温保存。
1.2.2 理化性质测定方法 土壤含水量的测定(烘干法):将采回的土壤捏碎混匀后,称20 g左右(精确至0.01 g)鲜土样放入称量好的铝盒中,做好标记,在105 ℃的高温烘箱中干燥24 h,取出样品,待铝盒放凉后称量铝盒和土样干质量,用土样鲜质量和干质量之差来计算水分含量。计算公式为:土壤水分含量=[(鲜土样质量+铝盒质 量)-(烘干土质量+铝盒质量)] /[(烘干土质 量+铝盒质量 g)-(铝盒质量 g)]× 100%。
土壤pH的测定:①试剂准备。无CO2去离子水,将去离子水煮沸10 min去除CO2,冷却时用保鲜膜封住烧杯口,隔绝空气。②测定方法。称取过1 mm孔径筛的风干土8.0 g于小烧杯中,加入20 mL的事先准备好的无CO2去离子水,置于磁力搅拌器上搅拌1 min,使土粒充分分散,放置30 min后用pH计测定土壤pH。
土壤有机质测定(国标法):①仪器设备。万分之一天平、铁丝笼、油浴锅、滴定剂、移液枪。②所需试剂。0.8 mol/L K2Cr2O7标准溶液:称取130 ℃烘干的K2Cr2O7(GB642-77,分析纯) 39.224 5 g溶于蒸馏水中,定容至1 000 mL,贮于试剂瓶中,备用;H2SO4:浓硫酸(H2SO4,GB625-77,分析纯);0.2 mol/L FeSO4溶液:称取硫酸亚铁(FeSO4·7H2O,GB664-77,分析纯)56.0 g溶于蒸馏水中,加5 mL H2SO4,水稀释至1 000 mL;邻菲罗啉指示剂:称取邻菲罗啉(GB1293-77,分析纯)1.485 g和FeSO4·7H2O 0.695 g,溶于100 mL蒸馏水中,贮于棕色滴瓶中,备用;SiO2:二氧化硅(SiO2,Q/HG22-562-76,分析纯)。③测定方法。用分析天平准确称取过0.15 mm筛孔的土样0.3~0.5 g(精确到 0.000 1),放入干燥的硬质试管中(应直接倒入试管底部避免粘在管壁上)。用移液枪加入0.8 mol/L K2Cr2O7标准溶液5 mL,轻轻摇动试管,使试管内土样分散。再沿管壁缓慢加入浓H2SO45 mL,充分摇匀;把试管插入铁丝笼中并放入预先加热至185~190 ℃的油浴锅中,此时油温下降至170~180 ℃,保持此温度。当试管内容物开始沸腾产生气泡时,计时煮沸5 min(温度和时间对测定结果影响较大,应准确计时),取出试管,稍冷却后擦净管外油液;将试管内容物用蒸馏水洗入三角瓶中,瓶内总体积不要超过60~70 mL,加入2~3滴邻菲罗啉指示剂,用0.2 mol/L FeSO4溶液滴定,溶液颜色由橙黄变绿再突变到棕红色即为终点,记录FeSO4滴定的体积(V);每一批(即上述每铁丝笼或铝块中)样品测定的同时,进行两个空白试验,即取0.500 g粉状SiO2代替土样,其他步骤与试样测定相同。记录FeSO4滴定的体积(V0)取其平均值。计算方法为:土壤有机质(g/kg)=[(c×5/V0)×(V0-V)×10-3×3.0×1.1×1.724]×1 000/(M×k),式中:c=0.8 mol/L,为K2Cr2O7标准溶液浓度;5表示重铬酸钾标准溶液加入5 mL;V0为空白滴定用去FeSO4的体积(mL);V为样品滴定用去FeSO4的体积(mL);3.0表示1/4碳原子的摩尔质量为3.0 g/mol; 1.1为氧化校正系数;M为风干土样质量(g);k为将风干土样换算成烘干土的系数;10-3表示将mL换算为L时的进率。
土壤全氮、磷、钾的测定:①仪器设备。万分之一天平、消煮管、消煮管架、涡旋振荡仪。②所需试剂有浓硫酸和过氧化氢。③土样消煮。称样及加酸:称取磨好的0.15 mm土样0.499 1~ 0.500 9 g(精确至0.000 1 g)于100 mL消煮管中,加入5 mL浓硫酸,在涡旋振荡器上震荡摇匀,过夜放置,以提高消煮速度和效果。消煮:当消煮炉升温到375 ℃后开始加热消煮,加热3~ 4 h至土样为灰白色。具体操作方法为:给消煮管中加入少许过氧化氢,待炉温升至375 ℃时,加入过氧化氢适量,摇匀;之后,每隔30 min加入1次过氧化氢催化剂,直至土壤消煮溶液变为灰白色。定容转移:待消煮管温度稍冷却后,可先加入少量的ddH2O,此后依次增多,但不能超过100 mL;将上述溶液摇匀,转移至新的100 mL容量瓶,加入ddH2O定容至100 mL;将上述溶液充分摇匀,可上下颠倒混匀;将上述定容好的溶液依次过滤至50 mL的离心管中(需待消煮液完全冷却至室温后再定容,将消煮好的样品在4 ℃下保存备用)。④测定。全氮和全磷用高分辨自动化学分析仪测定,全钾用火焰光度计测定。全氮含量 (g/kg)=(机测值-空白值)×10-3×100×10-3/(m×10-3),机测值和空白值的单位为 mg/L,10-3为mL与L间的换算进率,m为称量样品的质量。全钾、全磷计算公式和全氮计算公式一致。
土壤速效氮的测定:①准备工作:在浸提前计算好所需滤纸和KCl的试剂用量,并配置好1 mol/L 的KCl浸提液,备用。将所需的震荡瓶提前用自来水和去离子水洗干净、晾干,做好标记,备用。②浸提:采回的新鲜土样捏碎、充分混匀(难以捏碎的干土样应过1 mm筛)后,称取5 g新鲜土壤,加入1 mol/L 的KCl溶液50 ml(土液比1∶10),在120 r/min下震荡60 min,取出过滤,装入50 mL平底离心管中,盖紧瓶盖(一起震荡的每批样品应包括3个空白作对照和1个标准土样的2个重复。若浸提液不能及时测定,应及时放入4 ℃冰箱冷藏,最好不超过两周)。③测定:用高分辨自动化学分析仪测定硝铵态氮含量,计算前将每一批的测定值减去同一批的空白平均值,土壤硝铵态氮的计算公式为:土壤硝铵态氮含量(mg/kg)=浸提液硝铵态氮含量×浸提液体积/[土壤称样质量/(1+土壤含水量)],式中浸提液硝铵态氮含量单位为μg/mL,浸提液体积单位为mL,土壤称样质量单位为g,土壤含水量单位为%。
土壤速效磷的测定:①准备工作。在浸提之前计算好所需的无磷定量滤纸和NaHCO3试剂用量,并配置0.5 mol/L的NaHCO3浸提液备用,如上准备所需震荡瓶。②浸提。称取过 1 mm筛子的风干土样2.5 g于震荡瓶中,再加入 1 g无磷活性炭粉,加入50 mL的0.5 mol/L的NaHCO3浸提液(水土比20∶1),拧紧瓶盖,室温25 ℃、120 r/min震荡30 min,取下静置30 min后过滤,滤液放于50 mL平底离心管中(由于温度对土壤有效磷的浸提影响显著,要求土壤有效磷的称样、浸提均在有空调的房间进行)。③测定。用高分辨自动化学分析仪测定土壤速效磷的含量,计算前将每一批的测定值减去同一批的空白平均值,计算公式为:土壤速效磷含量 (mg/kg)=(浸提液速效磷含量×浸提液体积)/风干土壤称样质量,式中浸提液速效磷含量单位为 μg/mL,浸提液体积单位为mL,风干土壤称样质量单位为g。
土壤速效钾的测定:①准备工作。计算好所需的滤纸和NH4OAc试剂用量,并配置足量的 1 mol/L的NH4OAc浸提液,将所需的震荡瓶提前用自来水和蒸馏水洗干净,晾干,备用。②浸提。称取过1 mm筛子的风干土样5.00 g,倒入震荡瓶中,加入50 mL的1 mol/L的NH4OAc浸提液(水土比10∶1),拧紧瓶盖,放于振荡器上,在120 r/min下震荡30 min,取下静置20 min后过滤,保存至50 mL的平底离心管中。③测定。用火焰光度计测定土壤速效钾含量,计算前将每一批的测定值减去同一批的空白平均值,计算公式为: 土壤速效钾含量(mg/kg)=(浸提液速效钾含量×浸提液体积)/风干土壤称样质量,式中浸提液速效钾含量单位为μg/mL,浸提液体积单位为mL,风干土壤称样质量单位为g。
1.2.3 Illumina HiSeq测序和分析方法 引物335F (5′-CADACTCCTACGGGAGGC-3′)和769R (5′-ATCCTGTTTGMTMCCCVCRC-3′)用来扩增植物的内生细菌;引物ITS1F (5′-TGCGTTCTTCATCGATGC-3′)和ITS1R (5′-GCTGCGTTCTTCATCGATGC-3′)用来扩增真菌的ITS1高变区。利用双末端测序(Paired-End)的方法,构建小片段文库,基于Illumina HiSeq测序平台进行测序。对原始数据进行拼接(FLASH,version 1.2.11),将拼接得到的序列进行质量过滤(Trimmomatic,version 0.33),并去除嵌合体(UCHIME,version 8.1),进而得到高质量的Tags序列。在相似性97 %的水平上对序列进行聚类(USEARCH,version 10.0),以测序所有序列数的0.005 %作为阈值过滤OTUs(Operational Taxonomic Units)。通过细菌Silva和真菌Unite数据库对OTUs进行聚类分析,进一步进行α多样性分析(Alpha Diversity)、β多样性分析(Beta Diversity)和显著物种差异分析等来挖掘样品之间的差异。另外,将环境因子和特有的核心菌群进行关联性分析,解析环境因子-核心菌群之间的关系。
2 结果与分析
2.1 马铃薯连作与马铃薯-小麦轮作田块中的马铃薯根内微生物多样性分析
稀释性曲线结果表明,在一定范围内,随着测序条数的加大,曲线趋于平缓,样品序列充分,足以反映样品的物种多样性,可以进行后续的数据分析(图1)。Alpha多样性是对样本内多样性或物种丰度的评估,可通过Chao1、Ace、Shannon和Simpson等指标进行衡量,其中,Chao1和Ace指数用于衡量物种丰度,即物种数量的多少。Shannon和Simpson指数用于衡量物种多样性,受样品群落中物种丰度和物种均匀度的影响。Shannon指数值越大,Simpson指数值越小,说明样品的物种多样性越高。本试验依据Ace和inverse Simpson指数来衡量物种丰度和多样性(图2),Ace指数表明:轮作地块的马铃薯根内微生物(细菌和真菌)丰度高于连作地块但不显著;处于马铃薯生长期的根内细菌丰度显著高于马铃薯块茎膨大期的根内细菌丰度(图2-a),而处于马铃薯块茎膨大期的根内真菌丰度相比较马铃薯生长期虽有下降但不明显(图2-b)。inverse Simpson指数表明:轮作地块的根内细菌多样性大于连作地块,并且处于马铃薯生长期的根内细菌多样性大于马铃薯块茎膨大期的根内细菌多样性,但是都不显著(图2-c);轮作地块和连作地块的根内真菌多样性无显著差异,但处于马铃薯块茎膨大期的轮作地块中,根内真菌多样性呈上升趋势(图2-d)。用binary jaccard算法来比较不同耕作模式下的根内微生物beta多样性,结果表明:不同耕作模式下的马铃薯处于不同生长发育期时,其根内微生物多样性具有显著差异(图3)。
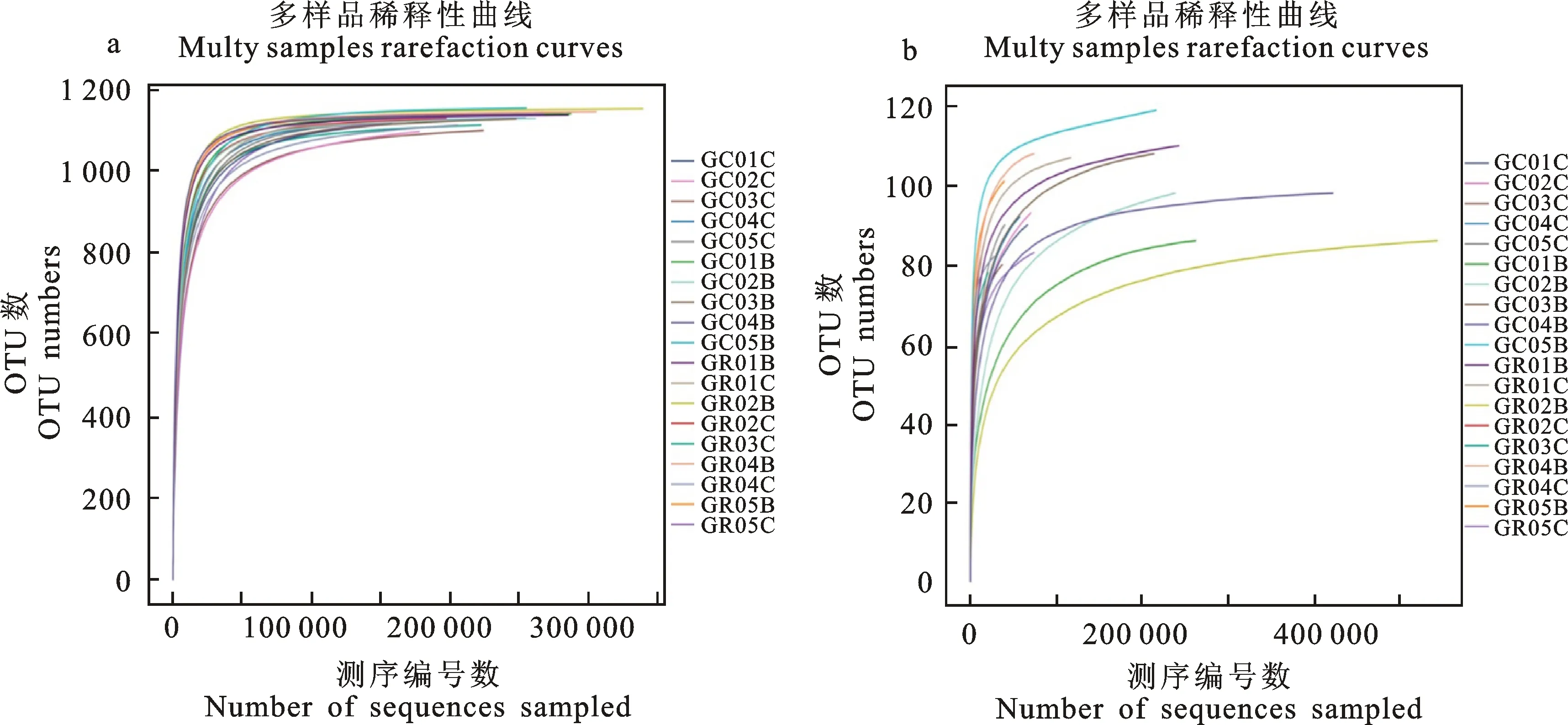
每条曲线代表1个样本,用不同的颜色标记。a和b分别为细菌和真菌样品稀释性曲线
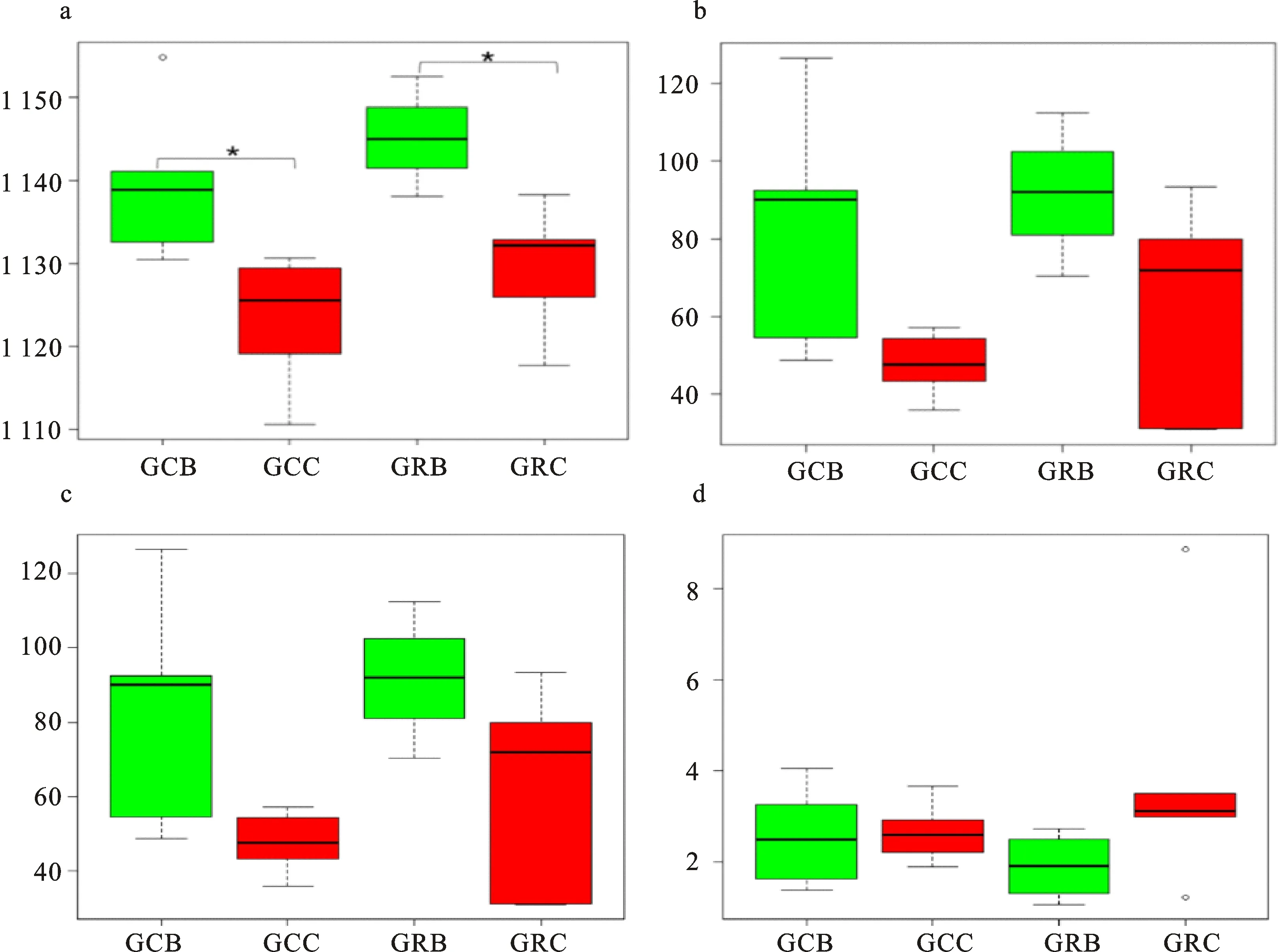
a和c分别为细菌Ace指数和inverse Simpson指数分析结果;b和d分别为真菌Ace指数和inverse Simpson指数分析结果;*.表示两地块的样品差异显著(P<0.05)

a和b分别为根样品细菌和真菌Beta多样性
2.2 马铃薯连作与马铃薯-小麦轮作田块中的马铃薯根内微生物群落组成分析
为了进一步揭示耕作模式对马铃薯根内微生物群落组成的影响,对马铃薯根内的微生物OTUs进行物种丰度的比较分析(门水平前10;纲水平前15;科水平前20;属水平前20)(图4,表1,表2)。细菌丰度分析结果显示,无论是轮作还是连作种植马铃薯地块,Proteobacteria是细菌门水平上丰度最高、占绝对优势的一类,处于马铃薯生长期时,轮作地块和连作地块的根内Proteobacteria丰度基本一致(66.2% / 65.8%),而到马铃薯块茎膨大期时,轮作地块的根内Proteobacteria丰度明显上升(66.2%→72.0%),连作地块虽有上升但不明显(67.1%);此外,Actinobacteria和Bacteroidetes的丰度也占有优势(图4-a)。Gammaproteobacteria、Alphaproteobacteria和Actinobacteria是两个地块纲水平上占优势的一类,从马铃薯生长期到块茎膨大期,根内Gammaproteobacteria的丰度水平在轮作地块中表现为上升趋势(31.1%→35.5%),而在连作地块中表现为下降趋势(32.0%→27.8%);根内Alphaproteobacteria的丰度水平在轮作和连作地块均表现为上升趋势;根内Actinobacteria的丰度水平在轮作地块表现为下降趋势 (17.4%→14.9%),而在连作地块表现为上升趋势 (17.7%→22.9%)(图4-c)。Burkholderiaceae、 Rhizobiaceae、 Sphingomonadaceae、 Streptomycetaceae和Pseudonocardiaceae是两个地块科水平上占优势的一类,从马铃薯生长期到块茎膨大期,根内Burkholderiaceae的丰度水平在轮作地块无明显变化,而在连作地块表现为下降趋势(15.00%→12.8%);根内Rhizobiaceae的丰度水平在两地块均上升,且在连作地块中的丰度略高于轮作地块;根内Sphingomonadaceae的丰度水平在两地块均表现为下降趋势,且在连作地块中的丰度水平高于轮作地块;根内Streptomycetaceae的丰度水平在轮作地块变化不明显 (4.90%→4.60%),而在连作地块呈较高水平 (6.80%→8.6%);根内Pseudonocardiaceae的丰度水平在轮作地块表现为下降趋势(5.40%→ 4.20%),而在连作地块表现为上升趋势(5.90%→ 8.70%)(表1)。Rhizobium、Streptomyces、Lechevalieria、Sphingomonas和Methylotenera是两个地块属水平上占优势的一类,从马铃薯生长期到块茎膨大期,根内Rhizobium的丰度水平在两地块均明显上升,且轮作地块的上升幅度大于连作地块;根内Streptomyces的丰度水平在轮作地块变化不明显,而在连作地块表现为上升趋势 (6.80%→ 8.6%);根内Lechevalieria的丰度水平在轮作地块表现为下降趋势(4.80%→ 3.30%),而在连作地块呈上升趋势(5.30%→ 7.60%);根内Sphingomonas的丰度水平在两地块均表现为下降趋势,且在连作地块中的下降幅度高于轮作地块;根内Methylotenera的丰度水平在两地块变化不明显,但在轮作地块中的水平显著高于连作地块(表1)。

a和b分别代表细菌和真菌门水平上排列前10的门; c和d分别代表细菌和真菌纲水平上排列前15的物种

表1 细菌科水平和属水平上排列前20的物种Table 1 Top twenty bacteria species in the family and genus levels
真菌丰度分析结果表明,Ascomycota和Basidiomycota是两地块门水平上占优势的一类,从马铃薯生长期到块茎膨大期,根内Ascomycota的丰度水平在两地块中均上升,且在轮作地块中的上升幅度显著高于连作地块(轮作:39.10%→90.46%;连作:43.32%→71.52%);而根内Basidiomycota的丰度水平在两地块中均表现为下降趋势,且在轮作地块中的下降幅度显著高于连作地块(轮作:59.76%→7.14%;连作55.42%→24.72%)(图4-b)。Sordariomycetes和Agaricomycetes是两地块纲水平上占优势的一类,从马铃薯生长期到块茎膨大期,根内Sordariomycetes的丰度水平在两地块中均表现为上升趋势,且在连作地块中的水平高于轮作地块;根内Agaricomycetes的丰度水平在两地块中均呈现下降趋势,且在轮作地块中的下降幅度显著高于连作地块(图4-d)。Plectosphaerellaceae和Ceratobasidiaceae是两地块科水平上占优势的一类,从马铃薯生长期到块茎膨大期,根内Plectosphaerellaceae的丰度水平在两地块中表现为显著上升趋势(轮作:21.0%→48.7%;连作:33.7%→60.8%),且在连作地块中的水平显著高于轮作地块(轮作:48.7%;连作60.8%);根内Ceratobasidiaceae的丰度水平在两地块中均表现为显著下降趋势(轮作:59.1%→5.9%;连作:53.4%→19.8%),且在轮作地块中的下降幅度显著高于连作地块(轮作:53.2%;连作:33.6%)(表2)。Plectosphaerella是两地块属水平上具有显著优势的一类,从马铃薯的生长期到块茎膨大期,其丰度水平在两地块中均表现为显著上升趋势,且在连作地块中的水平明显高于轮作地块(表2)。
综上可以得出,从马铃薯生长期到块茎膨大期,连作和轮作模式下的根内微生物组成和丰度水平具有显著差异。

表2 真菌科水平和属水平上排列前20的物种Table 2 Top twenty fungi species in family and genus levels
2.3 马铃薯连作与马铃薯-小麦轮作田块中的马铃薯根内微生物群落组成差异分析
利用de-seq对处于马铃薯生长期和块茎膨大期的连作与轮作地块的根内微生物群落进行差异比较分析(同一采样时期不同耕作模式下的比较)(表3,表4)。处于马铃薯生长期的轮作地块根内细菌含量增加的OTUs(log2差异倍数>0)有190个,其中丰度提高且达到极显著差异(log2差异倍数>2,FDR adjustedPvalue<0.01)的细菌有Clostridium、 o-211ds20、Terrisporobacter和Nocardioides;而处于马铃薯生长期的连作地块根内细菌含量增加的OTUs(log2差异倍数>0)有221个,其中丰度提高且达到极显著差异(log2差异倍数>2,FDR adjustedPvalue< 0.01)的细菌有Chitinophaga、Luteimonas、Niastella、Micromonosporaceae、Chryseobacterium、Falsirhodobacter、Pedobacter、Flavobacterium、Pseudonocardia、Nocardioides、Taibaiella、Actinophytocola、Phaselicystis、Pseudoflavitalea、Pseudomonas、Rhizorhapis和Ellin6067。处于马铃薯块茎膨大期的轮作地块根内细菌含量增加的OTUs(log2差异倍数>0)有231个,其中丰度提高且达到极显著差异(log2差异倍数>2,FDR adjustedPvalue< 0.01)的细菌有Azospirillales、Pelomonas、Methylobacillus、Uliginosibacterium、Flavobacterium、Microvirga、Lachnoclostridium、Clostridium、Thermoleophilia、Emticicia、 Colwelliaceae、Terrisporobacter、Cytophaga、Nocardioides、Methylophilus和Asticcacaulis;而处于马铃薯块茎膨大期的连作地块根内细菌含量增加的OTUs(log2差异倍数>0)有176个,其中丰度提高且达到极显著差异(log2差异倍数>2,FDR adjustedPvalue< 0.01)的细菌有Micromonosporaceae、Nonomuraea、Phreatobacter、Mycobacterium、Pseudonocardia、Nocardioides、Actinomadura、Chitinophaga、Phaselicystis、Rhizorhapis、Inquilinus和Lysobacter(表3)。
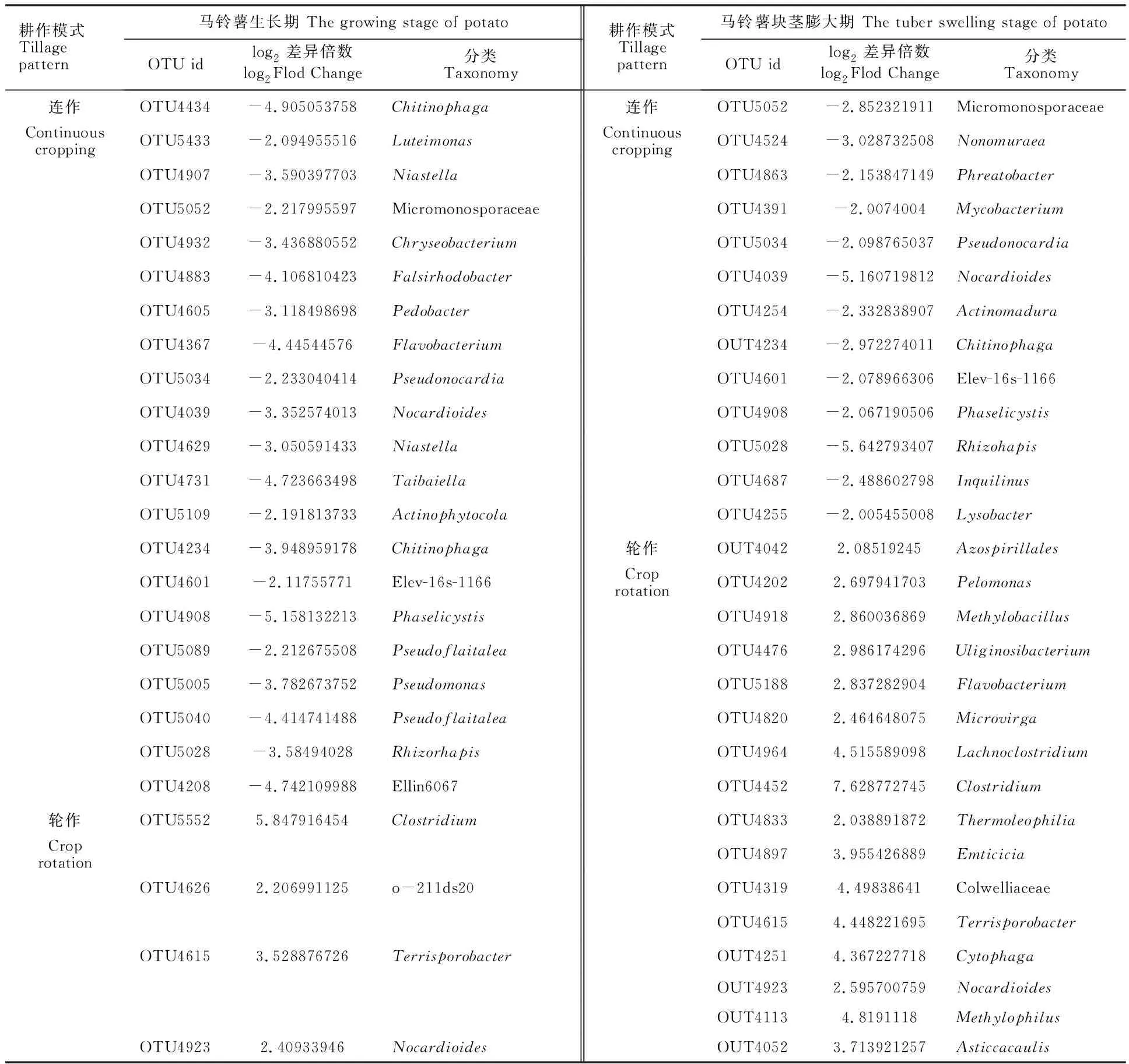
表3 细菌de-seq分析结果Table 3 Results of bacteria de-seq analysis
处于马铃薯生长期的轮作地块根内真菌含量增加的OTUs(log2差异倍数>0)有155个,其中丰度显著提高且达到极显著差异(log2差异倍 数>8,FDR adjustedPvalue<0.01)的真菌有Colletotrichum和Boeremia;而处于马铃薯生长期连作地块根内真菌含量增加的OTUs(log2差异倍数>0)有201个,其中丰度显著提高且达到极显著差异(log2差异倍数>8,FDR adjustedPvalue< 0.01)的真菌有Sclerotiniaceae、Ascobolaceae、Colletotrichum、Coprinellus、Xylariaceae、Spizellomycetales、Humicola、Gibberella、GS16和Lasiosphaeriaceae。处于马铃薯块茎膨大期的轮作地块根内真菌含量增加的OTUs(log2差异倍数>0)有57个,其中丰度显著提高且达到极显著差异(log2差异倍数>8,FDR adjustedPvalue<0.01)的真菌有Didymella、Colletotrichum、Boeremia、Plectosphaerellaceae和Verticillium(表4);而处于马铃薯块茎膨大期的连作地块根内真菌含量增加的OTUs(log2差异倍 数>0)有211个,其中丰度显著提高且达到极显著差异(log2差异倍数>8,FDR adjustedPvalue<0.01)的真菌有Colletotrichum、Humicola、 Chaetomiaceae、Gibberella、 Lasiosphaeriaceae、Naganishia和Sordariales(表4)。
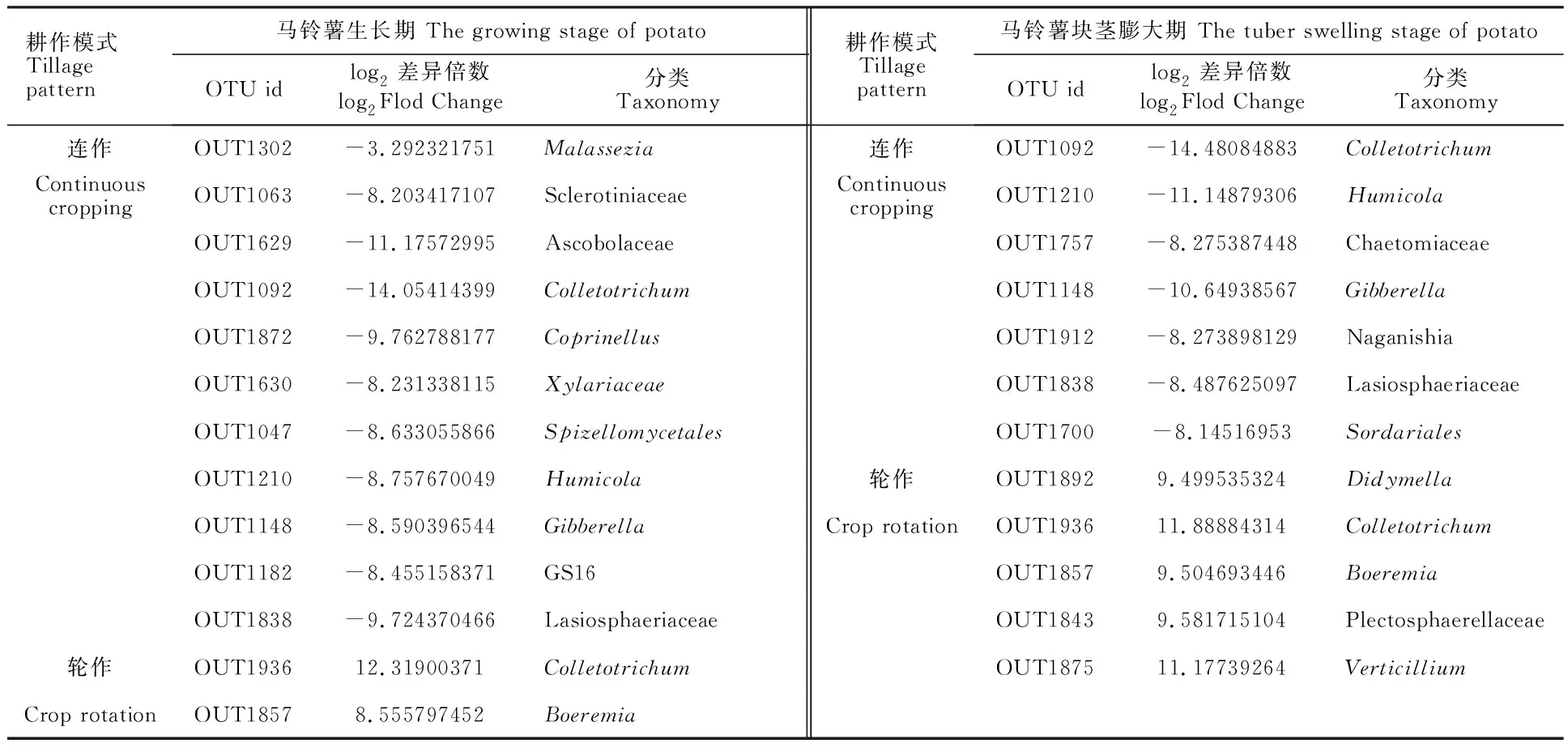
表4 真菌de-seq分析结果Table 4 Results of fungal de-seq analysis
2.4 环境因子对马铃薯根内微生物群落的影响
土壤有机质含量、硝铵态氮、速效磷和速效钾含量在马铃薯处于生长期和块茎膨大期的连作与轮作田块土壤中均无显著差异(P>0.05)。相比之下,土壤总钾、磷含量在马铃薯生长期和块茎膨大期有显著差异;而总氮含量则在连作与轮作田块土壤中有显著差异;土壤酸碱度和含水量则因耕作模式差异和马铃薯的生长期及块茎膨大期而有显著差异。土壤酸碱度从马铃薯生长期到块茎膨大期显著增加且轮作地块显著高于连作地块,而土壤含水量从马铃薯生长期到块茎膨大期显著下降(表5)。
通过RDA(Redundancy analysis)解析马铃薯根内微生物群落与环境因子之间的相关性(图5),结果表明,处于马铃薯生长期的连作与轮作地块中的根内细菌微生物群落主要受到土壤含水量、速效磷和有机质等因素的影响;其中,根内细菌微生物群落在连作地块中主要受到土壤含水量的显著影响,而在轮作地块受到土壤含水量、速效磷和有机质的显著影响。处于马铃薯块茎膨大期的连作和轮作地块中的根内细菌微生物群落主要受到土壤pH、铵态氮、有机质和总氮等因素的影响;其中,根内细菌微生物群落在连作地块中主要受到土壤铵态氮的显著影响,而在轮作地块中受到土壤pH、总氮和有机质等的共同影响(图5-a)。相比之下,处于马铃薯生长期和块茎膨大期的根内真菌微生物群落主要受到土壤有机质、总氮含量和pH等因素的影响(图5-b)。
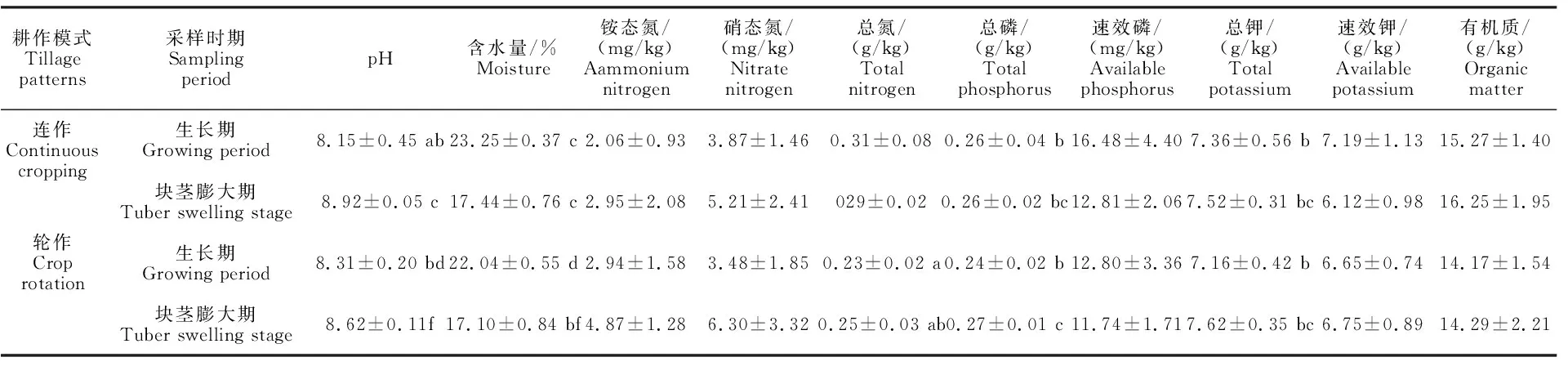
表5 土壤理化性质差异性分析结果Table 5 Result of difference analysis of soil physicochemical properties
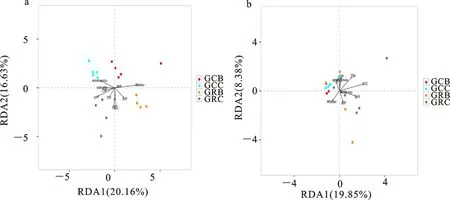
横纵坐标上的刻度为每个样品与环境因子进行回归分析计算时产生的值;点代表样品,字体表示环境因子,箭头代表不同的环境因子;a和b分别代表根样品中细菌和真菌微生物与环境因子的关联性分析 结果
3 讨论与结论
根际是植物根系与微生物相互作用的土壤生物活性区,对植物的生长发育、养分循环和生态系统功能具有重要意义[15]。研究表明,植物根际土壤和根内微生物群落的组成主要受到植物基因型和土壤环境因子的影响[17-22]。然而,耕作模式对作物根内微生物群落的影响机制尚不明确,尤其是针对西北旱区的典型耕作模式影响马铃薯根际微生态的机制研究亟需深入。在本研究中,重点比较分析甘肃天水马铃薯主栽品种‘天薯11号’在典型连作与轮作栽培模式下,其根内微生物多样性及群落组成的特征,并探究环境因子对马铃薯根内微生物多样性及群落组成的影响。结果表明,耕作模式能够影响马铃薯根内微生物多样性及微生物群落的结构组成(图2,图3)。通过马铃薯根内微生物群落的丰度变化分析,结果表明Proteobacteria和Ascomycota是马铃薯根内丰度水平最高且占绝对优势的一类菌群(图4-a,图4-b)。此外,有研究表明,Ascomycota在种植拟南芥的土壤和拟南芥根内占优势[21],而本研究发现Basidiomycota在处于马铃薯生长期的根内占优势,而Ascomycota则在马铃薯块茎膨大期的根内占绝对优势(图4-b)。同时,门水平(图4-a,图4-b)、纲水平(图4-c,图4-d)、科水平(表1,表2)、属水平(表3)上的物种丰度以及不同耕作模式下的de-seq差异性分析结果表明,马铃薯根内微生物的丰度水平及群落组成在不同耕作模式之间以及马铃薯不同生长发育时期具有明显差异。据此,本研究得出:根内微生物群落组成和丰度差异可能因为植物种类、耕作模式和植物生长发育时期的不同而有差异。
研究表明,Pseudomonadaceae是对植物多方面有益(解磷、固氮、合成细胞分裂素、植物激素吲哚乙酸和赤霉素)且能促进植物生长的细菌[23];Rhizobiaceae具有抗真菌、促进植物生长、解磷和固氮的特性[24];Bacteroidetes中的Chitinophaga和Flavobacterium能够抑制病原菌的生长[25],并且Flavobacterium能够抑制致病疫霉菌的生长[25];Mortierella和Trichoderma是能够抑制疫霉菌生长的有益真菌[25],其中Trichoderma已作为生防菌对作物病原真菌和卵菌进行生物防治[26-27]。本研究表明,在马铃薯生长期,根内Pseudomonadaceae在连作地块中的丰度水平 (1.6%)显著高于轮作地块(0.2%);而到马铃薯块茎膨大期时,其在轮作地块中的丰度水平明显上升(1.3%),而在连作地块中有所下降(1.0%) (表1)。根内Rhizobiaceae的丰度水平从马铃薯生长期到块茎膨大期呈显著上升;在马铃薯块茎膨大期时,根内Bacteroidetes在轮作地块中的丰度水平从8.01%上升到8.57%,而在连作地块中从10.06%下降为6.16%;Mortierella和Flavobacterium在轮作地块中的丰度水平高于连作地块。综上,相比连作地块,处于马铃薯块茎膨大期的轮作地块中具有丰度水平更高的有益微生物菌群。由此推断:轮作模式下形成的马铃薯根内微生物群落更有利于马铃薯的生长、抗逆能力的提高以及耕地地力的提升。
之前的研究表明,植物通过根系分泌物对其周围的微生物具有强烈影响,然而,土壤类型或者寄主植物的选择是否为根际和根内微生物区系组成的主要因素目前还不清楚[28]。在本研究中,土壤组分和马铃薯品种是相同的,只有耕作模式存在差异,根据环境因子与微生物的关联性分析结果,环境因子(尤其是土壤含水量、pH和铵态氮含量)对微生物的群落组成具有显著影响(表5,图5)。
本研究聚焦西北旱区马铃薯绿色生产这一关键科学问题,通过解析甘肃天水典型耕作模式下(马铃薯-小麦轮作地块、马铃薯连作地块)的马铃薯主栽品种‘天薯11’根内微生物多样性及微生物群落组成特征,并结合环境因子进行相关性分析,揭示耕作模式对马铃薯根内微生物多样性、以及微生物群落组成与结构特征的影响,并明确环境因子与马铃薯根内微生物多样性具有显著的相关性。进一步对轮作和连作地块的根内核心菌群的差异分析表明,轮作地块中形成的根内微生物群落更有利于马铃薯的生长和抗逆性,这为后续核心菌群的生物学功能研究奠定基础,并为推进西北旱区马铃薯的绿色高效生产提供理论 依据。

