通过两步离子交换层析建立保留HLA-A2二聚体构象的纯化方法*
杨 敬, 翁秀芳, 梁智辉, 吴雄文
华中科技大学同济医学院基础医学院免疫学系,武汉 430030
pMHC二聚体由MHC的重链与免疫球蛋白IgG Fc重组在一起,通过IgG Fc段的链间二硫键的作用而形成pMHC二聚体[1-2],由于其能与T细胞受体(TCR)高亲和力结合[3],已经成为检测抗原特异性T细胞的有效工具[4]。
在我们的前期工作中,已成功构建重组HLA-A2二聚体的真核表达载体pcDNA3.1+[HLA-A2/IgG1],表达载体中含有HLA-A2 α1-α3区与人IgG1重链CH1-CH3区的融合基因,并转染721.221细胞获得可表达HLA-A2-IgG1 Fc融合蛋白的7A2D细胞株。HLA-A2-IgG1 Fc融合蛋白由于含有IgG1 Fc段不仅可通过IgG1 Fc段的链间二硫键形成HLA-A2二聚体,而且还可借助IgG1 Fc段与金黄色葡萄球菌蛋白A(SPA)的高亲和力结合实现SPA亲和层析纯化[5]。
可溶性表达蛋白纯化过程复杂,目前常用的纯化方法主要有亲和层析、凝胶过滤层析和离子交换层析等。亲和层析通过SPA与抗体Fc段,或者抗体与抗原的特异性结合,能使混有大量杂蛋白的目的蛋白高效纯化[6]。但是亲和层析的洗脱条件pH值较低,构象不稳定的蛋白在该条件下易发生构象改变,导致功能丧失。凝胶过滤层析主要依据不同蛋白的分子量差别实现分离,而离子交换层析主要依据蛋白的等电点应用不同pH值的缓冲液实现分离纯化,两者对蛋白构象影响较小,但是凝胶过滤层析浓缩纯化蛋白的效率低于离子交换层析。由于HLA-A2二聚体上的HLA-A2分子由链、2m和抗原肽通过非共价连接结合在一起,易于解离变性,构象相对不稳定。SPA亲和层析纯化方法中低pH值洗脱液可能导致HLA-A2二聚体变性,从而限制了二聚体制备效率。因此,本研究探索洗脱条件相对温和的离子交换层析法在纯化HLA-A2二聚体中的应用,以建立高效的HLA-A2纯化方法,获得高纯度并保持天然构象与功能的HLA-A2二聚体。
1 材料与方法
1.1 主要实验材料
1.1.1 实验细胞 721.221细胞[7]:为B细胞转化淋巴母细胞系,HLAⅠ类抗原表达缺陷,同时不表达IgG1重链,但高表达HLAⅠ类分子轻链2m,作为本实验HLA-A2二聚体的表达细胞与阴性对照。7A2D细胞:成功转染pcDNA3.1+[HLA-A2/IgG1]并稳定表达HLA-A2二聚体的细胞,其中表达载体中含有HLA-A2 α1-α3区与人IgG1重链CH1-CH3区的融合基因,该HLA-A2二聚体上所有组成片段包括抗原肽均为人体来源的组分。
1.1.2 实验抗体 单克隆抗体W6/32:鼠抗人HLAⅠ类分子构象依赖性单克隆抗体,为小鼠杂交瘤细胞系HB-95所分泌的IgG抗体,识别HLAⅠ类分子重链与轻链结合后形成的重链α2-α3区特定表位,不与单独的轻链或重链结合[8],浓度为0.5 mg/mL,由本实验室陆盛军博士制备。兔抗人2m抗体:可与2m结合,购自Beckman公司。辣根过氧化物酶(HRP)标记的羊抗人IgG抗体、HRP标记的羊抗兔IgG抗体,购自北京中山生物技术有限公司,推荐效价为1∶2500~1∶20000。
1.1.3 主要试剂 细胞培养所需试剂:RPMI-1640培养液、胎牛血清、双抗(青霉素、链霉素)、100×非必需氨基酸(Hyclone,美国);亲和层析试剂:葡萄球菌蛋白A凝胶(Invitrogen公司);离子交换层析试剂:DE52纤维素(Whatman公司)。
1.2 实验方法
1.2.1 7A2D细胞表达的HLA-A2二聚体的收集应用含有10%FBS的RPMI-1640培养液大量扩增7A2D细胞,在细胞对数生长期,将细胞按照1×106/mL的密度接种到含有1%FBS的RPMI-1640培养液中培养24 h,收集获得2 L富含HLA-A2二聚体的表达上清。
1.2.2 HLA-A2二聚体的ELISA鉴定 用包被液(0.05 mol/L碳酸盐缓冲液,pH=9.6)将W6/32稀释至10 μg/mL,4℃湿盒中包被过夜;弃去包被液,每孔加满3%BSA-PBS的封闭液,4℃湿盒中封闭过夜;弃去封闭液,每孔加满洗涤液(0.05吐温20%-PBS),洗涤3~6次,控干;每孔加入不同稀释倍数的细胞培养上清100 μL,37℃孵育1 h,同上法洗3~6次,控干;每孔加入1∶2500稀释的HRP标记的羊抗人IgG的抗体100 μL,37℃孵育1 h,同上法洗3~6次,控干;每孔加50 μL新鲜配制的显色液(OPD),室温显色15 min;每孔加50 μL终止液(2 mol/L H2SO4),终止反应;于酶标仪上测量各孔490 nm处的吸光度A值。
1.2.3 HLA-A2二聚体的Western blot鉴定 分别配制12%的还原型SDS-PAGE分离胶与12%非还原型PAGE分离胶。将含有HLA-A2二聚体的上清液进行蛋白质电泳。并通过转膜将还原型SDS-PAGE与非还原型SDS-PAGE凝胶上的蛋白转移到硝酸纤维素膜上。将膜放入装有封闭液的袋子中,置4℃中封闭过夜;用PBS洗液洗膜3次;将HRP标记的抗人IgG抗体以1∶2500的比例用封闭液稀释,将硝酸纤维素膜置于其中,4℃孵育过夜;弃去含一抗的封闭液,用PBS洗液洗膜3次;将洗好的膜置于DAB显色液中,轻摇硝酸纤维素膜,观察显色程度,显色应在5~30 min内完成;用双蒸水洗膜终止显色反应,扫描显色结果。
1.2.4 HLA-A2二聚体的浓度测定 利用已知浓度的HLA-A2分子(1 mg/mL)作为标准品,与7A2D细胞培养上清同时进行ELISA检测,检测与计算7A2D细胞培养上清中HLA-A2二聚体的浓度。其中包被抗体为构象依赖性的W6/32,检测抗体为兔抗人β2m抗体,二抗为HRP标记的羊抗兔IgG抗体。根据不同稀释度的HLA-A2标准品的A490值做标准曲线,计算待测样品中HLA-A2二聚体的含量。
1.2.5 SPA亲和层析法纯化HLA-A2二聚体 本研究所表达的HLA-A2二聚体含有人IgG1的Fc段,与蛋白A有高亲和力的结合,可通过蛋白A亲合层析柱浓缩纯化。将收集的300 mL 7A2D细胞培养上清用滤纸过滤去除沉淀;取3 mL蛋白A凝胶加入5 mL体积的层析柱中,并置于4℃层析柜中;用结合缓冲液(0.1 mol/L PBS,pH=7.0)以1 mL/min的速度,平衡蛋白A层析柱,平衡30 min;将过滤好的样品以1 mL/min的速度经过蛋白A层析柱,使样品中的HLA-A2二聚体与蛋白A充分结合;当样品过滤完后,用结合缓冲液再次过柱,以洗涤未结合于蛋白A上的其它杂蛋白,流速为1 mL/min;用Brodford液检测,直至流出的液体不再检测得到蛋白;将结合缓冲液更换为洗脱缓冲液(0.1 mol/L甘氨酸-HCl,pH=3.0),以1 mL/min的速度经过蛋白A层析柱,以洗脱结合于蛋白A上的HLA-A2二聚体;每1 mL收集一管,随时用pH试纸监测pH值的变化,用Brodford液检测每管蛋白质含量;在pH值发生变化的收集样品中,加入10 μL 1 mol/L Tris碱溶液,将pH值调至7~8之间;Brodford液检测到蛋白含量较高的样品;以1 mg/mL的BSA作为标准品,利用Brodford液检测收获的纯化蛋白的总蛋白浓度;SDS-PAGE电泳检测纯化的HLA-A2二聚体的纯度;利用W6/32与抗人IgG1 Fc抗体检测构象正确的HLA-A2二聚体的浓度。
1.2.6 两步法离子交换层析技术纯化HLA-A2二聚体 选择阴离子交换剂纤维素DE-52,将1 mL 7A2D细胞培养上清加入到含有DE-52的不同EP管中,离心去掉上清,并应用pH值5.8~8.0的不同PB缓冲液进行重悬,通过Bradford法与ELISA法联合检测上清中HLA-A2二聚体及其它蛋白的析出情况,确定HLA-A2二聚体与细胞培养上清中的大部分蛋白的洗脱条件。
①pH=6.2条件下的离子交换层析:在pH=6.2的条件下,7A2D细胞培养上清中大部分杂蛋白可结合在DE-52层析柱上,而HLA-A2二聚体不能结合。收集300 mL含HLA-A2二聚体的7A2D细胞培养上清,透析(0.01 mol/L PB,pH=6.2);将溶胀与碱处理后(0.5 mol/L NaOH)的DE-52纤维素填充层析柱,并用0.01 mol/L PB(pH=6.2)充分平衡;将透析好的7A2D细胞培养上清(0.01 mol/L PB,pH=6.2)上样于预平衡完全的DE52层析柱中,流速控制在1~2 mL/min;收集流出液,利用W6/32与抗人IgG抗体进行双抗夹心ELISA检测流入液与流出液中HLA-A2二聚体的含量。
② pH=7.4条件下的离子交换层析:在pH=7.4条件下,HLA-A2二聚体可结合到DE-52层析柱上。收集第1次离子交换层析的流出液,并用pH7.4的0.01 mol/L PB充分透析;将透析好的第1次离子交换层析的流出液(0.01 mol/L PB,pH=7.4)上样于用pH7.4 PB预平衡完全的DE52层析柱中,流速控制在1~2 mL/min;弃去流出液;利用洗脱液(0.5 mol/L NaCl-PB,pH=7.4)进行洗脱收集,利用Brodford液检测收获的纯化蛋白的总蛋白浓度;SDS-PAGE电泳检测纯化的HLA-A2二聚体的纯度;利用W6/32与抗人IgG抗体检测构象正确的HLA-A2二聚体的浓度。
1.2.7 两种纯化方法的效率比较 300 mL的7A2D细胞培养上清通过SPA亲和层析与两步法离子交换层析分别进行纯化,每个实验重复3次;回收率计算公式为:(纯化后正确构象的HLA-A2二聚体量-纯化前HLA-A2/IgG1融合蛋白总量)/(纯化前HLA-A2/IgG1融合蛋白总量)×100%;在收集峰管中,HLA-A2二聚体的浓度通过W6/32与抗人2m进行双抗夹心ELISA检测计算。HLA-A2二聚体的纯度计算公式:(HLA-A2二聚体的浓度)/(Bradford法检测的总蛋白浓度)×100%。
1.3 统计学分析
2 结果
2.1 7A2D细胞可高效表达HLA-A2二聚体
HLAⅠ类分子的构象依赖性抗体W6/32可识别HLAⅠ类分子重链与轻链结合后在α2-α3区域形成的构象,抗人IgG1抗体可识别HLA-A2二聚体中IgG1 Fc段。利用W6/32与抗人IgG1抗体对转染了pcDNA3.1+[HLA-A2/IgG1]质粒的7A2D细胞培养上清进行双抗夹心ELISA检测,结果显示7A2D细胞培养上清中含有能够与W6/32和抗人IgG抗体同时结合的HLA-A2二聚体(结果如图1A)。进一步利用抗人IgG抗体对表达的HLA-A2/IgG1融合蛋白进行Western blot鉴定,检测其分子量以及是否以二聚体形式存在。结果如图1B所示,样品经过β-巯基乙醇的还原处理后进行SDS变性聚丙烯凝胶电泳,用抗人IgG Fc抗体均可检测到一条70 kD的蛋白质条带,样品如果不进行还原处理而保持二硫键的存在,利用抗人IgG Fc抗体则可检测到一条大约150 kD大小的片段,说明HLA-A2/IgG1融合蛋白在未进行还原处理前,是以二聚体的形式存在。为了更准确地估计7A2D细胞表达的HLA-A2二聚体的量,利用1 mg/mL的HLA-A2作为标准品,通过W6/32与抗2m抗体进行夹心ELISA检测,绘制标准曲线,检测7A2D上清中HLA-A2二聚体的量,结果如图2,通过绘制的标准曲线计算出7A2D细胞培养上清中HLA-A2二聚体的浓度为4.4 μg/mL。
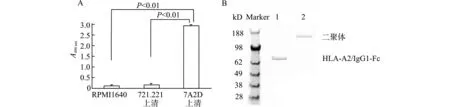
A:利用HLAⅠ类分子的构象抗体W6/32作为捕获抗体,抗人IgG Fc抗体作为检测抗体,进行夹心ELISA,检测得7A2D的细胞上清的A值远远高于RPMI 1640组(空白对照)与未转染的721.221上清的A值;B:利用抗人Fc抗体对7A2D上清进行Western blot鉴定,条带1为还原型SDS-PAGE电泳,条带2为非还原型PAGE电泳。图1 ELISA与Western blot法鉴定7A2D表达的HLA-A2二聚体Fig.1 Expression of HLA-A2 dimers in 7A2D identified by ELISA and Western blotting
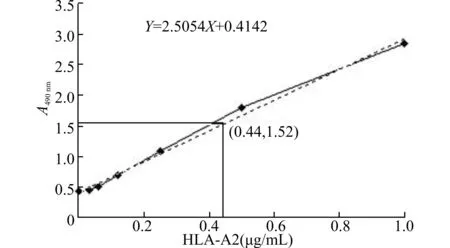
通过W6/32与抗2m抗体夹心ELISA检测的HLA-A2标准品绘制标准曲线,待测样品为10倍稀释的7A2D细胞培养上清,根据标准曲线算出的方程以及分子量推算HLA-A2二聚体的浓度为4.4μg/mL。图2 7A2D可高效表达HLA-A2二聚体Fig.2 High expression of HLA-A2 dimer in 7A2D
2.2 SPA亲和层析纯化方法容易导致HLA-A2二聚体变性
由于HLA-A2二聚体含有人IgG1 Fc段,后者与SPA有高亲和力结合的作用,因此可利用SPA亲和层析纯化HLA-A2二聚体。然而在我们的实验中发现,尽管亲和层析可有效地纯化含Fc段的融合蛋白,但pH=3.0的洗脱条件使大部分的HLA-A2二聚体发生了变性反应,结果如图3所示。经过SPA柱亲和层析后收获的蛋白中,总蛋白的含量相对较高,而利用构象依赖性抗体进行ELISA检测出的HLA-A2二聚体的含量很低,HLA-A2二聚体的回收率仅为7%左右。主要原因可能为低pH值导致与HLA-A2重链非共价结合的2m与抗原肽的解离,并且在纯化完后加入2m也无法促进变性的二聚体恢复构象。调高洗脱液的pH值却导致蛋白洗脱效率低下,无法利用亲和层析有效地纯化HLA-A2二聚体(结果未显示)。
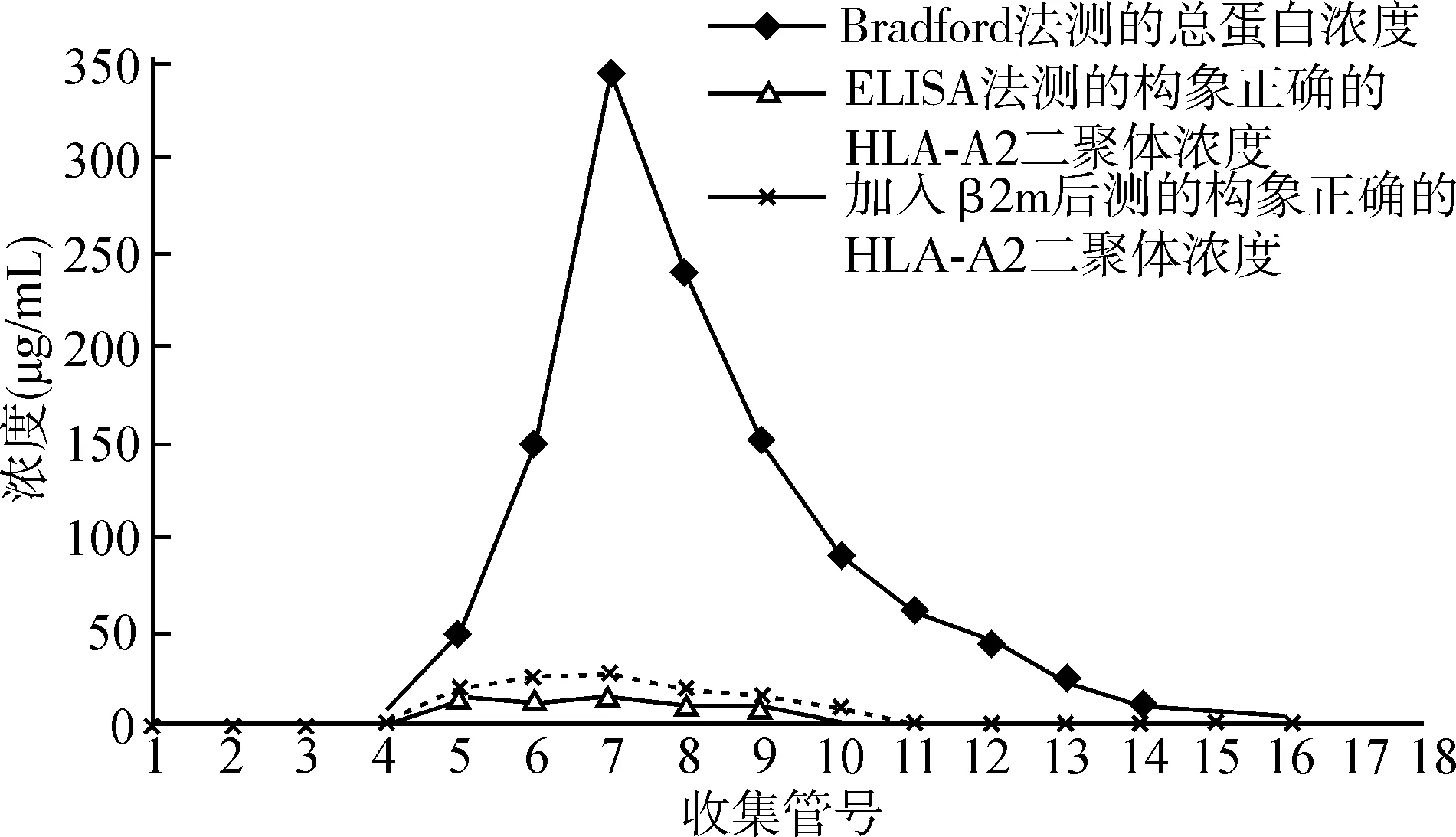
图3 SPA亲和层析纯化方法导致HLA-A2二聚体变性Fig.3 Denaturation of HLA-A2 dimer by SPA affinity chromatography
2.3 两步法离子交换层析技术可有效纯化HLA-A2二聚体
相对于亲和层析,离子交换层析法的洗脱条件相对温和。
在本研究中,检测7A2D细胞培养上清中蛋白以及HLA-A2二聚体在不同pH值条件下与DE52的结合情况,结果显示在pH=6.2,0.01 mol/L PB的缓冲条件下,7A2D细胞培养上清中99.2%的蛋白能够与DE52结合,而HLA-A2二聚体不结合;在pH=7.4的条件下,99.6%的HLA-A2二聚体可有效地与DE52结合(图4A)。并且结合在DE52上的二聚体可在NaCl浓度为500 mmol/L的条件下有效洗脱,结果见图4B。
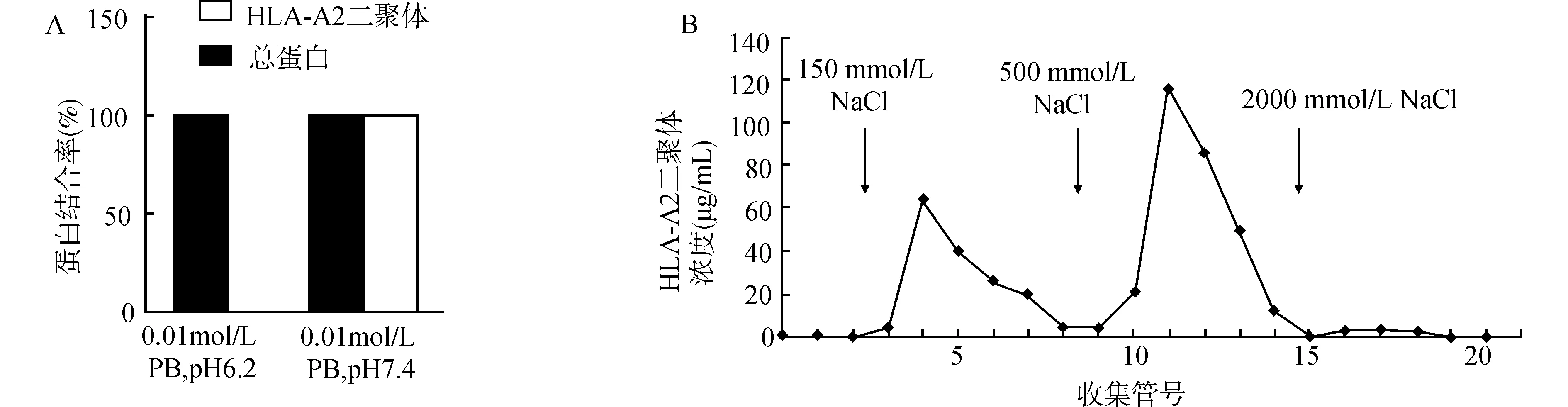
A:7A2D细胞上清中总蛋白与HLA-A2二聚体在pH=6.2与7.4条件下与DE52的结合效率检测;B:利用150、500、2000 mmol/L NaCl对结合在DE52层析柱上的HLA-A2二聚体的洗脱效率检测,其中500 mol/L NaCl可有效洗脱结合在层析柱上的HLA-A2二聚体图4 7A2D培养上清中的HLA-A2二聚体及杂蛋白与DE52的结合分析Fig.4 Analysis of binding of HLA-A2 dimer and heteroprotein to DE52 in culture supernatant of 7A2D
根据7A2D细胞上清中HLA-A2二聚体及其它蛋白与DE52在不同的pH值条件下的结合能力不同,本研究建立两步法离子交换层析技术,包括以下两步:① pH6.2条件下的离子交换层析,可去除大部分的杂蛋白;②pH7.4条件下的离子交换层析,在该条件下DE52层析柱可结合大部分的HLA-A2二聚体,并有效地通过500 mmol/L NaCl-PB洗脱收集。经过两步法离子交换层析,可有效纯化HLA-A2二聚体,并且不引起HLA-A2二聚体变性,结果见图5所示。经过两步离子交换层析后,
利用Bradford法检测不同收集管中蛋白的洗脱峰,其中6号收集管为洗脱峰,经过Bradford法测定6号收集管中总蛋白的浓度约338 μg/mL,SDS-PAGE灰度扫描分析显示其中HLA-A2/IgG1蛋白纯度约为69.2%,经计算6号收集管中含有的HLA-A2/IgG1蛋白约为242 μg/mL。与利用W6/32与抗Fc抗体双抗夹心ELISA法检测的HLA-A2二聚体的含量(234 μg/mL)基本一致,说明两步离子交换层析方法获得的纯化的HLA-A2二聚体保持天然构象。
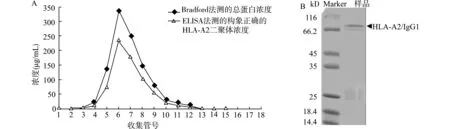
A:利用Bradford法与ELISA法检测经500 mmol/L NaCl洗脱后不同收集管中含有的总蛋白与HLA-A2二聚体的含量;B:6号收集管中的样品还原型SDS-PAGE电泳结果显示HLA-A2/IgG1蛋白纯度较高图5 两步离子交换层析纯化法可使HLA-A2二聚体有效纯化并保持天然构象Fig.5 Two-step ion exchange chromatography effectively purifies HLA-A2 dimer and maintains its natural conformation
2.4 两种纯化方法的效率比较
结果见表1,两步法离子交换层析纯化后HLA-A2二聚体含量、HLA-A2二聚体回收率(%)分别为(752±95)μg/mL、(51.9±6.5)%,较亲和层析纯化后的(106±16)μg/mL、(7.3±1.1)%有较大提升(均P<0.01);两步法离子交换层析纯化后收集峰中的HLA-A2二聚体纯度、含量分别为(72.9±4.6)%、(238.0±26.1)μg/mL,较亲和层析纯化后的(10.4±1.3)%、(37.0±9.2)μg/mL明显升高(均P<0.01)。
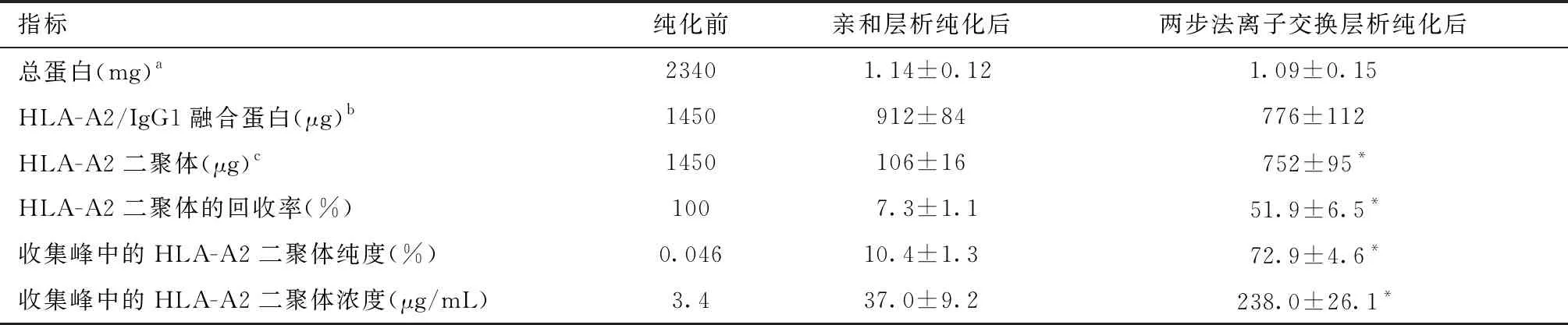
表1 两种纯化方法从7A2D细胞培养上清纯化HLA-A2二聚体的效率比较Table 1 Comparison of the efficiency of two purification methods for purification of HLA-A2 dimer from 7A2D cell culture supernatant
说明两步离子交换层析法可以获得高纯度、高浓度的HLA-A2二聚体。
与亲和层析纯化后比较,*P<0.01;a:通过Bradford法检测样品中含有的总蛋白的量;b:分子量正确的经过变性的HLA-A2/IgG融合蛋白,其含量通过Bradford法与SDS-PAGE结合分析;c:利用构象依赖性抗体W6/32与抗人2m进行双抗夹心ELISA分析获得的具有正确构象的HLA-A2二聚体的量
3 讨论
真核细胞表达的蛋白存在纯化困难、产量较低等问题,并且7A2D细胞培养上清中含有众多杂蛋白。前期功能实验结果显示,7A2D细胞上清中的HLA-A2二聚体在可溶性的状态下可抑制同种反应的强度与同种反应性T细胞的功能,而当上清中的HLA-A2二聚体加载到单核细胞表面,可人为地控制自身单核细胞作为单个同种表位的抗原提呈细胞,刺激表位特异性T细胞的产生[9]。然而没有高纯度的具有正确构象的HLA-A2二聚体,无法进行HLA-A2二聚体功能实验的质量控制与定量分析,提供HLA-A2二聚体调节特异性T细胞应答的有力证据与应用潜能。
通过表达细胞的筛选我们发现,人源性721.221细胞系由于其HLAⅠ类分子重链表达缺陷,并且细胞内富含游离的2m[6],可高效表达HLA-A2二聚体,其中通过G418筛选稳定转染并高表达HLA-A2二聚体的细胞株,命名为7A2D。该细胞株在体外连续传代50代以上依然保持高表达新型HLA-A2二聚体的特性,并且冻存后重新复苏也不影响二聚体的表达。7A2D表达的HLA-A2二聚体含有人IgG1 Fc段,其可与SPA特异性结合,因此可利用SPA亲和层析进行纯化[10],但是实验结果显示经SPA亲合层析纯化后回收到的具有正确构象和生物学活性的二聚体却很少,回收率仅为7%左右;由于HLA-A2二聚体分子中,HLA-A2的α链与2m及抗原肽为非共价结合,在SPA亲和层析纯化过程中经酸性条件(pH3.0)洗脱后,2m及抗原肽从重链解离,致使大量的HLA-A2二聚体变性失去正确构象。我们的ELISA检测体系中的包被抗体使用的是W6/32,它是HLA Ⅰ类分子表位特异性的单克隆抗体,识别重链与轻链结合后形成的重链α2-α3区特定表位的鼠抗人mAb W6/32,不与单独的轻链或重链结合。在pH3.0的洗脱环境中大量的2m与HLA-A2的重链形成的非共价键打开,从而使2m与抗原肽从复合物上脱落下来。故检测到的有生物学活性的HLA-A2二聚体很少。这与文献报道的pH3.8时,结合在细胞表面大部分的2m与重链解离脱落相吻合[11]。
离子交换层析是通过不同的蛋白等电点与所带电荷的差异来分离蛋白的纯化技术[12-13],由于7A2D细胞培养上清中大部分的蛋白的等电点在5.5左右,而HLA-A2的理论等电点约6.5,这种等电点的差异为利用离子交换层析纯化HLA-A2二聚体提供了可能。我们的研究显示,在pH=6.2的条件下,细胞培养上清中的大部分蛋白结合到DE52层析柱上,而HLA-A2二聚体在该条件下带有正电荷因此无法结合到DE-52层析柱上,而在pH=7.4的条件下,99%以上的二聚体结合到DE52层析柱上,因此通过pH6.2与pH7.4的两步法离子交换层析可有效地从7A2D细胞培养上清中纯化HLA-A2二聚体;并且通过两步法离子交换层析,300 mL的7A2D细胞培养上清中可纯化获得浓度大于200 μg/mL,纯度大约70%的构象完整的HLA-A2二聚体。
综上所述,本研究通过HLA-A2二聚体与其它蛋白的等电点可能存在的差异建立了一种纯化条件相对温和的两步法离子交换层析纯化方法,经过该方法制备获得的高纯度与高浓度的HLA-A2二聚体可保持正确的空间构象,达到了纯化与浓缩的目的,为更有效地结合与检测抗原特异性T细胞提供了有力工具。

