铜尾矿白羊草各生长阶段根际土壤丛枝菌根真菌群落特征
贾 彤,姚玉珊,郭婷艳
黄土高原生态恢复山西省重点实验室,山西大学黄土高原研究所,太原 030006
我国金属矿产资源丰富,随着金属矿产资源开发活动的迅猛发展,矿山周边土壤环境受到污染的现象日趋严重,受损生态系统的修复越来越被重视。山西省作为全国能源重化工基地,工矿企业多、土地破坏面积大、土壤修复任务重,矿区受损生态系统恢复是山西省生态文明建设面临的重大挑战之一。山西省运城市垣曲县,中条山集团北方铜业铜矿峪矿作为全国非煤系统最大的井下开采矿山,在浮选铜精矿过程中废弃尾砂、铜矿石经破碎球磨等工序加工至颗粒度很小的细砂状[1]。大量的尾矿堆积导致尾矿库面积迅速增大。尾矿砂有机质含量低、养分贫瘠、重金属污染严重,这使矿区生态系统生物多样性、群落结构和功能均受到不同程度的影响[2- 5]。近年来,微生物修复技术因其低耗、高效净化和安全备受人们关注,特别是菌根修复在众多领域中得到了广泛的应用。微生物技术可加快生土熟化,加速植被恢复,是培肥矿区土壤和修复矿区生态的一个重要途径。
丛枝菌根真菌(Arbuscular mycorrhizal fungi,AMF)是陆地生态系统最重要的土壤微生物之一,自然界中80%以上有花植物都能被丛枝菌根真菌侵染。AMF的宿主专一性相对较低,全球 AMF 物种丰富度范围在341个OTU(分类操作单元,operational taxonomic unit)至1600个OTU,甚至可能多余 1600 个 OTU[6]。这些 AMF 与大约 20 万种植物形成共生关系[7]。AM 结构分为表面和根内结构两部分,其中,根系表面菌丝包括从根内长出和生长于土壤中附着于根系表面的菌丝,根外菌丝为根内菌丝长出和土壤中生长分布在土壤中的菌丝。研究表明,芦苇根系周围寄主植物根系的理化特性决定了芦苇根系AMF的种类多样性和侵染强度[8],且土壤理化因素是影响宿主植物根系和根际AMF多样性和群落结构的重要因素[9-10]。AMF多样性对不同生态系统的植物群落结构、多样性和生产力有重要影响,在植被重建、生态恢复及植物多样性维持等当面扮演着重要角色[11-12]。已有研究表明,不同生态系统中AMF多样性表现出明显差异[13]。有研究发现,自然生态系统AMF物种数在热带森林中最多,而在人为干扰的环境中最少,如农田和污染区[14],并且污染生态系统中AM真菌多样性指数最低[15]。AM真菌的数量及群落组成,间接受到土地利用方式、土壤耕作等人为干扰的影响,例如,北方农牧交错带在草地转变为农田的过程中,由于土壤结构及养分状况的改变,间接导致AM真菌多样性显著下降及AMF群落结构的改变[16]。AMF生态适应性在很大程度上决定了其生态生理功能的发挥。AMF可以促进宿主植物吸收水分和养分,对植物生长具有重要作用,例如,干旱、重金属以及极端温度等逆境胁迫下可提高植物抗逆性[11,17]。因此,研究受损生态系统中AMF多样性及其关键影响因子,有助于生态恢复中可利用菌种资源的开发和利用。
本实验选择铜尾矿区主要恢复植被白羊草为研究对象,研究重金属污染环境下白羊草各生长阶段中AMF群落结构与多样性的变化,探讨白羊草各个生长阶段中AMF与环境因子的关系,阐明AMF在铜尾矿重金属胁迫环境中的多样性以及对白羊草不同发育阶段的生态因子响应机制,为铜尾矿生态恢复过程中发掘和利用AMF资源提供科学依据,选育具有抗逆性的植物-微生物共生体,进而提高铜尾矿区的生态修复效率。
1 材料与方法
1.1 研究区概况
试验区位于山西省运城市垣曲县,北方铜业铜矿峪矿十八河尾矿库(35°15′—35°17′N,118°38′—111°39′E),该尾矿坝建于1969年,位于选矿厂西南6 km的河谷中,由上游拦洪坝和下游尾矿坝及两侧山梁围成。选矿产生的废弃物以矿砂的形式逐年堆积于十八河尾矿坝,每3—5年堆积形成一个新子坝,并在表层覆盖30 cm客土,尾矿坝初期坝底标高486 m,坝顶标高509 m,现已堆筑16道子坝,堆积高度84 m,总坡比1∶6。该区域属大陆性季风气候,四季分明,春季干旱多风,夏季雨量集中,冬季少雪干燥。年均降雨量为780 mm,年均气温14℃,无霜期大于200 d[18]。
1.2 样品采集
以铜尾矿坝的优势种白羊草为研究对象,2017年6月初、7月末和9月中旬在S536号子坝(恢复20年[1])对当年新生白羊草进行根际土壤采集,选择采用五点取样法在1 m×1 m的样方内对白羊草根际5—20 cm 深度土壤进行采集,去除植物少部分枯落物及老旧根系后,选择当年新生根系,利用抖落法收集根际土壤样本,各取样点之间的距离至少大于50 m,采样期间佩戴无菌手套,避免不同样点间土壤样品污染。采集的样本分为两份,一份用于土壤理化性质的测定,另一份带回实验室置于-80℃超低温冰箱保存,用于微生物高通量测序。
1.3 研究方法
1.3.1土壤理化性质及酶活性的测定
用点位法测定土壤pH(土水比为1∶2.5)。土壤总碳和总氮含量使用元素分析仪(vario EL/MACRO cube, Elementar, Hanau, Germany)进行测定。采用苯酚钠—次氯酸钠比色法对土壤脲酶活性进行测定,过氧化氢酶的测定采用高锰酸钾滴定法,蔗糖酶的测定采用3,5-二硝基水杨酸比色法,碱性磷酸酶的测定采用磷酸苯二钠比色法[9]。
1.3.2白羊草根际土壤AMF群落的测定
用E.Z.N.A.® soil 试剂盒(Omega Bio-tek, Norcross, GA, U.S.)进行基因组提取,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量。PCR所用的引物选用AML1/AML2为第一对引物[19],AMV4.5NF/AMDGR[20]为第二对引物。使用2%琼脂糖凝胶回收PCR产物,利用Illumina公司的Miseq PE300平台进行测序,白羊草根际土壤样品送到上海美吉生物医药科技有限公司完成高通量测序。
1.4 数据处理
使用Trimmomatic软件对原始序列进行数据去杂和质控过滤,得到优化数据。使用的UPARSE软件(version 7.1 http://drive5.com/uparse/)对得到的高质量序列按照97%的相似度进行操作分类单元(Operational taxonomic units, OTU)的聚类。对OTU代表序列进行物种注释,用Qiime软件(Version1.7.0)中的blast方法[21]与Unit 数据库[22]行物种注释分析,并分别在各个分类水平进行统计AMF群落组成。采用Microsoft Excel进行数据处理和作图,利用SPSS 19.0进行单因素方差分析及Canoco 4.5进行RDA分析。
2 结果与分析
2.1 白羊草不同生长阶段根际土壤的理化性质
白羊草不同生长阶段的根际土壤理化性质表明,土壤养分(总碳和总氮)及土壤碳氮比均表现为幼苗期显著高于分蘖期和成熟期的根际土壤。土壤pH为碱性,且白羊草分蘖期的根际土壤pH达最大值(8.9),显著高于幼苗期(8.2)和成熟期(8.1)的土壤pH(表1)。对于土壤酶活性而言,过氧化氢酶和碱性磷酸酶均在白羊草成熟期达到最大值,而脲酶和蔗糖酶在分蘖期显著高于其他生长阶段(表1)。这表明白羊草各个生长阶段土壤理化和酶活性都存在显著差异。
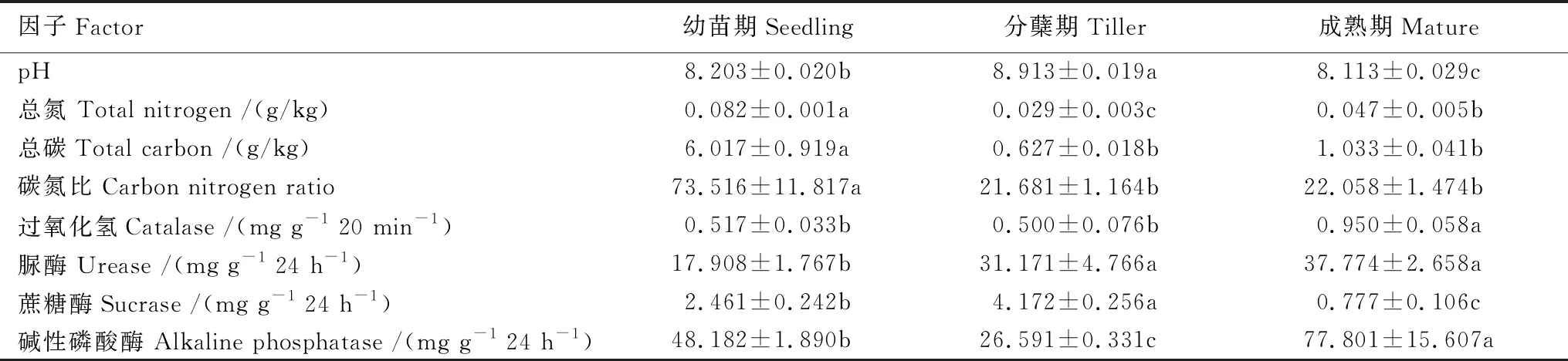
表1 白羊草不同生长阶段根际土壤理化特征及酶活性
2.2 白羊草根际土壤AMF分类
不同生长阶段白羊草根际土壤样本共得到6目,白羊草各个生长阶段根际土壤中优势菌均为球囊霉目(Glomerales),其中,白羊草幼苗期根际土壤中球囊菌目(Glomerales)占97.5%,分蘖期为56.82%,成熟期球囊菌目(Glomerales)占75.14%。和球囊霉目类似,白羊草各个生长阶段的优势菌群也具有明显的差异。分蘖期多样孢囊霉属(Diversispora)占优势,其相对丰度达到31.64%。白羊草成熟期的类球囊霉属(Paraglomus)相对丰度最高(23%)(表2)。在OTU水平上,白羊草各生长阶段根际土壤中属于AMF的OTU分别为28个(幼苗期)、19个(分蘖期)和15个(成熟期)。
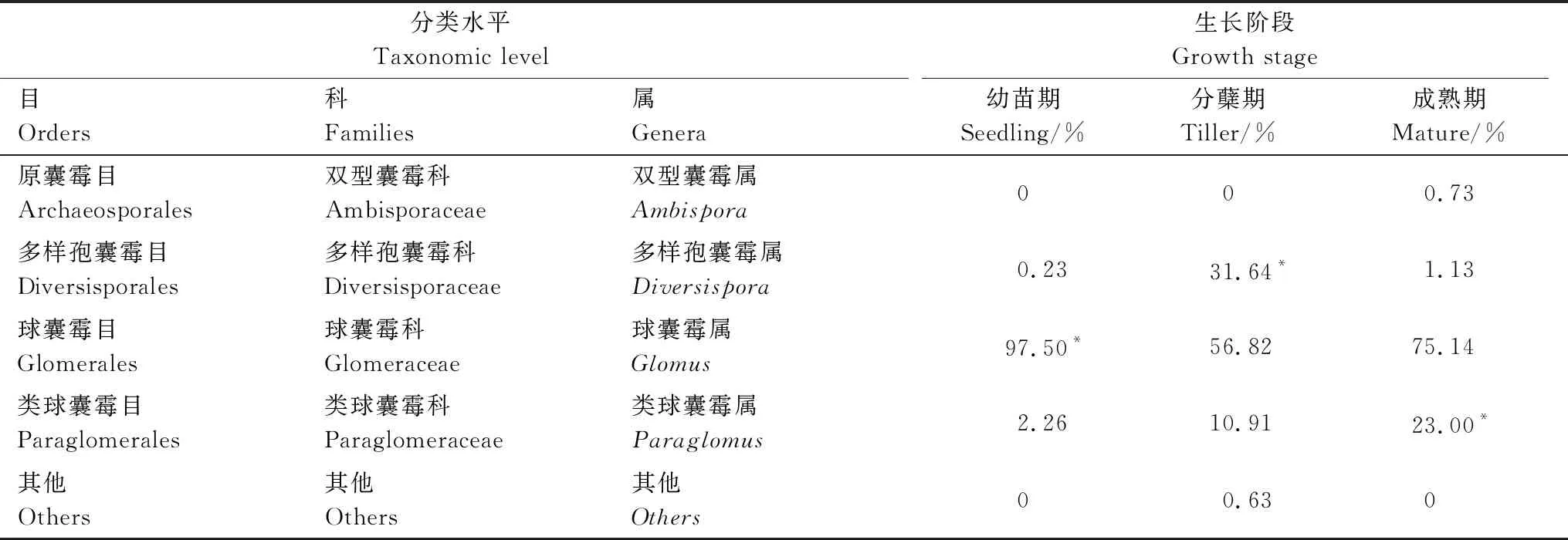
表2 白羊草不同生长阶段根际土壤中AMF分类情况
2.3 白羊草不同生长阶段根际土壤AMF群落结构与多样性
由图1可知,白羊草不同生长阶段根际土壤的AMF群落结构具有显著差异,白羊草3个生长阶段之间共有的OTU数为8个,白羊草幼苗期特有的OTU数为9个,分蘖期和成熟期AMF群落中的特有OTU数分别为5个和2个。白羊草幼苗期的GlomusperpusillumVTX00287菌占比最大(29.8%),分蘖期和成熟期相对丰度最多的丛枝菌根真菌均是GlomusMOG18VTX00064,分别达26.8%和27.8%(图1)
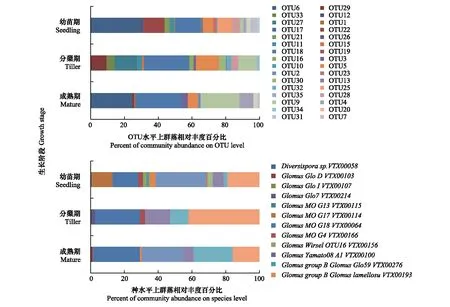
图1 在OTU(分类操作单元,operational taxonomic unit)水平和种水平上白羊草不同生长阶段AMF群落相对丰度Fig.1 Relative abundance of AMF community on OTU and species levels in different growth stages of B. ischaemumOTU:分类操作单元,operational taxonomic unit,不同数字表示各OTU编号;Diversispora:多孢囊霉属;Glomus:球囊霉属;Paraglomus:类球囊霉属;不同属名后字母及编号:在种水平上各属丛枝菌根真菌的菌株编号
所有采样点测序文库的覆盖度均达到99%以上,说明绝大部分AMF序列可以被测出,测序结果具有较好的代表性。随着白羊草的生长,其根际土壤AMF的香农指数逐渐降低,即在幼苗期达到最大值(2.339),而辛普森指数在成熟期达到最大值(0.204)。ACE指数和Chao1指数变化趋势与香农指数一致,均在幼苗期达到最大值,在成熟期丰富度指数最低(表3)。
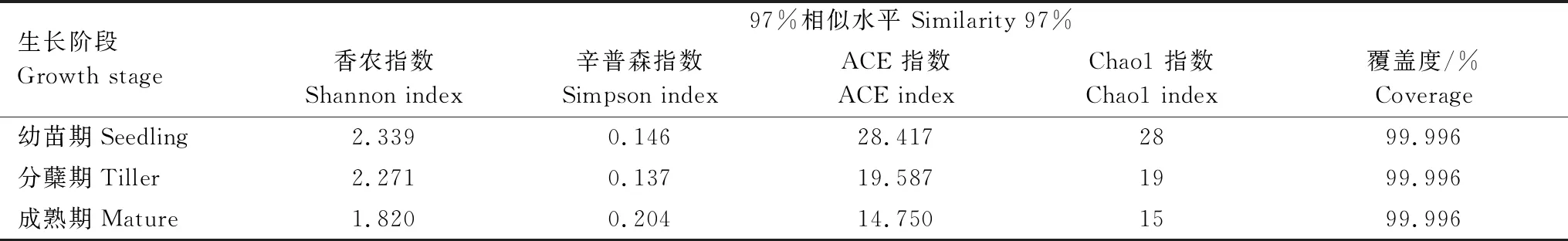
表3 不同生长阶段白羊草根际土壤AMF的OTU丰度与多样性指数
2.4 土壤理化性质及酶活性对白羊草AMF群落的影响
白羊草不同生长阶段中,AMF群落受到土壤理化性质和土壤酶活性的影响(图2),为研究这些生态因子对AMF群落结构的影响大小以及各时期影响AMF的关键因素,使用软件Canoco 4.5对实验数据进行了RDA约束排序分析,得到在科水平上AMF的群落组成与6种土壤理化性质及4种土壤酶活性之间的关系。结果表明土壤理化性质和土壤酶活性分别能够解释81.0%和83.0%的变异信息,白羊草各生长阶段AMF群落组成具有差异性,其中,第一排序轴解释了68.2%,第二排序轴解释了12.8%的信息,主要影响幼苗期白羊草根际土壤球囊霉科(Glomeraceae)的是土壤养分(总碳和总氮)和碳氮比。分蘖期白羊草根际土壤中的多样包囊霉科(Diversisporaceae)与土壤pH显著相关。分蘖期白羊草根际土壤中的多样孢囊霉科(Diversisporaceae)的丛枝菌根真菌主要受土壤pH的影响(图2)。白羊草幼苗期,球囊霉科(Glomeraceae)与碱性磷酸酶显著正相关;分蘖期多样孢囊霉科(Diversisporaceae)与蔗糖酶显著相关,成熟期的双型囊霉科(Ambisporaceae)与土壤过氧化氢酶显著相关,类球囊霉科(Paraglomeraceae)与土壤脲酶也具有显著正相关关系(图2)。这表明不同生长阶段白羊草根际土壤的丛枝菌根真菌群落受土壤理化性质和酶活性的影响大小也各有差异。
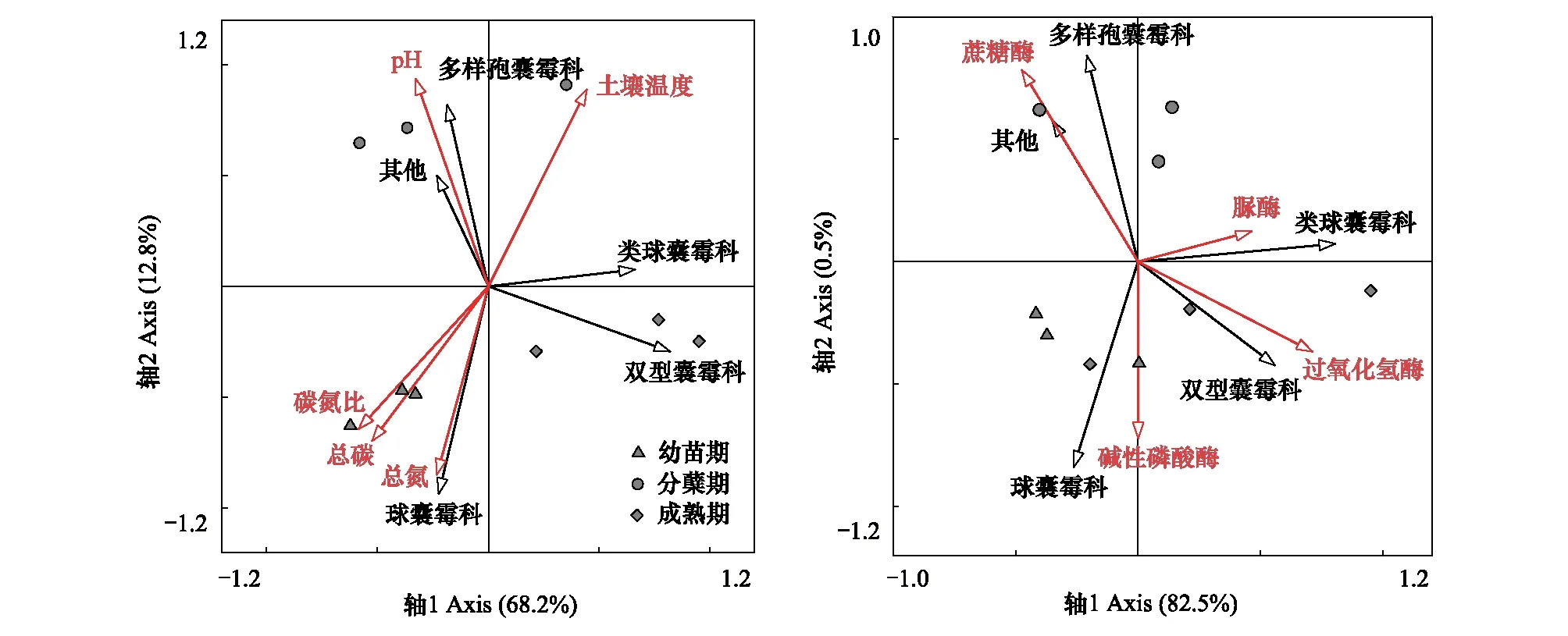
图2 不同生长阶段白羊草AMF群落与土壤理化性质(A)及土壤酶活性(B)的RDA分析Fig.2 Redundancy analysis (RDA) bi-plot of AMF community at family level, soil properties (A) and enzyme activity (B)
3 讨论
AMF群落主要分布在根系周围的土壤中,与土壤环境紧密相关。土壤养分可直接或间接影响AMF侵染、菌根共生体系发育、产孢和分布[23]。Wang[24]等对毛乌素沙漠AMF群落结构和多样性的研究发现,不同土壤深度的植物AMF组成中,球囊霉属(Glomus)和无梗囊霉属(Acaulospora)占总数的70%以上,多样孢囊霉属(Diversispora)和巨孢囊霉属(Gigaspora)仅在浅层土壤中发现。本研究中,处于相同生长阶段,白羊草根际土壤的AMF群落组成也具有明显差异,分蘖期多样孢囊霉属(Diversispora)占优势,成熟期类球囊霉属(Paraglomus)相对丰度最高,这可能由于分蘖期植物根系所处土层较浅,而随着植物生长,根系不断伸长,所处土层深度增加,优势菌逐渐变为球囊霉属(Glomus)。有研究发现, AMF的丰度和密度随着土壤肥力的提升均呈增加趋势[25],并且在一定范围内AMF孢子数量随有机质含量的升高而增多[26]。本研究中白羊草幼苗期,根际土壤中球囊霉科(Glomeraceae)的主要因子是土壤总碳、总氮和碳氮比,这与前人的研究结果类似。土壤pH直接影响丛枝菌根的形成、AMF的产孢和种属分布。有研究表明,不同AM真菌种的最适pH不同,球囊霉属(Glomus)能适应较广泛的土壤pH范围,但喜在碱性和中性土壤中生长[27-28]。相一致地,本研究发现白羊草各生长阶段的优势AMF均为球囊霉属(Glomus),这可能与铜尾矿土壤pH呈碱性(8.1—8.9)有关。此外,白羊草分蘖期,根际土壤中的多样孢囊霉科(Diversisporaceae)与土壤pH显著相关,这表明相对于AMF物种而言,环境对各AMF的筛选差异更加直接和显著[29]。
AMF群落的环境影响因子除非生物因子外,生物因子如宿主植物及人为干扰也会对AM真菌的分布产生明显的影响。AMF与植物形成的共生体系,二者通常具有紧密联系,地上植被可对AMF群落产生关键影响[30-32]。有研究表明,AMF的物种数与植物群落的物种数存在显著正相关关系[31]。本研究中,不同生长发育阶段的白羊草AMF的物种组成和多样性表现出明显差异,这可能由于不同生长阶段宿主植物所需的光合产物不同,因此,输送给对使自身生长更为有利的AMF具有一定差异,进而影响各个生长阶段AMF的群落组成和多样性[33],而且植被恢复过程中,白羊草周围的非菌根植物或弱菌根植物的存在也会对AMF的群落组成及多样性产生影响[34]。此外,AMF与土壤中其他微生物之间关系复杂,可相互促进、抑制或互不影响[35]。研究表明,逆境条件下AMF有助于提高土壤中微生物的量,同时也提高了土壤中相关酶的活性[36]。本研究中,成熟期白羊草根际土壤中类球囊霉科与土壤脲酶显著正相关,这与前人的研究结果一致。
综上所述,各生物与非生物因子并不是独立地对AMF群落产生作用,而是作为一个整体综合发挥作用[33]。同时,由于铜尾矿区重金属污染严重[3- 4],因而,重金属可能对AMF群落结构与多样性也有重要的影响,而白羊草根际土壤中AMF的优势物种在胁迫环境中表现出良好的适应性,为进一步研究重金属胁迫下AMF群落生态功能提供科学基础,同时,白羊草各个生长阶段的优势AMF可为矿区生态修复提供可利用的菌种资源,从而加速铜尾矿区受损生态系统的恢复。

