叶酸靶向超声纳米造影剂的制备及其细胞孵育装置的设计
李 莹,刘 威,廖秀玉(通讯作者)
(1福建医科大学附属第一医院重症医学科 福建 福州 350005)
(2福建中医药大学附属人民医院麻醉科 福建 福州 350005)
癌症近年来已经成为临床上危害全世界人类健康的主要疾病之一,而癌细胞被检测出的越早,则治愈的可能性就越高。研究表明癌症可以实现早期检测,则将有30%的癌症患者得以生存,超声分子成像技术近年来得到长足的发展。叶酸及其还原产物是真核细胞核酸合成过程必不可少的原料,可特异性地与细胞表面糖基磷脂酰肌醇连接的叶酸受体结合。叶酸受体在正常细胞表面的表达非常有限,而在肿瘤细胞表面常存在过表达,如宫颈癌、卵巢癌、乳腺癌等,叶酸受体的特异性分布为肿瘤的靶向造影和靶向治疗提供了可能性,也极大程度地降低了对正常组织的影响[1]。本实验采用价格低廉、无细胞毒性、生物相容性较好的N-软脂酰基壳聚糖(N-palmitoyl chitosan,PLCS)共价连接叶酸制备了叶酸靶向超声纳米造影剂[2],粒径均匀,靶向性可靠。本实验还成功实现叶酸纳泡与叶酸受体高表达的Hela细胞的共孵育,望用其作为分子探针对叶酸受体高表达的肿瘤进行超声分子成像。
1 材料与仪器
剪切仪(IKA ULTRA-TURRAX T25,德国IKA公司);全氟丙烷(广东佛山捷和气体有限公司);马尔文粒度分析仪(ZS Nano S,英国Malvern公司);共聚焦成像系统(FluoView FV10i,Olympus,日本);透射电镜(FEI TECNAI SPIRIT G2,美国);扫描电镜(FEI QUANTA 200,美国);35mm×12mm玻底培养皿(耐思生物科技有限公司,中国);100mm×20mm培养平皿(康宁,中国);25cm2透气培养瓶(康宁,中国);HeLa细胞(行知生物科技有限公司,中国);叶酸(华南农业大学资源环境学院提供);DMSO(PanEra,中国);牛血清白蛋白(BSA,Sigma,美国);DiO 细胞膜绿色荧光探针(碧云天,中国);RPMI 1640培养基(gibco,美国);胎牛血清(hyclone,南美洲);0.25%胰酶(gibco,美国);N-软脂酰基壳聚糖/叶酸-N-软脂酰基壳聚糖(华南农业大学资源环境学院提供)。
2 方法
2.1 纳泡制备
2.1.1普通N-软脂酰基壳聚糖纳泡/叶酸-N-软脂酰基壳聚糖纳泡(以下简称C-NBs/F-NBs)的制备
将适量N-软脂酰基壳聚糖/叶酸-N-软脂酰基壳聚糖等膜材料加入20ml蒸馏水中,在50℃水浴条件下轻轻搅拌至完全溶解,置入50ml注射器内,注射器头端以三通管连通C3F8氟碳气体。将剪切仪置人注射器内至液面下2.5cm处,在通入氟碳气体的同时,以剪切仪第5档(21000r/min)剪切40s后,转第6档(24000r/min)剪切7min。纳泡制备后分装入青霉素瓶中,填充氟碳气体并密封瓶口,4℃保存备用。
2.1.2 DiO荧光N-软脂酰基壳聚糖纳泡(DiOencapsulated NBs)制备
为了在荧光下更好地观察N-软脂酰基壳聚糖纳泡(NBs),我们将荧光探针DiO连接到NBs表面,制备DiO-encapsulated NBs,方法如下:将适量N-软脂酰基壳聚糖或叶酸-N-软脂酰基壳聚糖加入20ml蒸馏水中,在50℃水浴条件下轻轻搅拌至完全溶解。下述步骤尽量避光操作:取适量DiO溶解于DMSO中(1mg/ml),用注射器吸取DiO/DMSO溶液,逐滴缓慢加入溶解的N-软脂酰基壳聚糖或叶酸-N-软脂酰基壳聚糖溶液中,同时轻轻搅拌使DiO与壳聚糖充分混合;将上述溶液置入50ml注射器内,注射器头端以三通管连通C3F8氟碳气体。以下步骤与普通纳泡制备方法相同,将装有荧光纳泡的青霉素瓶以锡纸包裹后放于4℃避光保存。
2.2 纳泡基本特征的观察和测定
纳泡制备后24小时进行下列检测:将纳泡轻轻摇匀,取一小滴加至载玻片上,普通光学显微镜及荧光显微镜下观察纳泡的外观形态;以透射电镜(Transmission electron microscopy,TEM)检测纳泡之前,先进行甲胺钨酸盐染色:纳泡混悬液滴在表面镀了碳膜的铜网(200目)上,自然干燥5min后,以滤纸轻轻吸干铜网上残余的液体,然后把铜网浸泡在甲胺钨酸盐的缓冲溶液中,染色1min,清水中漂1~2次,室温下晾数分钟,透射电镜下观察纳泡的内部结构;扫描电镜(Scanning electron microscopy,SEM)观察纳泡表面形貌:纳泡混悬液滴在表面镀了碳膜的铜网(200目)上,室温下干燥,镀以钯-铂金属膜;共聚焦显微镜下观察F-NBs及C-NBs,明确叶酸是否成功地连接至壳聚糖纳泡表面:纳泡悬液稀释后滴于载玻片上,以盖玻片覆盖,共聚焦显微镜下进行观察,激发光波长为365nm,发射波长为450nm;马尔文粒度分析仪检测纳泡的大小:100μl纳泡稀释至5ml,倒入检测池中,以532nm的激光垂直照射样品池,检测器与入射光的角度为90°;Zeta电位仪分析纳泡表面电位:纳泡混悬液用去离子水稀释;细胞计数板计数纳泡的浓度。
2.3 纳泡与细胞共孵育
本实验中HeLa细胞为贴壁细胞,可通过如下方法实现纳泡与细胞的共孵育。
接种于25cm2透气培养瓶的细胞:①细胞贴壁后,去除培养液,PBS冲洗后加入适量纳泡,以RPMI 1640培养基加满整个培养瓶以排尽瓶内气体,拧紧瓶盖,上下颠倒数次使纳泡在培养基中均匀分布,避免剧裂振荡;②将上述培养瓶倒置于37℃细胞培养箱中,纳泡上浮后可与细胞充分接触,达到孵育的目的(图1A)。
接种于35mm×12mm玻底培养皿的细胞:①准备一个100mm×20mm培养平皿,加入适量的培养基,再加入适量的纳泡,充分混匀;②细胞贴壁后,去除培养液,PBS冲洗,将玻底皿倒扣于前述100mm×20mm培养平皿,以自制抽气装置将玻底皿内气体抽尽使细胞完全浸润于培养基中,如图1B~D所示。

图1 NBs与细胞共孵育的装置(A:接种于25cm2透气培养瓶的贴壁细胞与NBs共孵育示意图;B:自制抽气装置,将输液针头折弯形成约120°夹角,如红色圆圈所示;C:玻底皿内气体被抽出前;D:玻底皿内气体被抽出后)。
2.4 共聚焦成像
将接种于玻底培养皿的HeLa细胞与DiO-encapsulated F-NBs孵育30min,去除培养基,PBS冲洗,再次加入新鲜的培养基,在共聚焦显微镜下观察细胞与纳泡的情况。
3 结果
3.1 纳泡外观形态和理化特性
F-NBs/C-NBs/DiO-encapsulated NBs制备后呈淡黄色/白色/橙黄色的混悬液,静置24h后,上层为约2~3mm的淡黄色/白色/橙黄色纳泡聚集层,下层为透明溶液(图2-1A),轻轻摇匀后造影剂呈均匀毛玻璃样混悬液(图2-1B)。普通光学显微镜观察,纳泡呈透亮球形,粒径小,大小较均一,分布均匀,彼此无聚集现象(图2-1C),荧光显微镜观察,DiO-encapsulated NBs呈绿色圆环状(图2-1D)。透射电镜图(图2-1E)及扫描电镜图(图2-1F)清楚地显示N-软脂酰基壳聚糖纳泡的内部结构(壳聚糖外壳+中心空腔)和表面形貌。
共聚焦显微镜下观察F-NBs及C-NBs,激发光波长为365nm,发射波长为450nm,F-NBs表面带蓝色荧光,荧光分布均匀,而C-NBs表面无荧光,说明靶分子叶酸成功连接到纳泡表面,且叶酸分布均匀,F-NBs构建成功(图2-2)。
马尔文粒度分析仪测得纳泡平均粒径为(617±12)nm(图2-3A),Zeta电位仪测定表面电位为(55.3±2.1)mV(图2-3B),计数板计算纳泡浓度约为(7.2±0.6)×109/ml。

图2-1 纳泡外观形态(A:NBs制备后静置24小时大体形态;B:NBs摇匀后大体形态,A、B图由左至右依次为F-NBs、C-NBs及DiO-encapsulated F-NBs;C:NBs在普通显微镜下所见形态;D:DiOencapsulated F-NBs在荧光显微镜下所见形态;E、F:NBs的透射电镜图及扫描电镜图;C、D、E、F图左上角均为局部放大图)。

图2-2 共聚焦显微镜下观察F-NBs及C-NBs(A:F-NBs表面呈蓝色荧光,说明叶酸已成功连接到NBs表面;B:F-NBs在明场下所见;C:C-NBs表面无荧光;D:C-NBs在明场下所见)。
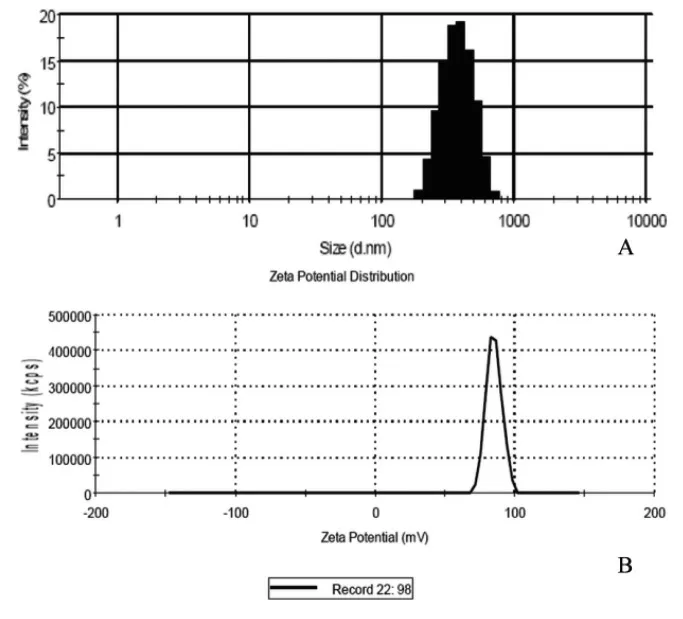
图2-3 纳泡粒径及表面电位分布(A:马尔文粒度分析仪所测得纳泡的粒径分布;B:Zeta电位仪所测得纳泡的表面电位)。
3.2 DiO-encapsulated F-NBs与Hela细胞共孵育后的共聚焦成像
在共聚焦显微镜下可见,Hela细胞形态正常,分布均匀,细胞间紧密结合,可见较多DiO-encapsulated F-NBs粘附在细胞表面,部分散在分布在细胞质内,纳泡结构完整(图3A、3B)。

图3 DiO-encapsulated F-NBs与Hela细胞共孵育后的共聚焦成像
4 结论
近年来,临床上恶性肿瘤发病率一直有升高的趋势,而且恶性肿瘤致死率高,如何能在早期诊断中确诊,如何做到靶向治疗是目前医学研究的热点。本实验将叶酸共价连接到N-软脂酰基壳聚糖上,结合稳定,F-NBs制备过程中叶酸不易丢失和改变构象,可良好解决靶向造影剂生物连接中配体产率和配体靶向活性的问题。实验材料叶酸、壳聚糖来源丰富、价格便宜,且无毒副作用,生物相容性好。
研究表明疾病状态时内皮细胞间隙会出现变化,如肿瘤新生血管的间隙较大,大部分肿瘤新生血管允许700nm以下的粒子通过[3],F-NBs粒径小,可以通过肿瘤血管内皮间隙进入血管外组织间隙,而叶酸与叶酸受体有效特异的结合,使F-NBs有望作为分子探针对叶酸受体高表达的肿瘤进行靶向超声分子成像[4]。
微泡/纳泡具有良好的药物和基因包载功能,可设计单靶点、多靶点、多功能和多模式的分子探针等。因此,有效跨越血管内皮屏障的靶向纳泡的成功构建,为使超声分子成像技术能全面实现在活体中从分子水平定位、定量和可视化研究疾病发生和发展的规律,以及为疾病的早期预警诊断和干预效果监测提供了可能。以靶向超声纳泡为基础可设计出载药靶向纳泡,以及可设计出具有诊断和治疗功能的载药靶向微泡/纳泡/纳米粒复合剂,具有靶向治疗的潜在价值。

