地塞米松注射液联合葡萄糖高渗液对兔眼角膜内皮的保护作用
李 彪,尹 利,曲 超,2
0引言
目前,白内障仍然是全世界第一大致盲眼病,随着现代生活水平逐步提高,医学不断发展进步,人类平均寿命的延长,白内障发病率和患病率呈逐年递增趋势[1]。手术依然是治疗白内障最有效的途径[2],白内障超声乳化术因为治疗效果好、手术时间短、创伤小、产生术源性散光低、术后恢复快等优点近年来被眼科医生广泛采用[3-4],然而超声乳化术后的一系列并发症影响了手术效果,角膜水肿是其中最常见的术后并发症之一[5],国外有研究者报道超声乳化术后角膜水肿的发生率为12.7%[6]。角膜内皮细胞在维持角膜正常厚度、透明性方面起着重要作用[7],常规超声乳化手术由于超声乳化的能量及乳化颗粒的机械损伤均会引起角膜内皮细胞数量不同程度下降。但是通常角膜内皮细胞数量>1500cells/mm2手术都是安全的。以往的共识认为角膜内皮细胞数量<1500cells/mm2可以考虑白内障囊外摘除(extracapsular cataract extraction,ECCE),但是随着手术设备的优化,手术技巧的日趋完善,很多术者在探寻角膜内皮细胞数量的最低界限,目前角膜内皮细胞数量在400~800cells/mm2被认为是一个界限值。
超声乳化术中,角膜内皮细胞受到损伤,术后早期细胞的能量主要用于两方面:(1)自身修复;(2)Na+-K+ATP泵工作,保持角膜脱水状态。因此如果术后早期(术后0~24h)使用高渗液保持角膜的脱水状态,内皮细胞将节省出更多的能量,用于自身修复。我们在临床观察发现,术后第1d早上,通常是角膜能否经受手术考验的关键时间点,如果术后第1d早上角膜透明,则角膜水肿不会再有加重。如果角膜水肿,高渗液的使用时间可能是病情的转折点。本研究采用兔作为研究对象,探讨地塞米松联合高渗液对兔眼角膜内皮的早期保护作用,为临床治疗角膜水肿,防止角膜内皮失代偿提供参考依据。
1材料和方法
1.1材料
1.1.1实验动物与分组健康成年日本大耳白兔20只40眼(四川省人民医院实验动物中心提供),雌雄不限,体质量2.0~2.2kg,均在裂隙灯显微镜下检查,排除有眼部疾病者。按随机数字表法分为A、B、C、D四组(每组5只10眼)。本研究通过四川省人民医院医学伦理委员会审查[No.伦审(研)2019年第273号]。
1.1.2主要试剂葡萄糖高渗液(50%葡萄糖注射液与维生素C注射液按5∶1比例配制,无菌操作,现配现用,4℃恒温冰箱保存);0.2%地塞米松注射液(辰欣药业);0.4%盐酸奥布卡因滴眼液(参天制药)。
1.1.3主要仪器眼科手术显微镜(Zessis S88,Zessis Corporation,German);裂隙灯光学显微镜(Topcon Corproration,Janpan);A超角膜厚度测量仪(Pachymeter SP-3000,Japan);相干光断层扫描成像系统(RTVuee100-2,America);角膜内皮仪(Topcon SP-3000P,Janpan)。
1.2方法
1.2.1角膜水肿动物模型建立造模前用角膜厚度测量仪测量角膜中央厚度(CCT),角膜内皮仪测量角膜内皮细胞计数,前节OCT检查角膜。所有兔均采用30mg/mL戊巴比妥溶液(1mL/kg)耳缘静脉注射麻醉,待进入全麻状态后,将其侧卧位固定于手术台上,术眼常规消毒铺巾。开睑器开睑,聚维酮碘+生理盐水冲洗结膜囊,0.4%盐酸奥布卡因1滴滴于结膜囊行表面麻醉,显微齿镊固定眼球,用2.4mm角膜穿刺刀分别于12∶00、3∶00位透明角膜缘做自闭性切口,前房维持器连接接有平衡液与灭菌注射用水按3∶7比例(基于前期实验观察结果,该比例既能建立兔眼角膜水肿模型,又不会导致兔眼角膜内皮失代偿)配制的低渗液输液器,瓶高75cm,从12∶00位进入前房,斜口朝向晶状体但不接触晶状体及角膜,维持前房灌注,并用钝性针头穿刺入3∶00位切口,保持引流通畅,防止眼压过高,并于显微镜下观察角膜水肿情况,维持前房灌注10min。角膜雾样水肿,则造模成功。若实验操作过程中刺伤晶状体或角膜,则按要求重新补充实验动物。
1.2.2造模后处理A组:造模后立即予以地塞米松注射液0.2mL结膜下注射,高渗葡萄糖液按15min/次频繁点眼;B组:造模后立即予以0.9%生理盐水0.2mL结膜下注射,平衡盐溶液按15min/次频繁点眼;C组:造模后第2d予以地塞米松注射液0.2mL结膜下注射,高渗葡萄糖按15min/次频繁点眼;D组:造模后第2d予以0.9%生理盐水0.2mL结膜下注射,平衡盐溶液按15min/次频繁点眼。各组滴眼液滴眼每天持续8h,共7d。
1.2.3观察指标
1.2.3.1兔眼角膜裂隙灯显微镜下观察造模后第1、3、5、7d于裂隙灯下观察兔眼角膜水肿情况,参考文献[8]将角膜水肿程度分为0~4级:0级,角膜完全透明,无水肿;1级,角膜轻度水肿,可观察到虹膜、晶状体细节;2级,角膜中度水肿,可观察到虹膜、晶状体;3级,严重的角膜水肿,无法观察到晶状体;4级,弥漫角膜水肿,无法观察到虹膜。
1.2.3.2兔眼CCT测量超声测厚法是临床上应用最广泛的CCT测量方法[9],被公认为是角膜厚度测量的“金标准”[10]。造模后第1、3、5、7d行裂隙灯检查后测量CCT,具体方法为将兔固定于专用固定架上,以0.4%盐酸奥布卡因表面麻醉后,使用A超角膜厚度测量仪测量CCT,测量5次取平均值。
1.2.3.3兔眼角膜内皮细胞计数造模后第1、3、5、7d全身麻醉后采用角膜内皮仪行角膜内皮细胞检查,测量角膜内皮细胞计数。
1.2.3.4兔眼前节OCT检查造模后第1、3、5、7d全身麻醉后行前节OCT检查,观察兔眼角膜水肿情况。
2结果
2.1兔眼角膜裂隙灯显微镜下观察造模前,各组兔眼角膜透明(图1A)。造模后,A组兔眼在整个实验观察中角膜保持透明,水肿程度为0~1级(图1B);C组兔眼造模后第1d角膜水肿最明显,为2~3级(图1D),其后逐渐消退;B、D组兔眼造模后角膜水肿明显,至造模后第3d最显著,为3~4级(图1C、1E),最长消退时间为造模后21d,角膜基本恢复透明,未出现角膜大泡性病变,考虑与兔眼角膜内皮可再生有关。造模前后各组兔眼角膜水肿程度分级见图2。

图1 各组实验兔造模后第3d裂隙灯下观察角膜水肿情况 A:造模前,角膜透明;B:A组,角膜透明;C:B组,角膜弥漫水肿,眼内结构窥不清;D:C组,角膜水肿,但尚可观察到虹膜;E:D组, 角膜弥漫水肿,眼内结构窥不清。

图2 各组实验兔在不同观察时间点角膜水肿程度。
2.2兔眼角膜中央厚度测量结果造模前后不同时间点各组兔眼CCT测量结果比较具有时间差异性(F=1514.703,P<0.05)和组间差异性(F=801.98,P<0.05),且不同组在不同时间上的变化趋势具有差异性(F=29.402,P<0.05),见表1~3。造模前,各组兔眼CCT测量结果差异无统计学意义(P>0.05)。造模后,A组兔眼CCT在实验过程中变化不明显;C组兔眼CCT在造模后第1d最高,其后逐渐下降;B、D组兔眼CCT明显增加,在造模后第3d增加最明显,其后逐渐缓慢下降。
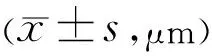
表1 各组兔眼在不同时间测量的CCT值

表2 各组兔眼不同时间CCT的比较 P值

表3 不同时间各组兔眼CCT的比较 P值
2.3兔眼角膜内皮细胞测量结果造模前,各组兔眼角膜内皮细胞计数分别为2979.6±273.3、2947.4±210.3、3002.3±145.1、3017.8±125.3cells/mm2,差异无统计学意义(F=0.272,P>0.05)。造模后第1、3、5、7d,A组兔眼角膜内皮细胞数分别为2962.9±223.4、2984.9±232.6、2991.2±243.0、2983.7±251.1cells/mm2,差异无统计学意义(F=0.02,P>0.05);造模后第7d,C组兔眼可测出角膜内皮细胞数为2821.8±141.1cells/mm2,与C组造模前相比差异有统计学意义(t=11.498,P<0.05),与A组造模后第7d相比差异有统计学意义(t=-2.024,P<0.05);B、D组兔眼由于角膜水肿在观察期间无法测出角膜内皮细胞数量。
2.4兔眼前节OCT检查情况兔眼前节OCT图像可见,造模前各组兔眼角膜厚度正常(图3A);造模后,A组兔眼角膜无明显增厚(图3B),C组兔眼角膜轻度增厚(图3D),B、D组兔眼角膜基质明显水肿,厚度增加,超过OCT自动测厚上限(800μm)(图3C、3E)。

图3 各组实验兔造模后第3d前节OCT检查结果 A:造模前,角膜厚度正常;B:A组,角膜厚度正常;C:B组,角膜明显增厚,超过OCT自动测厚上限;D:C组,角膜轻度增厚;E:D组,角膜明显增厚,超过OCT自动测厚上限。
3讨论
角膜内皮细胞在维持角膜透明性方面具有十分重要的作用。角膜内皮由一层厚约5μm的六角形扁平细胞构成,内皮细胞之间的缝隙连接及基质构成机械屏障连同细胞的离子泵功能,可防止过多水分进入角膜基质并将多余水分主动排出细胞从而维持角膜透明。人类角膜内皮细胞数量约2800~4000cells/mm2,并随着年龄增加而逐渐减少,一般以每年0.6%的速度下降。此外,外伤、青光眼、糖尿病及多种角膜原发病如Fuchs角膜内皮营养不良、Peters异常、圆锥角膜[11]等均可造成角膜内皮细胞损伤。人类角膜内皮细胞不可再生,损伤后将由周围的细胞扩大、移行代偿其功能。Goktas等[12]通过动物实验发现,角膜内皮细胞密度的危险阈值是1000cells/mm2,当细胞密度低于阈值时,角膜水肿的发生率成倍增长,若损伤导致角膜内皮细胞数量明显减少,低于临界值,残余细胞将不能代偿其功能,可导致角膜内皮失代偿,发生严重角膜水肿,甚至角膜大泡性病变。目前对于术后角膜水肿的治疗主要有药物治疗,包括类固醇激素、非甾体抗炎类药物、重组人表皮生长因子滴眼液、谷胱甘肽、高渗液等,其中类固醇激素具有强大的抗炎作用,可抑制免疫反应,抑制炎性渗出,保护受损伤的细胞,而高渗液是辅助内皮细胞完成角膜脱水状态的一种重要物质,可能帮助内皮细胞节约能量,从而使内皮细胞有更多的能量用于自身修复。
我们推测超声乳化术后早期内皮细胞损伤最重,细胞刚刚经历了手术损伤,包括超声能量[13]、超声乳化产生的热量、皮质碰撞等机械性损伤、灌注液的损伤[14]等。术后早期,内皮细胞的生存环境也相对恶劣,前房的微环境处于恢复状态,房水pH值、渗透压、电解质及其他物质的含量都在逐步回归正常状态。因此,术后保护细胞的治疗应该在手术结束后立即进行。同样的治疗措施,使用的时间不同,可能是完全不同的结果。本研究中,A组和C组采用同样的药物,但是不同的给药时间,A组造模结束后,立即进行药物保护,C组则是模仿临床的传统方法,临床治疗中总是在术后第1d早上若发现有问题才进行处理,我们认为这种做法可能错过了最佳的治疗时机。本研究发现,A组由于用药时间早,可能使大量临界细胞顺利完成了自身修复,得以存活,所以仅在造模后第1d早上角膜有1级水肿,角膜厚度没有明显增加;而C组在造模后第1d早上角膜水肿严重,此后开始使用高渗液,角膜厚度变薄,但是,也许由于细胞负担过重,导致更多角膜内皮细胞死亡,所以造模后1wk内,尽管高渗液连续使用,但是角膜厚度基本均在400μm以上,造模后各观察时间点A、C组兔眼角膜中央厚度差异显著。1wk后,C组兔眼角膜透明,第一时间测量了角膜内皮细胞计数,C组的内皮细胞数量明显小于A组,这表明高渗液的延迟使用,导致了角膜内皮细胞更多的死亡。B、D组作为对照组,未给予地塞米松注射液结膜下注射和高渗液滴眼,在整个观察期间,B、D组角膜明显水肿,角膜内皮细胞无法计数。上述研究结果表明,地塞米松注射液联合葡萄糖高渗液对兔眼角膜内皮具有保护作用,提前用药对于角膜内皮的保护有着关键性的作用。本实验的观察期仅为7d,主要是由于兔眼角膜内皮细胞具有增生能力,这与人眼不同,长于7d的观察受增生的影响较大,不能模拟临床问题。我们观察发现,3wk后各组兔眼角膜均接近透明。
综述所述,地塞米松注射液联合葡萄糖高渗液对兔眼角膜内皮细胞有良好的保护作用,早期联合应用能有效预防及治疗角膜水肿,避免进展至角膜内皮失代偿。但本研究未比较单纯使用地塞米松或葡萄糖高渗液的疗效,需在后续研究中进一步探索。

