miR-221对高糖诱导的人视网膜血管内皮细胞凋亡的作用机制
路 璐, 李 欢
0引言
miRNA为短链的非编码内源性保守的微小RNA分子,其通过抑制靶基因的转录或翻译过程及调控信号通路的活性,在疾病的发生发展中具有重要作用[1]。miR-221在机体多种肿瘤中均出现表达失调,其在糖尿病引起的疾病中也有重要作用[2],但是其在糖尿病视网膜病变中的功能及作用机制研究甚少。本研究拟以高糖诱导的人视网膜血管内皮细胞HRCECs为研究对象,检测其中miR-221、p53、MDM2的表达,观察过表达miR-221、抑制miR-221、过表达MDM2对高糖诱导的HRCECs细胞凋亡的影响,揭示miR-221促进高糖诱导的HRCECs细胞凋亡的机制与P53/MDM2信号通路有关。
1材料和方法
1.1材料人视网膜血管内皮细胞HRCECs购自ATCC;DMEM培养基购自美国GIBCO公司;Trizol液购自上海恪敏生物科技有限公司;LipofectamineTM2000购自北京宜科思源科技有限公司;BCA蛋白定量试剂盒购自北京艾然生物科技有限公司;逆转录试剂盒购自大连TaKaRa公司;RIPA蛋白裂解液购自碧云天生物技术公司;Annexin V-FITC/PI凋亡检测试剂盒购自北京索莱宝公司。P53抗体购自上海研谨生物科技有限公司;MDM2抗体购自Abcam;辣根过氧化物酶标记的山羊抗兔IgG抗体购自深圳市豪地华拓生物科技有限公司。
1.2方法
1.2.1细胞培养将人视网膜血管内皮细胞HRCECs用含10%胎牛血清的DMEM培养基,置于37℃,5% CO2的恒温培养箱中常规培养,每2~3d传代一次。
1.2.2细胞转染与分组将正常培养的HRCECs细胞分为NG组、HG组、HG+miR-NC组、HG+miR-221组、HG+anti-miR-NC组、HG+anti-miR-221组、HG+miR-221+pcDNA 3.1组、HG+miR-221+pcDNA 3.1-MDM2组。各组细胞的处理方法分别为:NG组:用5mmol/L的葡萄糖处理48h的HRCECs细胞;HG组:用30mmol/L的葡萄糖处理48h的HRCECs细胞;将miR-NC、miR-221 mimics、anti-miR-NC、anti-miR-221、miR-221 mimics+pcDNA 3.1、miR-221 mimics+pcDNA 3.1-MDM2按照脂质体LipofectamineTM2000试剂说明书的操作步骤转染至HRCECs细胞,转染5h后,弃去培养液更换新鲜的培养基继续培养48h,用qRT-PCR法确认转染效率达到要求。转染成功后用30mmol/L的葡萄糖处理培养48h,分别标记为HG+miR-NC组、HG+miR-221组、HG+anti-miR-NC组、HG+anti-miR-221组、HG+miR-221+pcDNA 3.1组、HG+miR-221+pcDNA 3.1-MDM2组,用于后续实验研究。
1.2.3 qRT-PCR法检测细胞中miR-221、p53、MDM2的表达Trizol法提取对数生长期的细胞样本总RNA,并用Nano-Drop 2000微量分光光度计进行RNA定量。DNaseⅠ消化RNA中可能污染的DNA。逆转录反应采用逆转录试剂盒方式,操作按照试剂盒说明书进行,合成模板链cDNA。按照反应体系进行,反应结束后通过分析Ct值,以U6、β-actin为内参,计算定量结果,以2-△△Ct法测定miR-221、p53、MDM2的相对表达水平。引物信息(5’-3’):miR-221上游引物ACACTCCAGCTGGGGAAACCCAGCAGACAA,下游引物CTCAACTGGTGTCGTGGAGT;p53上游引物TGACACGCTTCCCTGGATTGGCAGCCAGAC,下游引物CTGACGCACACCTATTGCAAGCAAGGGTTC;MDM2上游引物CACCTCACAGATTCCAGCTT,下游引物CGCCAAACAAATCTCCTAGA;β-actin上游引物GGACTTCGAGCAAGAGATGG,下游引物AGCACTGTGTTGGCGTACAG;U6上游引物CTCGCTTCGGCAGCACA,下游引物AACGCTTCACGAATTTGCGT。
1.2.4 Western blot实验检测细胞中p53、MDM2的蛋白表达将对数期细胞进行冰上蛋白裂解1h,提取总蛋白,以BCA法测定样品蛋白的浓度。以4∶1的比例加入蛋白上样缓冲液,混匀,沸水浴变性5min,离心取上清,取60μg目的蛋白进行SDS-PAGE蛋白电泳。然后将蛋白湿转至PVDF膜,5%脱脂奶粉室温封闭1h,TBST洗涤,4℃条件下,将封闭后的PVDF膜放入一抗(1∶1000稀释的P53抗体、MDM2抗体)中反应过夜,以封闭液洗膜3次,每次5min,再在37℃下将PVDF膜转入二抗(1∶500稀释的辣根过氧化物酶标记的山羊抗兔IgG抗体)中反应2h。于暗室内ECL试剂盒显影曝光:滴加化学发光剂显影,以凝胶成像系统采集图像。Quantity One 4.62图像分析软件进行条带灰度分析,以GAPDH为内参,以目的条带灰度值与GAPDH灰度值的比值表示目的蛋白的表达情况。
1.2.5 Annexin V-FITC/PI流式细胞术实验检测细胞凋亡将1.2.2各转染组细胞,用500μL的Binding Buffer悬浮细胞,分别加入5μL的Annexin V-/FITC避光反应20min后再加入5μL的PI避光反应20min,用300目铜筛过滤,最后在1h内上流式细胞仪结束检测。细胞的凋亡率(%)=早期凋亡率+晚期凋亡率。每个样品重复3次。

2结果
2.1 miR-221在高糖诱导的HRCECs细胞中的表达结果如图1所示,与NG组相比,HG组细胞中miR-221表达显著升高,差异有统计学意义(t=32.863,P<0.05)。
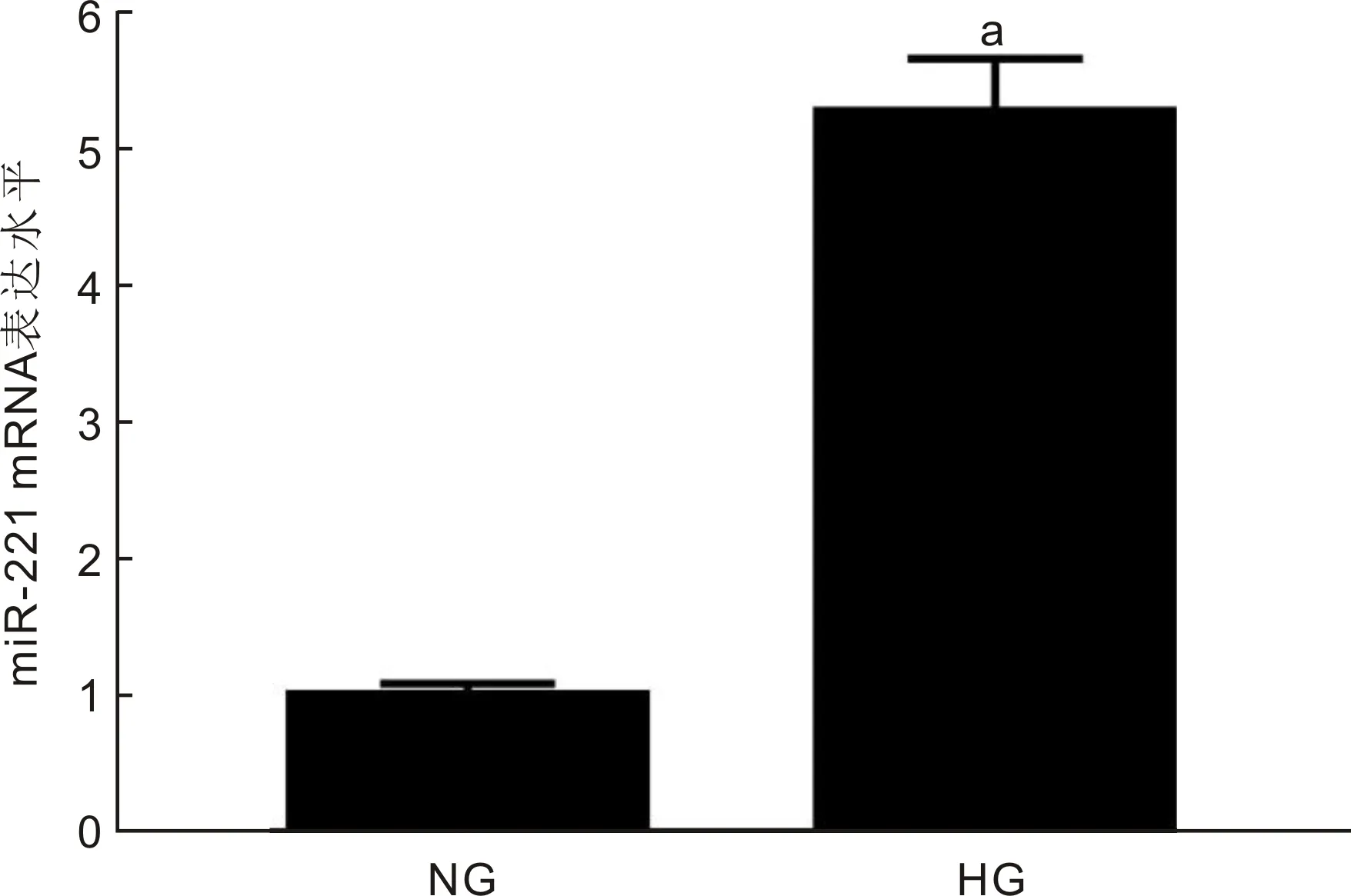
图1 miR-221在高糖诱导的HRCECs细胞中的表达 aP<0.05 vs NG组。
2.2 p53和MDM2在高糖诱导的HRCECs细胞中的表达结果如图2所示,与NG组相比,HG组细胞中p53的mRNA和蛋白表达均显著升高(t=15.274、16.127,均P<0.05),MDM2的mRNA和蛋白表达均显著降低(t=22.472、16.994,均P<0.05),差异均有统计学意义。

图2 p53和MDM2在高糖诱导的HRCECs细胞中的表达 A:p53、MDM2在高糖诱导的HRCECs细胞的mRAN的表达;B:p53、MDM2在高糖诱导的HRCECs细胞的蛋白表达。aP<0.05 vs NG组。
2.3过表达miR-221对高糖诱导的HRCECs细胞凋亡的影响结果如图3所示,NG组、HG组、HG+miR-NC组、HG+miR-221组细胞凋亡率比较,差异具有统计学意义(F=29.506,P<0.01)。与NG组相比,HG组细胞的凋亡率显著升高(P<0.05),与HG+miR-NC组相比,HG+miR-221组细胞的凋亡率显著升高,差异具有统计学意义(P<0.01)。
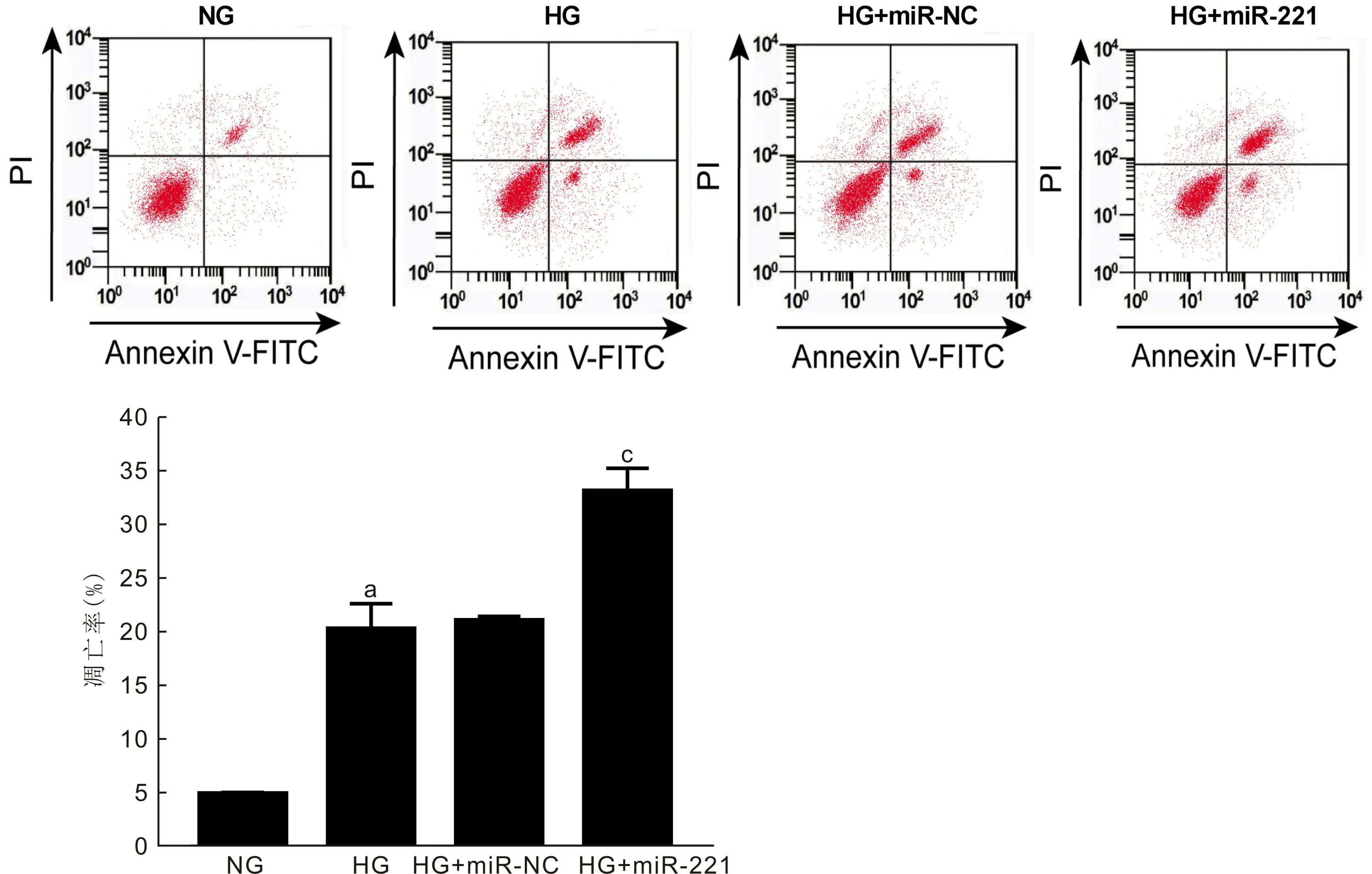
图3 过表达miR-221对高糖诱导的HRCECs细胞凋亡的影响 aP<0.05 vs NG组,cP<0.05 vs HG+miR-NC组。
2.4抑制miR-221对高糖诱导的HRCECs细胞中p53、MDM2表达及凋亡的影响结果如图4所示,HG组、HG+anti-miR-NC组、HG+anti-miR-221组细胞中p53 mRNA和蛋白表达、MDM2 mRNA和蛋白表达、凋亡率比较,差异均有统计学意义(F=707.353、211.787、372.761、334.887、170.664,均P<0.01)。与HG+anti-miR-NC组相比,HG+anti-miR-221组细胞中p53的mRNA和蛋白表达均显著降低,MDM2的mRNA和蛋白表达均显著升高,细胞凋亡率显著降低,差异均有统计学意义(P<0.01)。
2.5过表达MDM2对抑制miR-221的抗高糖诱导的HRCECs细胞凋亡的影响结果如图5所示,HG组、HG+miR-221+pcDNA 3.1组、HG+miR-221+pcDNA 3.1-MDM2组细胞凋亡率、p53蛋白表达、MDM2蛋白表达,差异均有统计学意义(F=202.442、347.115、621.257,均P<0.01)。与HG组相比,HG+miR-221+pcDNA 3.1组细胞凋亡率显著升高,p53蛋白表达显著升高,MDM2蛋白表达显著降低,HG+miR-221+pcDNA 3.1-MDM2组细胞凋亡率显著降低,p53蛋白表达显著降低,MDM2蛋白表达显著升高,差异均有统计学意义(P<0.05);与HG+miR-221+pcDNA 3.1组相比,HG+miR-221+pcDNA 3.1-MDM2组细胞凋亡率显著降低,p53蛋白表达显著降低,MDM2蛋白表达显著升高,差异均有统计学意义(P<0.01)。

图5 过表达MDM2对抑制miR-221的抗高糖诱导的HRCECs细胞凋亡的影响 A:过表达MDM2对抑制miR-221的抗高糖诱导的HRCECs细胞凋亡的影响;B:过表达MDM2对抑制miR-221的抗高糖诱导的HRCECs细胞中p53、MDM2蛋白表达的影响。aP<0.05 vs HG组,cP<0.05 vs HG+miR-221+pcDNA 3.1组。
3讨论
miRNA参与人类机体的多种疾病的发生发展,其中包括糖尿病[3-4]。由于miRNA的调控网络十分复杂,因此其在疾病中的作用机制成为研究的热点和难点。据报道,miR-221在糖尿病肾病、糖尿病心脏疾病中均出现异常表达[5-6]。Daniel等[7]报道,miR-221和miR-222在糖尿病小鼠血管平滑肌细胞中的表达上调,促进糖尿病小鼠的血管内膜增厚,而抑制上调的miR-221和miR-222可有效预防糖尿病心血管疾病,其可能与细胞外信号应答激酶-1/2(ERK-1/2)和p27Kip1有关。Liu等[8]在研究中报道,miR-221在糖尿病视网膜病变患者血清中的表达水平明显的上调,并与患者的总体存活率具有显著的相关性,更重要的是,miR-221的诊断效率明显的高于Ang Ⅱ、VEGF,揭示血清miR-221作为潜在的生物标志物不仅与T2DM患者DR的发生有关,而且与DR的进展有关。遗憾的是,没有继续进行miR-221在糖尿病视网膜病变的体外研究。本研究用高糖诱导了HRCECs建立糖尿病视网膜病变的体外研究细胞模型,检测了其中miR-221的表达水平发现,miR-221高表达,这与Liu等[8]在患者血清中的检测结果相呼应;进一步研究,通过流式细胞术检测过表达miR-221在高糖诱导的HRCECs细胞中的作用发现,过表达miR-221后,高糖诱导的HRCECs细胞的凋亡率上调更严重,并上调p53、下调MDM2, 抑制miR-221则起相反的作用抑制凋亡作用,这说明miR-221在高糖诱导的HRCECs凋亡中具有促进作用,提示miR-221具有促进糖尿病视网膜病变的恶性进展的作用,推测可能与p53/MDM2通路相关,为糖尿病视网膜病变的诊断和治疗提供新的靶点。
p53为一种可诱导细胞凋亡核磷酸蛋白,其在糖尿病大鼠的视网膜毛细血管内大量积累[9-10]。MDM2是一种负向调节p53的下游因子,其可通过与p53结合引起其泛素化降解,从而抑制p53引起的凋亡级联反应[11-13]。有研究报道,MDM2过度表达时,可抑制p53的功能[14]。郭承伟等[15]在研究中发现,在糖尿病视神经病变大鼠模型中,p53的表达明显升高,MDM2的表达明显降低,大黄虫丸治疗后,p53、MDM2的表达得到平衡,可见,p53/MDM2通路在糖尿病视神经病变中的关键作用。本研究检测了高糖诱导了HRCECs细胞中p53、MDM2的表达发现,p53的表达升高,MDM2的表达降低,二者呈明显的负相关,这与前人的实验结果均相一致;进一步研究发现,p53、MDM2的表达水平受miR-221的调控,这为p53/MDM2信号通路的调控机制研究提供参考依据;深入研究发现,过表达MDM2可逆转抑制miR-221的抗高糖诱导的HRCECs细胞凋亡,这说明不仅miR-221可调控p53/MDM2信号通路,相反,MDM2也可反向调控miR-221在高糖诱导的HRCECs细胞的功能。
综上所述,miR-221可促进高糖诱导的人视网膜血管内皮细胞凋亡,其作用机制与调控p53/MDM2信号通路调控有关,为糖尿病视网膜病变的治疗提供新靶点。

