阿魏酸对熏马肠发酵过程中组胺及产组胺微生物的影响
赵利利, 薛林林, 李彬彬, 蒋艾廷, 卢士玲
(石河子大学 食品学院,新疆 石河子832003)
熏马肠是新疆哈萨克民族特色的传统肉类制品,深受大众喜爱。 据相关资料报道,新疆伊犁地区哈萨克族群众食管癌的发病率是全国平均水平的2.3 倍, 其中熏马肠中生物胺含量过高可能是引起食管癌的一个重要原因[1]。 组胺是毒性较强的一种生物胺,正常条件下,食品中外源性摄入的组胺在组胺氧化酶的作用下会被迅速降解,但每当降解过程受到干扰,或者组胺量过高,食物中存在的组胺可导致组胺中毒或不耐受的情况[2]。 中毒症状通常表现为头痛、心跳呼吸加快、血压下降等[3]。 组胺是游离组氨酸在微生物的组氨酸脱羧酶作用下,发生脱羧反应产生的[4]。 许多因素可能会影响熏马肠中组胺的产生,如食品的理化特性(即pH 值和AW)、原料质量、生产过程、产组胺微生物的存在以及游离组氨酸的可用性[2]。 在香肠的生产、贮藏和销售过程中均会有组胺的积累[5-6]。
目前许多研究指出,天然植物提取物对组胺具有较好的抑制效果[7]。 在肉制品中,多酚类化合物已被证明对组胺的形成有很好的抑制作用[6,8]。 阿魏酸是酚类化合物的一种,存在于水果、粮食、蔬菜、中药中,其中,谷物麸皮中含量最高[9-10],据报道,它具有多种生理功能,对多种疾病,包括癌症、糖尿病、心血管和神经性疾病都有广泛的治疗作用[11]。 随着世界范围内非传染性慢性疾病患病率的增加,既能够改善食品品质,又具有特殊功能的天然食品添加剂将具有更加广阔的发展和应用前景[12]。 阿魏酸在日本被正式批准为食品添加剂, 可以加入饼干、熟食,主要用作食品抗氧化剂提高食品质量。 魏延玲在阿魏酸对风干鲈鱼中N-亚硝胺及生物胺的抑制作用的研究中发现阿魏酸对组胺有很好的抑制作用,使用阿魏酸能显著抑制风干鲈鱼加工及贮藏过程中微生物的生长(P<0.05)[13]。 而关于阿魏酸能否抑制熏马肠中组胺和产组胺微生物的研究还未见报道。 此外, 传统的变性梯度凝胶电泳 (PCRDGGE) 方法通常用于检测整个体系中微生物的动态变化, 而不能区分产组胺和不产组胺的微生物。本研究用带GC 夹的产组胺微生物特异性引物结合PCR-DGGE 检测方法,监测阿魏酸对熏马肠发酵过程中产组胺微生物的影响作用,为一些复杂的发酵食品(如奶酪)中产组胺微生物的鉴定提供一种快速简便的方法。
作者以新鲜马肉为原料,参考张雅晴[14]熏马肠加工工艺,并通过添加不同质量浓度阿魏酸,探讨阿魏酸添加量(质量分数)对组胺质量分数、游离组氨酸质量分数、微生物数、产组胺微生物等方面的影响,旨在利用阿魏酸对熏马肠中组胺的作用效果进行研究,为将阿魏酸应用于熏马肠及其他发酵香肠提供一定的理论依据。
1 材料与方法
1.1 材料
1.1.1 材料与试剂阿魏酸 (纯度98%)、 组氨酸(纯度99%):北京博奥拓科技有限公司产品;甲醇、乙腈(均为色谱纯):赛默飞世尔科技(中国)有限公司产品;组胺(纯度97%)、丹磺酰氯(纯度99%):美国Sigma 公司产品;MRS、MSA、VRBGA 和假单胞菌属选择性培养基: 北京奥博星生物试剂公司产品;三乙胺:石家庄世纪隆鑫商贸有限公司产品;异硫氰酸苯酯(纯度99%):上海泽崇医药科技有限公司产品;马肉:购自伊犁牧民家庭;动物肠衣、烟熏液:市售。
1.1.2 仪器与设备LDZX-40 立式压力蒸汽灭菌锅:上海申安医疗器械厂制造;LC-2010AHT 高效液相色谱仪: 日本岛津公司产品; 色谱柱(Ecilpse XDB-C184.6 mm×250 mm,5 μm): 上海泰坦科技股份有限公司产品;ZXRD-7080 全自动新型鼓风干燥箱:上海一恒科技有限公司产品;ZHWY-1111 落地普通型大容量恒温培养振荡器:上海智城分析仪器制造有限公司产品;循环水式多用真空泵:郑州长城科工贸有限公司产品;DNP-9272 恒温培养箱:上海精宏有限公司产品;KQ-250B 型超声波清洗器: 江苏同君仪器科技有限公司产品;EPED-20TJ实验室超纯水器:南京易普易达科技发展有限公司产品;UB-7pH 计: 美国赛多利斯丹佛公司产品;PCR 仪: 美国BIO-RAD 公司产品;DGGE 仪: 美国BIO-RAD 公司产品;水平电泳仪:北京市六一仪器厂制造;凝胶成像仪:美国BIO-RAD 公司产品。
1.2 方法
1.2.1 新疆熏马肠的制作工艺
1) 工艺配方 (质量分数) 瘦肉80%, 肥肉20%,白糖2%,食盐2.5%,姜粉0.2%,胡椒粉0.1%,八角0.1%,花椒粉0.15%,味精0.1%,五香粉0.1%,亚硝酸钠0.01%,烟熏液1%。
2) 加工工艺 原料肉处理 (紫外灯照射30 min)→修整、切丁(切小拇指上指尖大小)→配料→腌制 (4 ℃,1 d)→接种→灌肠→发酵 (18 ℃,RH90%~95%,2 d)→成熟(12 ℃,RH70%~75%,25 d)→成品。 分别在第0、3、7、14、28 天取样,对微生物数量、水分含量、pH 测定,置于-20 ℃冷冻保藏,以备组胺和组氨酸的测定。
1.2.2 试验设计将腌制好的原料肉均匀地分为4组, 分别做如下处理: 第I 组添加0 mg/kg 的阿魏酸;第II 组添加100 mg/kg 的阿魏酸;第III 组添加300 mg/kg 的阿魏酸;第Ⅳ组添加500 mg/kg 的阿魏酸。
1.2.3 微生物计数取20 g 香肠, 加入到180 mL无菌生理盐水中,在200 r/min 室温下摇1 h。 混合液稀释后于对应固体培养基进行均匀涂布。 乳酸菌用MRS 培养基,在37 ℃条件下培养72 h;葡萄球菌/微球菌用MSA 培养基,37 ℃培养48 h; 肠细菌用VRBGA 培养基,30 ℃培养48 h。 假单胞菌属用假单胞菌属选择性培养基,25 ℃培养48 h。
1.2.4 样品pH 值测定无菌条件下称取样品20 g于180 mL 灭菌生理盐水中,在200 r/min 室温下摇1 h,用pH 计进行上部清液pH 值测定。
1.2.5 水分含量测定准确称取样品2 g 于平板中,于105 ℃干燥箱中烘干至质量恒定,取出置于干燥皿中冷却,计算出水分含量。
1.2.6 细菌DNA 组的提取无菌条件下取样品20 g 于180 mL 灭菌生理盐水, 使用物料拍打机拍打20 min, 取上清液5 mL 在4 ℃条件下2500 r/min离心5 min,去沉淀,取上清液于干净离心管中4 ℃条件下10000 r/min 离心20 min,弃去上清液,用灭菌的移液枪将沉淀转移至1.5 mL 离心管中,然后根据细菌DNA 提取试剂盒操作步骤提取总DNA,提取的DNA 中加入150 μLTE 缓冲液,于-20 ℃保存备用。
1.2.7 PCR-DGGE
1)PCR 对所分离菌的16S rDNA 的V6-V8 区段进行PCR 扩增, 选用引物对为: 上游引物:ChdcDG-F (5′-CGCCCGCCGCGCGCGGCGGGCGGG GCGGGGGCACGGGGGCCTGGTCAAGGCTATGGTG TATGGTC -3′ ) 下 游 引 物:hdcDG -R (5′ -GGTTTCATCATTGCGTGTGCAAA-3′)[15]。
PCR 反应为25 μL 体系:1 μL 模板DNA,上游引 物 和 下 游 引 物 各1.5 μL,2 × Taq PCR Master Mix12 μL,ddH2O 9 μL。
扩 增 程 序:94 ℃预 变 性5 min,35个 循 环(94 ℃,30 s;55 ℃,30 s;68 ℃,30 s), 最终68 ℃延伸10 min。用1.5 g/dL 琼脂糖凝胶电泳检测PCR 产物后,进行DGGE 分析。
2)变性梯度凝胶电泳(DGGE) 聚丙烯酰胺凝胶质量浓度为8 g/dL (丙烯酰胺∶甲叉双丙烯酰胺37.5 g∶l g)。 变性梯度从35%~55%,制好胶后点样,在0.5×TAE 缓冲液中, 先200 V 电压预跑15 min,然后在80 V 恒压下电泳14 h。 将DGGE 胶片在含0.5 μL/mL EB 的超纯水中摇床染色20 min。再用超纯水20 min 脱色3次后,用凝胶成像仪拍照。 在紫外灯照射下用灭菌的刀片切割所需的明亮条带,放入无菌的1.5 mL 离心管中, 加入20 μL TE 溶液淹没切割下的条带,4 ℃冰箱过夜后, 再次进行PCR扩增 (上游引物为U968:5′-AACGCGAAGAACCT TAC-3′; 下游引物为L1401:5′-CGGTGTGTACAA GACCC-3′),反应体系同1.2.7.1,扩增程序:95 ℃预变性10 min,35个循环(95 ℃,30 s;56 ℃,30 s;72℃,30 s),最终72 ℃延伸10 min。 PCR 产物送去华大测序。 将测序结果与NCBI 数据库中序列进行比对,对菌株进行鉴定,结果见表2。
1.2.8 HPLC 测定熏马肠中组胺和游离组氨酸的含量
1) 组胺含量的测定 准确称取组胺50 mg,用0.4 mol/L 的高氯酸溶液定容到50 mL 容量瓶中,稀释至最终质量浓度为:10、50、100、150、200 μg/mL组胺标准液。 参考张雅晴[14]的方法来测定熏马肠中的组胺。
2)游离组氨酸含量的测定[16]精密称取组氨酸对照品20 mg,用0.1 mol/L 的盐酸定容至10 mL 容量瓶中, 稀释成一定质量分数的组氨酸标准溶液。取1 mL 的组氨酸标准液, 加入500 μL 0.1 moL/L异硫氰酸苯酯-乙腈溶液(移取异硫氰酸苯酯1.2 mL用乙腈容至100 mL 容量瓶中) 和500 μL 1 moL/L三乙胺-乙腈溶液(移取三乙胺13.5 mL 用乙腈定容至100 mL 容量瓶中),摇匀静置1 h,加入2 mL 正乙烷萃取,吸取下层溶液过膜,上机分析。
取2 g 熏马肠样品加入,30 mL 的0.1 mol/L 的盐酸,超声提取(40 kHz)45 min,放冷离心,收集上清液待用。 取上述处理液1 mL,此后衍生处理方法同上。色谱柱为Agilent C18(4.6 mm×250 mm),流量1 mL/min,流动相A:醋酸钠7.5 g,加超纯水850 mL溶解,用乙酸调pH 6.5,加水至925 mL 加乙腈70 mL,摇匀。 流动相B:体积分数80%乙腈水。 用0.22 μm 滤膜过滤超声30 min 后备用,紫外检测波长为254 nm,进样体积20 μL,柱温31 ℃,梯度洗脱:0~18 min,A(100%~91%);18.01~50 min,A(80%~67%);50.01~60 min,A(0%)。
1.2.9 数据分析全部试验数据采用Microsoft Excel 2010 统计,Origin 8.5 绘图,SPSS 22 进行差异性分析。
2 结果与分析
2.1 理化指标的分析
2.1.1 水分质量分数由表1 可知,熏马肠发酵过程中水分质量分数呈下降趋势,在发酵成熟过程中由于较高的发酵温度及较低的相对湿度使得水分质量分数下降显著(P<0.05),到发酵成熟结束时对照组样品中水分质量分数为37.73%,相比发酵初期0 d(75.13%)下降了49.78%。 不同添加量的阿魏酸处理组与对照组相比水分质量分数变化的差异不显著(P>0.05),说明阿魏酸对熏马肠的水分质量分数无影响。 这与杨蓉蓉等[17]在八角茴香提取物对风干鲈鱼加工贮藏过程中水分质量分数的实验结果较为相似。
2.1.2 pH 值由表1 可知,熏马肠发酵过程中pH值呈先下降后上升的趋势。 添加阿魏酸组熏马肠中的pH 值要低于未添加阿魏酸组(P>0.05),主要是由于阿魏酸本身的酸性,在熏马肠的整个发酵成熟过程中pH 始终保持在酸性范围(<5.32)。 4 组熏马肠在发酵初期(0~7 d),pH 值迅速下降,主要是由于加工过程中碳水化合物水解作用产生的乳酸、磷酸等其他有机酸的积累,酶促水解作用产生的游离氨基酸的累积[18],使pH 值显著下降(P<0.05)。 发酵后期(14~28 d),pH 值开始回升,主要原因是在成熟过程中,微生物生长代谢产生大量的含氮化合物等碱性缓冲物质如组胺的积累,以及蛋白质代谢产物的释放。 在发酵结束后, 各组样品的pH 值都处于5.14~5.26 之间,这与Lu 等[19]在研究熏马肠发酵过程中pH 值的实验结果一致。 而pH 值为5 左右的酸性条件有利于维持发酵香肠货架期的稳定性,各组终产品中的结果都符合香肠的这个要求。
2.2 微生物分布的分析
2.2.1 乳酸菌分析由表1 可知,随着熏马肠发酵过程的进行,各组乳酸菌数量均先上升后下降的趋势。 添加阿魏酸后各组的乳酸菌数量与对照组相比较低(P>0.05)。 4个不同处理组的样品中乳酸菌数量(lg(CFU/g))在第7 天时达到最大值8.15~8.29,可能与发酵后期较高的pH 值有关。 发酵结束 (第28 天)时,对照组乳酸菌总数(lg(CFU/g))为7.61±0.03,添加阿魏酸500 mg/kg 组乳酸菌总数(lg(CFU/g))为7.43±0.04,相对于对照组降低了2.37%。 杨蓉蓉等[17]研究了0、50、100、150、200 mg/kg 的八角茴香提取物对风干鲈鱼加工及贮藏过程中微生物的抑制效应,结果显示,风干结束时,添加500 mg/kg 八角茴香提取物处理组样品中乳酸菌总数相对于对照组降低了6.88%,相对于八角茴香提取物,阿魏酸对乳酸菌的抑菌作用要弱。 乳酸菌是熏马肠中的优势菌,主要是由于原料肉中乳酸菌数量较多以及它们在发酵过程中较快的繁殖速度。 发酵后期4 组样品中乳酸菌数量(lg(CFU/g))在7.43~7.61 范围之间。 与国际上建议的乳酸菌在食品中的数量(lg(CFU/g))范围6~8 相符[20],说明产品安全性较高。
2.2.2 微球菌/葡萄球菌分析4 组熏马肠中微球菌/葡萄球菌数量与乳酸菌数量的变化趋势一致(表1),都是先上升后下降。发酵28 d 时,各组样品中的微球菌/葡萄球菌数量(lg(CFU/g))在6.34~6.93 之间,与一些学者报道的熏马肠中微球菌数量相近[17]。使用阿魏酸能显著抑制熏马肠终产品中微球菌/葡萄球菌的生长(P<0.05),发酵后期3 组添加阿魏酸组的熏马肠中微球菌/葡萄球菌数量相对于空白对照组分别降低了3.17%、5.92%、8.51%。 吕珍等在阿魏酸对酒类酒球菌生长作用机理的研究中也发现:50 mg/L 阿魏酸能够强烈抑制酒类酒球菌的生长,并且随阿魏酸含量的增加抑制作用逐渐增强[21]。 何粉霞在阿魏酸和阿魏酸葡萄糖酯的生物活性研究中也发现阿魏酸对枯草杆菌、金黄色葡萄球菌和酵母菌均有一定的抑制效果[22]。
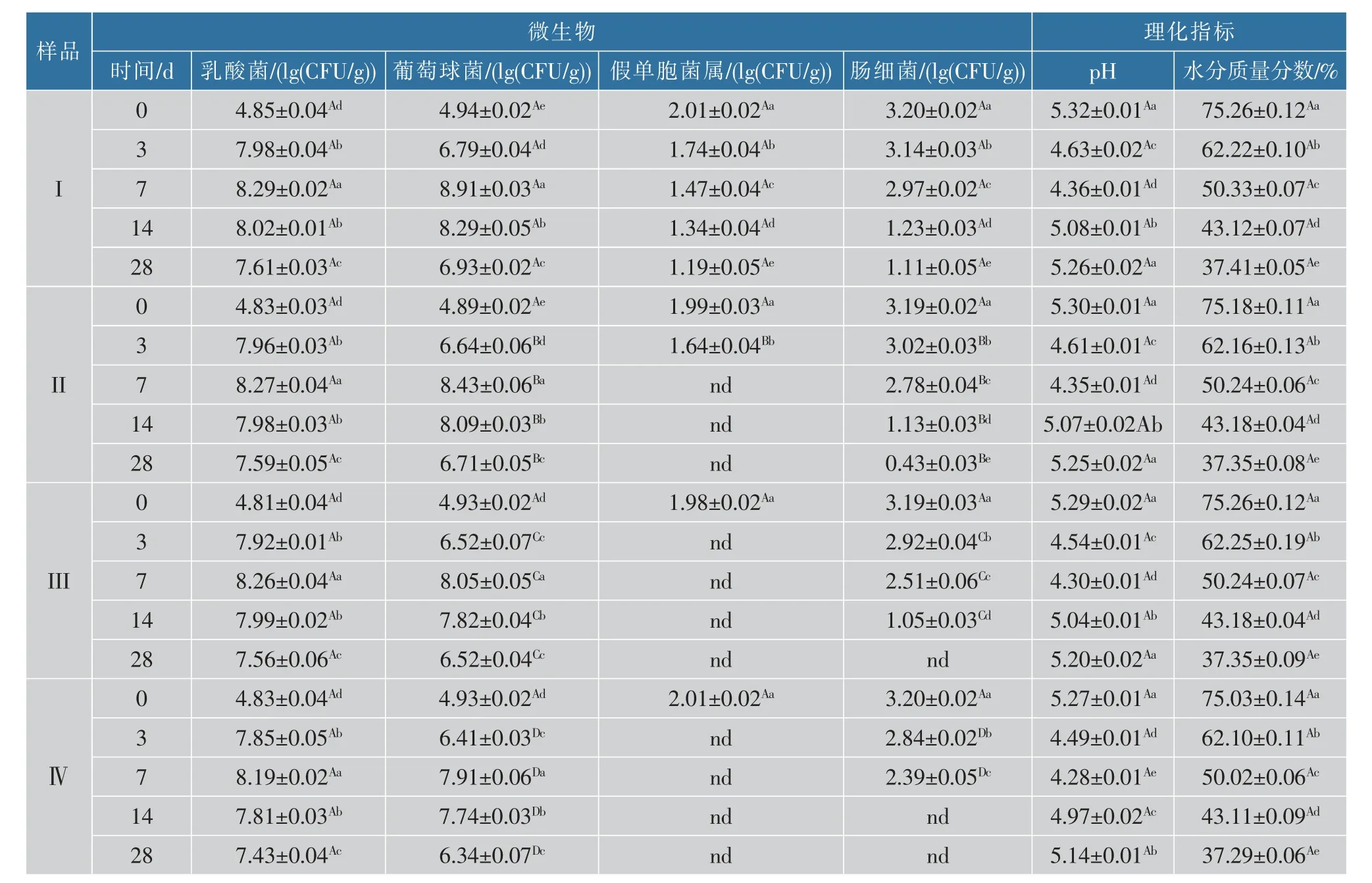
表1 阿魏酸对新疆熏马肠成熟过程中微生物和理化指标的影响Table 1 Microbial counts (lg(CFU/g)) and physicochemical parameters during ripening of smoked horsemeat sausage after adding different concentrations of ferulic acid
2.2.3 肠细菌和假单胞菌属分析由表1 可知,在发酵初期(0 d),肠细菌和假单胞菌属的数量(lg(CFU/g))分别在3.20 和2.01 左右,与Lu 等[19]在熏马肠中的研究结果相似。 在整个发酵过程中,各组肠细菌数量均呈下降的趋势(P<0.05)。 添加阿魏酸后Ⅱ、Ⅲ、Ⅳ组肠细菌数量显著低于对照组中肠细菌数量(P<0.05)。 成熟第28 天时, 添加阿魏酸300 mg/kg 和500 mg/kg 组熏马肠样品中均未检测到肠细菌,另外在添加阿魏酸后,各组在发酵成熟期也都没有检测到假单胞菌属。 Lu 等[19]在发酵剂和植物提取物对熏马肠中生物胺的研究中指出,添加植物提取物后,在发酵后期均没有检测到肠细菌和假单胞菌属。 说明阿魏酸和植物提取物对肠细菌和假单胞菌属的生长都具有显著的抑制效果(P<0.05)。王永丽等[23]在辣素对培根风干成熟过程中微生物的抑制效应中发现, 添加500 mg/kg 姜辣素处理组的肠细菌数量相对于空白对照组降低了19.44%,这说明阿魏酸对肠细菌的抑菌作用比姜辣素强。 肠细菌和假单胞菌属是一类在发酵香肠中不受欢迎的菌种,很可能导致致病性危害以及对发酵香肠的感官品质造成影响,尤其是一些大肠杆菌可以产生大量组胺。 实验结果表明,阿魏酸能有效地抑制肠细菌和假单胞菌属的生长,从而抑制组胺在熏马肠发酵成熟过程中的积累。
2.3 DGGE 的分析
如图1 DGGE 电泳图所示,熏马肠发酵过程中主要的产组胺微生物是Lactobacillus sakei,Enterobacter cloacae和Bacillus cereus(见 表2)。Maria Diaz 等[15]在使用PCR-DGGE 方法鉴定奶酪中产组胺菌的研究中得到Lactobacillus sakei是奶酪中的产组胺菌。Enterobacter cloacae和Bacillus cereus在很多文献里也曾被报道是潜在的产组胺微生物[24-25]。 发酵前期,添加阿魏酸组与未添加阿魏酸组中存在的产组胺微生物相似。 在熏马肠成熟的第7 天时, 添加阿魏酸500 mg/kg 组熏马肠样品中没有检测到这些产组胺微生物,成熟第28 天时,添加阿魏酸300 mg/kg 和500 mg/kg 组熏马肠样品中均未检测到这些产组胺微生物,这与微生物的统计结果基本一致。 说明阿魏酸对这些产组胺微生物有很好的抑制作用。
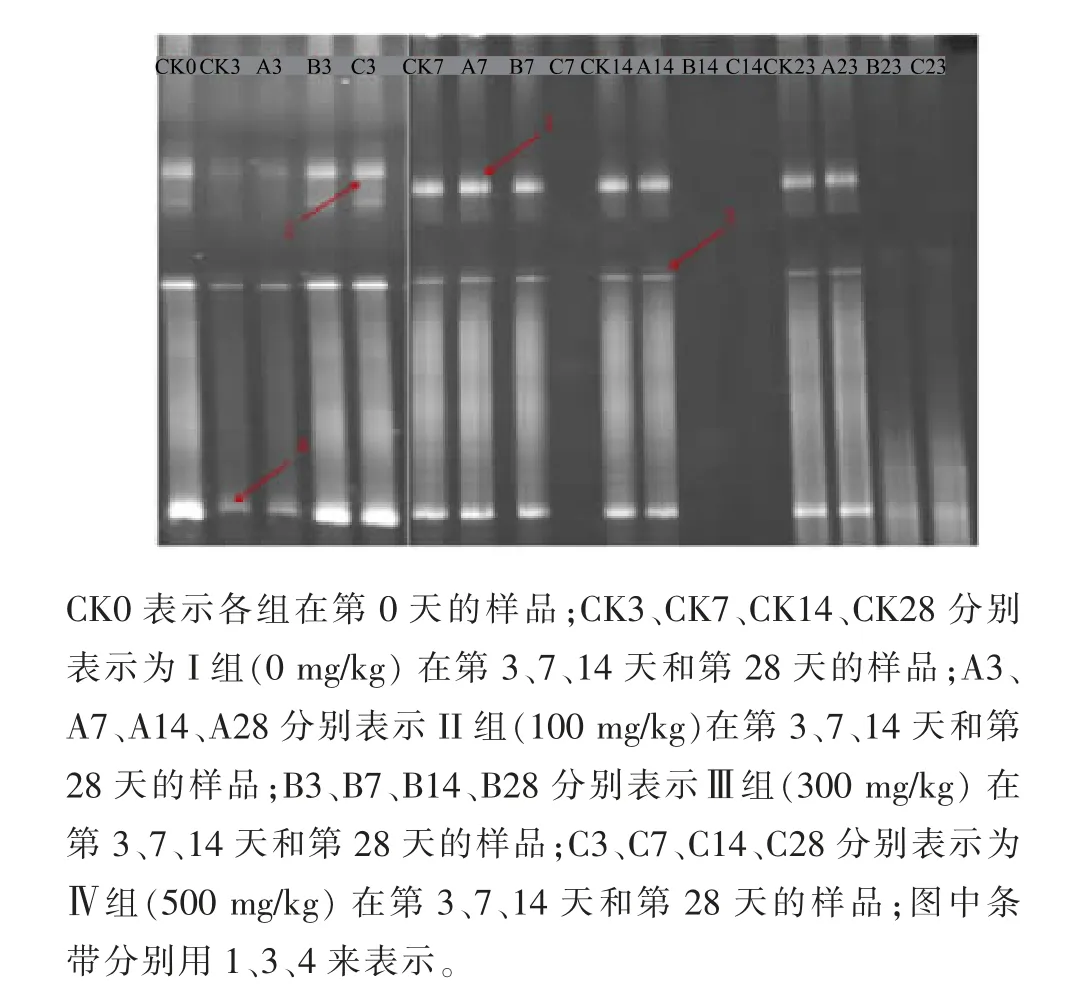
图1 阿魏酸对新疆熏马肠成熟过程中产组胺菌的PCRDGGE 图谱Fig. 1 DGGE fingerprinting of PCR products of Xinjiang smoked horsemeat sausage during ripening by addition of ferulic acid at different concentrations
2.4 熏马肠中的游离组氨酸和组胺的分析
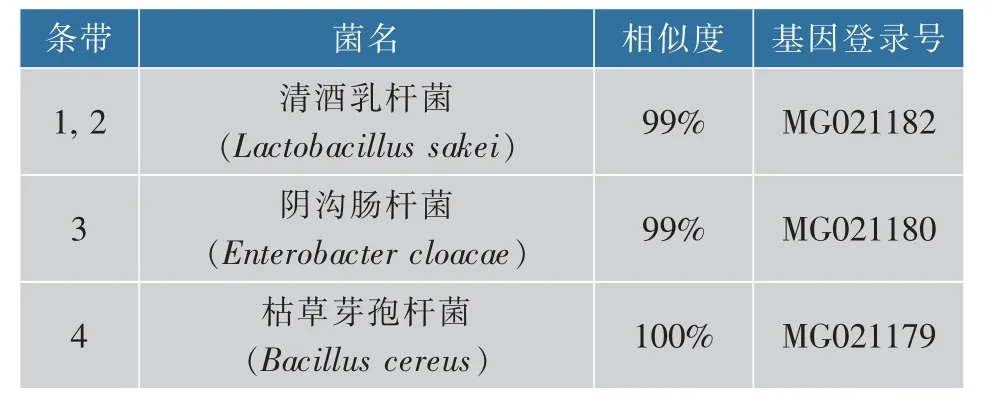
表2 熏马肠成熟过程中产组胺菌PCR-DGGE 图谱上条带序列分析Table 2 DNA sequencing results of histamine-producing bacterias found in smoked horsemeat sausage samples based on the cut bands from the DGGE gels
2.4.1 游离组氨酸阿魏酸对熏马肠发酵过程中的游离组氨酸影响情况如图2 所示。 随着发酵过程的进行,各组游离组氨酸均呈上升趋势,Zhang 等[26]在鲤鱼香肠的发酵成熟过程中也发现游离组氨酸的这种变化趋势。 添加阿魏酸Ⅱ、Ⅲ、Ⅳ组游离组氨酸与未加阿魏酸组中的组氨酸质量分数没有明显差异(P>0.05),说明阿魏酸对熏马肠发酵过程中游离组氨酸的释放不起作用。发酵成熟期(28 d),各组熏马肠中的游离组氨酸质量分数为1.89 mg/kg 左右,与Domínguez 等[27]在干腌小马驹香肠中的研究结果相似。 熏马肠发酵过程中组氨酸量的变化是一个动态过程:一方面,蛋白酶不断水解蛋白质生成组氨酸,组氨酸量增加;另一方面,微生物生长消耗部分组氨酸产生组胺。 但是本实验中组胺的生成与游离组氨酸的减少之间不成正比关系,这与Nie 等[28]在鲤鱼香肠中的研究结果相似。
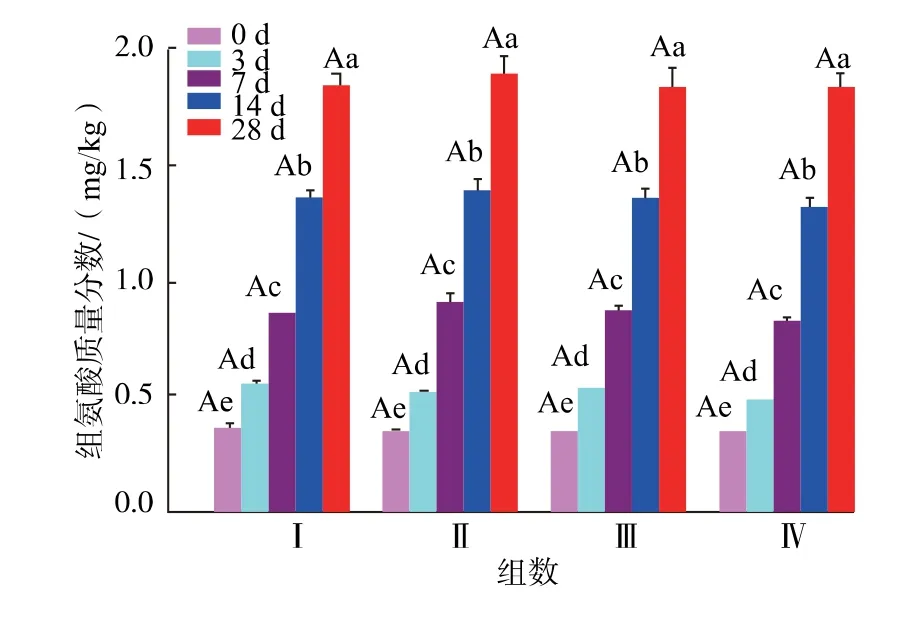
图2 阿魏酸对新疆熏马肠成熟过程中游离组氨酸的影响Fig. 2 Changes of free histidine contents in Xinjiang smoked horsemeat sausage during ripening affected by addition of ferulic acid at different concentrations
2.4.2 组胺由图3可知,熏马肠发酵过程组胺质量分数呈先上升后下降的趋势,Lu 等[19]在熏马肠中也发现组胺质量分数的这种变化趋势。 发酵初期(0 d) 时,4 组熏马肠中的组胺质量分数都很少,说明选择的原料肉安全性很高。 在发酵第7 天时,对照组的组胺质量分数达到111.12 mg/kg, 超出了Nout 等[29]指出香肠制品中组胺的允许水平100 mg/kg。 在发酵后期(第28 天),300 mg/kg 添加量时组胺质量分数为30.71 mg/kg,相对于对照组降低了43.26%,为组胺质量分数最低的一组。 李彬彬等[14]也在熏马肠中添加250 mg/kg 的大蒜精油,发现在发酵后期, 组胺量较空白对照组降低了66.64%,张惠超等[30]在熏马肠中接种生物胺氧化酶菌作为发酵剂,发现生物胺氧化酶菌具有较好的氧化组胺能力,其中以腐生葡萄球菌最为显著,与对照组相比降低了49.28%。虽然阿魏酸对组胺量的减少低于大蒜精油和生物胺氧化酶,但是阿魏酸作为天然植物提取物,对癌症、糖尿病、心血管和神经性疾病等都具有广泛的治疗作用,在发酵香肠中具有很好的应用前景。 100 mg/kg 阿魏酸降低组胺质量分数的作用均不如300 mg/kg 与500 mg/kg 明显,300 mg/kg 与500 mg/kg 的组间差异不显著(P>0.05)。所以质量分数为300 mg/kg 的添加量更适合应用于熏马肠的生产。 4 组熏马肠终产品中组胺质量分数都远远低于FDA 限量标准,大量研究也曾得到组胺质量分数在其他类发酵香肠中较低,但是熏马肠中的组胺仍是大家值得关注的问题,因为腐胺和尸胺在一定条件下能够增强组胺的毒性[31]。 添加阿魏酸后,熏马肠中产组胺微生物的生长受到抑制(图1),所以组胺量明显降低(P<0.05)。
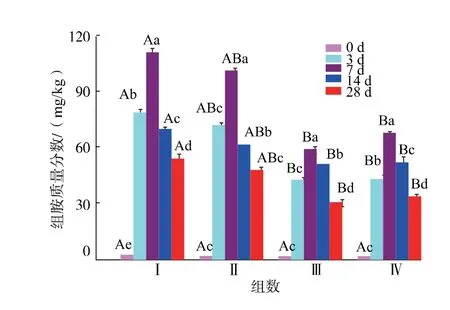
图3 阿魏酸对新疆熏马肠成熟过程中组胺的影响Fig. 3 Changes of histamine contents in Xinjiang smoked horsemeat sausage during ripening affected by addition of ferulic acid at different concentrations
3 结 语
阿魏酸对熏马肠发酵过程中的水分含量、pH值以及游离组氨酸的变化无显著差异(P>0.05)。 阿魏酸能显著(P<0.05)抑制肠细菌、微球菌/葡萄球菌以及假单胞菌属的生长繁殖,对乳酸菌的抑制作用不显著(P>0.05)。 通过PCR-DGGE 分析得到,阿魏酸能够很好地抑制产组胺微生物(Lactobacillus sakei,Enterobacter cloacae 和Bacillus cereus) 的生长,对控制组胺在熏马肠中的含量起到非常显著的作用。 300 mg/kg 的阿魏酸处理组对于组胺抑制效果最好, 为30.71 mg/kg, 相对于对照组降低了43.26%,500 mg/kg次之。 所以300 mg/kg 的添加量适合应用于熏马肠的生产。

