变形假单胞菌吡咯喹啉醌合成基因簇的克隆与分析
王大明, 孙 雷, 孙文敬, 崔凤杰, 龚劲松,张晓梅, 史劲松, 许正宏*
(1. 江南大学 工业生物技术教育部重点实验室, 江苏 无锡214122;2. 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡214122;3. 江苏大学 食品与生物工程学院,江苏 镇江212013;4. 百勤异VC 钠有限公司,江西 德兴334221)
2-酮基-D-葡萄糖酸(2KGA)在合成杂环化合物、用于立体选择性化学反应等方面具有重要应用价值[1],已经被成功地应用于生产食品抗氧化剂D-异抗坏血酸及其衍生物[2-4]。 目前,发酵法是最经济、高效且环保的2KGA 工业生产方法[5]。 在国际上,具有较高效率和稳定转化性能的假单胞菌通常用于2KGA 的工业生产[2,6]。变形假单胞菌(Pseudomonasplecoglossicida) JUIM01 是一株工业化生产2KGA的经典菌株, 其糖酸转化率可达理论产率的90%,但其生产强度依然不能满足节能降耗的要求[7]。
假单胞菌的2KGA 合成途径即发生在细胞周质空间中的葡萄糖胞外直接氧化途径,该途径首先需通过吡咯喹啉醌(PQQ)依赖性葡萄糖脱氢酶将葡萄糖转化为葡萄糖酸,随后借助黄素腺嘌呤二核苷酸依赖性葡萄糖酸脱氢酶将葡萄糖酸转化为2KGA[6]。在这个代谢过程中,葡萄糖脱氢酶是2KGA代谢合成的限速因素[8]。 前期有文献研究表明,恶臭假单胞菌(P. putida) KT2440 中较低的辅酶PQQ 合成水平,成为提高葡萄糖脱氢酶活性的限制因素之一[9];Gao 等在研究提高2-酮基-L-葡萄糖酸产量时也发现,PQQ 合成水平是PQQ 依赖性脱氢酶活性的限制因素, 而引入PQQ 合成基因可提高20%的产物浓度[10-11]。 故推测,通过提高2KGA 工业生产菌株变形假单胞菌JUIM01 的自身PQQ 合成水平,有望进一步提高2KGA 的生产强度。
PQQ 作为氧化还原酶的一种辅酶,在革兰氏G-菌中存在较为广泛[12]。有研究表明,PQQ 来源于短肽PqqA 内部保守的谷氨酸和酪氨酸, 由这2个氨基酸侧链交联构成[13]。 PQQ 代谢合成的详细机制截至目前尚未解析清楚,但可初步推测该代谢过程是由5 到6个酶促反应所构成。 其实在早期研究中已有学者推测:首先充当PQQ 代谢合成的前体,PqqA 在体内实现成功表达, 进而通过PqqE 识别; 随后在PqqE 的辅助作用下,PqqA 会介导谷氨酸Glu 与酪氨酸Tyr 2 种氨基酸之间碳碳键的产生, 而这一反应过程则可由PqqF 所识别,同时PQQ 骨架还会被从PqqA 短肽上切割下来;最后,该代谢过程还会继续借助PqqC 环化及氧化反应促使中间产物合成PQQ[14]。 这个合成途径共包括4 到7个以基因簇形式存在的基因(pqqABCDEFG)[14-15]。 一些细菌具有连续的pqq基因,如氧化葡萄糖酸杆菌即由5个基因所构成,组成一个完整的基因簇(pqqABCDE)[16];另外,据前期文献报道,还有一些其他不同来源细菌的pqq基因则包括2个基因簇,例如扭脱甲基杆菌中含有pqqABCDE和pqqFG共2个基因簇[17]。
截至目前,涉及PQQ 生物合成途径的编码基因已经在多种细菌中被鉴定获得, 除扭脱甲基杆菌(M. extorquens)[18]外, 还有醋酸钙不动杆菌(A.calcoaceticus)[19]、肺炎克雷伯氏菌(K. pneu-moniae)[13,20]、氧化葡萄糖酸杆菌(G. oxydans)[21-22]等多种不同细菌菌株;另外,假单胞菌属来源的菌株还包括荧光假单胞菌(P. fluorescens)[23-25]以及恶臭假单胞菌(P. putida)[9]等。 但总结已有文献来看,尚未见任何有关变形假单胞菌生物合成PQQ 的报道。
作者采用LA-PCR 技术克隆变形假单胞菌JUIM01 的PQQ 合成基因簇, 在此基础上明确其基因组成与生物学信息, 以期从分子水平深入探究PQQ 的生物合途径与胞内再生机制,在此基础上最终通过辅酶工程提高2KGA 的工业化生产强度。
1 材料与方法
1.1 实验材料
1.1.1 菌株和质粒本实验所采用的菌株及质粒如表1 所示。
表1 本实验所用菌株及质粒Table 1 Bacterial strains and vectors in this experiment
1.1.2 培养基固体活化培养基 (g/L): 蛋白胨10.0,牛肉膏3.0,NaCl 5.0,琼脂粉20.0;pH 7.2。
液体LB 培养基(g/L):胰蛋白胨10.0,酵母提取物5.0,NaCl 10.0;pH 7.0。
1.1.3 主要工具酶和试剂作者所采用的工具酶及分子生物学试剂包括Premix LA Taq 试剂及各种消化实验所用限制性内切酶, 均购自Takara Biomedical Technology(Beijing)公司;用于基因工程操作的各类分子生物学试剂盒则购自Sangon Biotech(Shanghai)公司。
1.2 实验方法
1.2.1 基因组DNA 的提取将活化好的JUIM01种子液接种到25 mL 的液体LB 培养基中,30 ℃振荡培养后,低温离心去除上清液,将菌体收集并用无菌水重悬洗涤2 遍, 用于后续基因组DNA 提取操作,该实验流程参考细菌基因组提取试剂盒操作指南进行。
1.2.2 PCR 引物的设计与合成作者所用的PCR简并引物基于假单胞菌来源的PQQ 合成基因簇序列及NCBI 数据库其他具有不同相似度且不同来源的假单胞菌序列,通过Primer 5.0 软件设计而成。引物序列如下所示:
P1:5′-GCGGTACANACGTNGCTCNACGNCG-3′;P2:5′-AATCTTNCTCACANGGANGTANCGC-3′
1.2.3 目的基因片段的扩增所述1.2.1 步骤所得基因组DNA 用作模板,PCR 反应体系为(50.0 μL):预混合使用Premix LA Taq 试剂25.0 μL, 引物P11.0 μL,引物P21.0 μL,基因组DNA 1.0 μL,ddH2O 22.0 μL。 扩增反应程序设置为:在98 ℃变性10 s;延伸步骤设置为66 ℃运行10 min, 循环运行35次;最终延伸设置在72 ℃条件下运行10 min。
扩增反应所得基因产物采用1 g/dL 电泳进行验证,同时,所需目的片段借助DNA 回收试剂盒进行回收,连接pMD19-T,导入E. coliDH5α 感受态;筛选阳性转化子。
1.2.4 生物信息学分析借助ORF Finder 软件分析基因簇中的开放阅读框; 使用DNAMAN 及BLAST 分别分析序列数据及序列同源性; 选择ProtParam 工具来分析目标序列的基本物理化学性质;选用PredictProtein 软件来判断蛋白质的二级结构;通过TMHMM 2.0 服务器研究该酶的跨膜结构;启动子情况则是通过BPROM 和BDGP 软件进行分析; 终止子是使用FindTerm 进行预测; 使用NCBI保守结构域检索软件对目标酶的氨基酸保守序列进行分析; 蛋白质的信号肽, 则使用SIGNALP 4.1分析[26]。
2 结果与分析
2.1 PQQ 合成基因簇的克隆与重组质粒的构建
作者特异性针对变形假单胞菌PQQ 合成途径设计引物P1 和P2,同时选择1.2.1 步骤所得基因组作为模板,通过PCR 扩增目的编码基因。 实验结果表明基因片段大小约为11.6 kb。 在此基础上,本实验进一步构建重组质粒pMD19-T-pqq,并进行限制酶消化。1 g/dL 琼脂糖凝胶电泳分析结果表明,重组质粒经单次消化后获得大小约14 kb 的单一条带,继续双酶切获得约11.6 kb 和2.7 kb 2个条带,具有预期的大小。 上述结果表明重组质粒pMD19-Tpqq已成功构建。
2.2 PQQ 合成基因簇的基因组成
将重组质粒 pMD19 -T-pqq送至 Sangon Biotech(Shanghai)进行测序、拼接,最终获得基因簇的完整序列。测序结果显示目的基因片段为11659 bp。 分析结果表明,该片段是由9个开放阅读框组成的PQQ 合成基因簇, 其中包括pqqF、pqqA、pqqB、pqqC、pqqD、pqqE、pqqM、pqqH, 以及位于反向互补链上的pqqI,这些基因相应的编码并合成目的 蛋 白 质 PqqF、PqqA、PqqB、PqqC、PqqD、PqqE、PqqM、PqqH、PqqI。 将作者所得来源于变形假单胞菌JUIM01 的PQQ 合成基因簇的核苷酸序列提交至Genbank 数据库,获得登录号为MH919393。
变形假单胞菌JUIM01 与荧光假单胞菌Pf0-1和B16[23]的PQQ 合成基因簇的基因组成类似(图1)。 同源性分析结果表明,JUIM01 与Pf0-1 等菌株的PqqF、PqqA、PqqB、PqqC、PqqD、PqqE、PqqM、PqqH、PqqI 氨基酸序列一致性分别为41%、92%、84%、94%、84%、88%、65%、81%、70%(表3)。

图1 变形假单胞菌JUIM01 与其他菌株PQQ 合成基因簇物理图谱的比较Fig. 1 Comparison of physical map of PQQ synthesis gene clusters from P. plecoglossicida JUIM01 with those from other strains
2.3 PQQ 合成基因簇的非编码序列分析
作者对变形假单胞菌JUIM01 的PQQ 基因簇的非编码区域进行启动子区和终止子区的在线分析,结果显示其中存在6 处启动子区(具有典型的-10 区和-35 区)、7 处终止子区(具有典型的反向重复序列)和6 处核糖体结合位点(RBS) (图2),这些预测结果将为进一步的实验验证以及将来的分子改造提供理论支撑。

图2 PQQ 合成基因簇的非编码区序列分析Fig. 2 Sequence analysis of non-coding regions of PQQ synthesis gene clusters
2.4 PQQ 合成基因簇中各基因的生物信息学分析
使用在线分析软件, 分析了变形假单胞菌JUIM01 的PQQ 合成基因簇中各不同基因的物理化学性质(表2),这9个基因所编码的相应蛋白质没有信号肽、没有跨膜结构域,均属于胞内蛋白质;各基因编码的Pqq 蛋白质的注释与同源比对结果见表3。各Pqq 蛋白质的保守序列分析结果具体如下:
保守序列分析结果表明,pqqF 编码的蛋白质属于PQQ 生物合成蛋白PqqF 家族, 该肽酶存在于PQQ 生物合成区域中, 并且被认为是作用于PQQ可能的前体肽PqqA 的蛋白酶, 其分子功能是能够结合锌离子,以及具有金属肽链内切酶活性[24]。同源超家族分析结果显示,第5~207 和617~756 位氨基酸属于 “Metalloenzyme,LuxS/M16 peptidase-like”;结构域分析结果显示, 第17~142 位氨基酸属于“Peptidase M16,N-terminal”。
pqqA编码的蛋白质属于PQQ 生物合成蛋白PqqA 家族,这个蛋白质在许多物种中均存在,其大小为<25个氨基酸, 可初步推断出pqqA 编码的蛋白质为辅酶PQQ 的肽前体,此外,PqqA 的保守基序“Glu-Xxx-Xxx-Xxx-Tyr”中的首尾2个氨基酸残基Glu 和Tyr 会成为最终产物PQQ 的一部分[27]。
pqqB编码的蛋白质属于PQQ 生物合成蛋白PqqB 家族,该基因是扭脱甲基杆菌(相当于pqqG)和肺炎克雷伯氏菌的PQQ 生物合成所必需的,但对于大肠杆菌PQQ 生物合成的异源表达、醋酸钙不动杆菌(相当于pqqV)来说不是必需的。 基于后一发现,表明PqqB 可能是一个转运蛋白或一个PQQ 依赖性酶[28],而不是用于PQQ 生物合成的酶[19]。 同源超家族分析结果显示, 第1~303 位氨基酸属于“Ribonuclease Z/Hydroxyacylglutathione hydrolase -like”;结构域分析结果显示,第50~270 位氨基酸属于“Metallo-beta-lactamase”,这些蛋白质每分子结合2个锌离子作为辅助因子;氨基酸残基注释结果显示, 含有9个推定的活性位点“88D、90Q、92D、93H、176H、177P、199G、220D”, 以及2个推定的金属结合位点“92D、220D”。
pqqC 编码的蛋白质属于PQQ 合成酶类和PQQ生物合成蛋白PqqC 家族,PqqC 是一种氧化酶,其反应涉及底物的一个环闭合和八电子氧化,以产生PQQ[29]。同源超家族分析结果显示,第4~251 位氨基酸 属 于“Haem oxygenase-like,multi-helical”,该 超家族具有一个多螺旋结构域, 组成3-螺旋基序的2个结构重复[20];结构域分析结果显示,第14~223 位氨基酸属于“Thiaminase-2/PQQC”。
pqqD编码的蛋白质属于PQQ 生物合成蛋白PqqD 家族, 它是参与辅酶PQQ 生物合成最后一步的蛋白质[30],其分子功能是与醌结合。
pqqE 编码的蛋白质属于PQQ 生物合成蛋白PqqE 家族。 同源超家族分析结果显示, 第13~289位氨基酸属于“Aldolase-type TIM barrel”,这种TIM桶通常覆盖整个蛋白质结构。 第11~214 位氨基酸具有“Radical SAM”结构域,以及第244~336 位氨基酸具有“4Fe4S-binding SPASM”结构域。 有证据表明, 该类蛋白质通过不寻常的Fe-S 中心来还原性裂解S:-腺苷甲硫氨酸(SAM)而产生自由基[31]。 尽管 PqqE 具有变体形式, 但该家族的“CxxCxxxxxCxxxC”基序几乎不变。
pqqM编码的蛋白PqqM 的第351~610 位氨基酸是属于α/β 水解酶家族,含有8 条通过螺旋连接的链;第403~609 位氨基酸具有肽酶S9、脯氨酰寡肽酶活性位点结构域;该蛋白质具有丝氨酸型肽酶活性,可进行蛋白质水解。
pqqH编码的蛋白PqqH 属于LysR 家族转录调控因子, 其中第1~91 位氨基酸属于翼状螺旋DNA结合蛋白家族,该家族的共同特征是具有一个翼状螺旋-转角-螺旋DNA 结合基序,其中“翅膀”或环状结构是小的β 折叠。 翼状螺旋基序由2个翼(W1、W2)、3个α 螺旋(H1、H2、H3)和3个β 折叠(S1、S2、S3)按H1-S1-H2-H3-S2-W1-S3-W2 顺序排列组成[32]。 DNA 识别螺旋使序列特异性DNA 与DNA 的主要沟槽接触,而“翅膀”通常是与DNA 的小沟槽或骨架接触。 一些翼状螺旋蛋白具有裸露的疏水残基片段,可介导蛋白质-蛋白质相互作用。 第91~293 位氨基酸具有底物结合结构域,并且类似于周质结合蛋白[33]。氨基酸残基注释结果显示,二聚界面 的 结 合 位 点 是107P、108Q、110L、111E、114R、118P、120L、121V、122V、123Q、124I、125Y、126E、218E、219A、220E、221M、222N、223N、229D、230S、232A、233H。
pqqI 编码的蛋白PqqI 属于氨基转移酶类型III家族,该氨基转移酶与其他磷酸吡哆醛依赖性酶具有某些相同的机制特征,例如磷酸吡哆醛基团与赖氨酸残基进行共价结合。 氨基酸残基注释结果显示, 抑制剂-辅因子结合口袋位点为129S、130G、131A、162C、163H、165R、213E、246D、248V、249Q、275K; 吡哆醛5'-磷酸结合位点为130G、131A、162C、163H、213E、246D、249Q、275K; 催化残基位点为275K。

表2 变形假单胞菌JUIM01 的PQQ 合成基因簇中各基因的基本理化性质分析Table 2 Analysis of basic physical and chemical properties of genes in PQQ synthesis gene clusters of P. plecoglossicida JUIM01
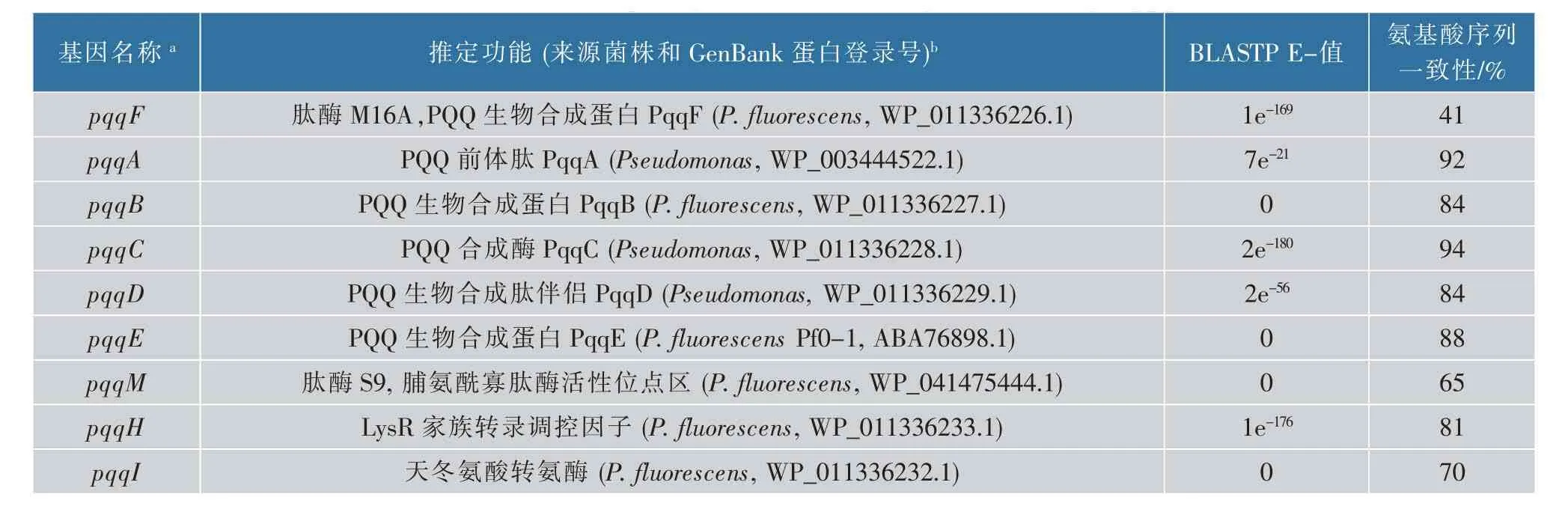
表3 变形假单胞菌JUIM01 的Pqq 蛋白编码基因的注释Table 3 Annotation of P. plecoglossicida JUIM01 genes encoding Pqq proteins
3 结 语
本研究中通过生物信息学手段对数据库中不同来源假单胞菌的PQQ 生物合成基因簇进行分析,进一步设计引物,并采用LA-PCR 技术,首次克隆到了含有2KGA 工业生产菌株变形假单胞菌JUIM01 的PQQ 合成操纵子完整序列的基因簇,该11659 bp 基因片段含有9个开放阅读框pqqFABCDEMHI,编码PQQ 生物合成的前体短肽PqqA 和合成途径的相关酶。 基因编码区和非编码区的生物信息学分析为2KGA 工业生产菌株变形假单胞菌JUIM01 的PQQ 生物合成途径和胞内再生机制的研究奠定了基础,进而为通过提高该菌株的自身PQQ 合成水平,来进一步提高2KGA 的生产强度提供理论支撑。

