用于牛肉掺杂肉成分检测的荧光PCR方法研究
杨军辉




摘 要:目的:研究用于牛肉掺杂肉成分检测的荧光PCR方法。方法:制备不同混合比例的牛肉、猪肉、鸭肉样品,采用DNA提取方法分别提取牛肉、猪肉、鸭肉的DNA,并以不同源性基因为靶基因设定特异性引物和探针;利用荧光PCR的反应条件对DNA实施扩增,分析不同掺杂比例的混合肉样品。结果:该方法设计的荧光PCR引物和探针具备良好的特异性和敏感性,可有效检测出相同质量牛肉、猪肉、鸭肉的DNA浓度差异,可检测出牛肉中猪源性成分、鸭源性成分的质量百分比,且误差均在5%以内,同时可检测实际牛肉食品中牛源性含量差异,并通过DNA检测条带清楚呈现。结论:该方法具备牛肉中掺杂肉成分检测的有效性。
关键词:荧光PCR;成分检测;DNA提取;引物;探针;特异性;扩增条件;敏感性
市场贸易经济中,在牛肉中掺杂价格便宜的猪肉、鸭肉等,冒充牛肉欺骗消费者的情况屡屡发生,严重损害消费者利益。为了更好地保证消费者权益,为肉制品鉴定相关部门提供肉制品质量成分鉴定的有效方法[1-2],依靠感官和经验对肉质品的判断已经不能保证判断结果的准确性,且不满足相关部门对肉类食品掺假的监管。因此,研究一种能快速、有效且特异性强的检测方法,是目前必须解决的问题[3-4] 。本文研究一种用于牛肉掺杂检测的荧光PCR方法,判断牛肉中是否有其他肉类的掺入,为肉制品的检验提供可靠、快捷的方法。
1 材料与方法
1.1 试剂与仪器
1.1.1 试剂 动物组织基因组DNA提取试剂盒,北京索莱宝科技有限公司;核糖核酸酶A,上海江莱生物有限公司;Tap DNA聚合酶,上海捷瑞生物工程有限公司;Premix Ex Taqxuaq,南京森贝伽生物科技有限公司;引物和探针合成、人工全基因合成,上海捷瑞生物工程有限公司;无水乙醇,分析纯,上海昆山化工原料有限公司[5];琼脂糖(西班牙),上海如吉生物科技有限公司。
1.1.2 仪器 实时荧光PCR仪,上海士森视觉科技有限公司;高速冷冻离心机,上海继普电子科技有限公司;凝胶成像系统,上海勤翔科学仪器有限公司;电子天平,上海亚津电子科技有限公司;舒适型恒温混匀仪,杭州佑宁仪器有限公司;绞肉机,上海台乙机械设备有限公司;旋涡震荡仪,北京优晟联合科技有限公司;电泳系统,深圳美科仪科技有限公司。
1.2 方法
1.2.1 样本制备 本研究使用的猪肉、鸭肉、牛肉均由北京肉制品质量检验中心提供[6],按照牛肉、鸭肉、猪肉各自不同的比例完成样本制备(表1)。
1.2.2 DNA提取 选取50 g动物肌肉组织样本,利用绞肉机将其搅碎后,按照以下方法完成DNA提取:(1)将搅碎的样本选取一定量放入2 mL离心管中,将预热至66 ℃的十六烷基三甲基溴化铵提取液以及3.8 μL蛋白酶K溶液,放于66 ℃舒适型恒温混匀仪中60 min,并间隔15 min取出颠倒混匀,直至取出。(2)离心机中放入从舒适型恒温混匀仪中取出的样本[7],并离心15 min后,吸取上清放入至新的离心管中。(3)在旋涡震荡仪上放入498 μL三氯甲烷和吸取的上清混合液,并旋涡30 s使其充分混匀后,放于离心机离心15 min。(4)向新的1.5 mL离心管中加入混匀后的样本以及2.1倍的十六烷基三甲基溴化铵提取液[8-9],于室温环境下放置60 min。(5)将离心管中放置60 min后的样本,放入离心机并离心5 min后,将样本中的上清液提取出来丢弃。(6)向步骤(5)中的离心管中分别加入氯化钠溶液和三氯甲烷各351 μL,将其放入旋涡震荡仪上旋涡35 s,使其充分混匀后,取出放置于离心机并离心15 min。(7)向新的1.5 mL离心管中加入步骤(6)处理后的样本及0.7倍体积的异丙醇,将其轻摇混匀后放于室温下25 min。(8)向离心机上放入步骤(7)获取的样本并离心15 min取出,并将样本中的上清液提取出来丢弃后[10-12],加入498 μL 75%乙醇,置于旋涡震荡仪上旋涡35 s,使离心管中样本的沉淀完全洗涤,放入离心机并离心15 min。(9)将样本中上清液提取出来丢弃并将沉淀晾干后,加入49 μL超纯水完全溶解后,放入-18 ℃冰箱中,存储备用[13] 。
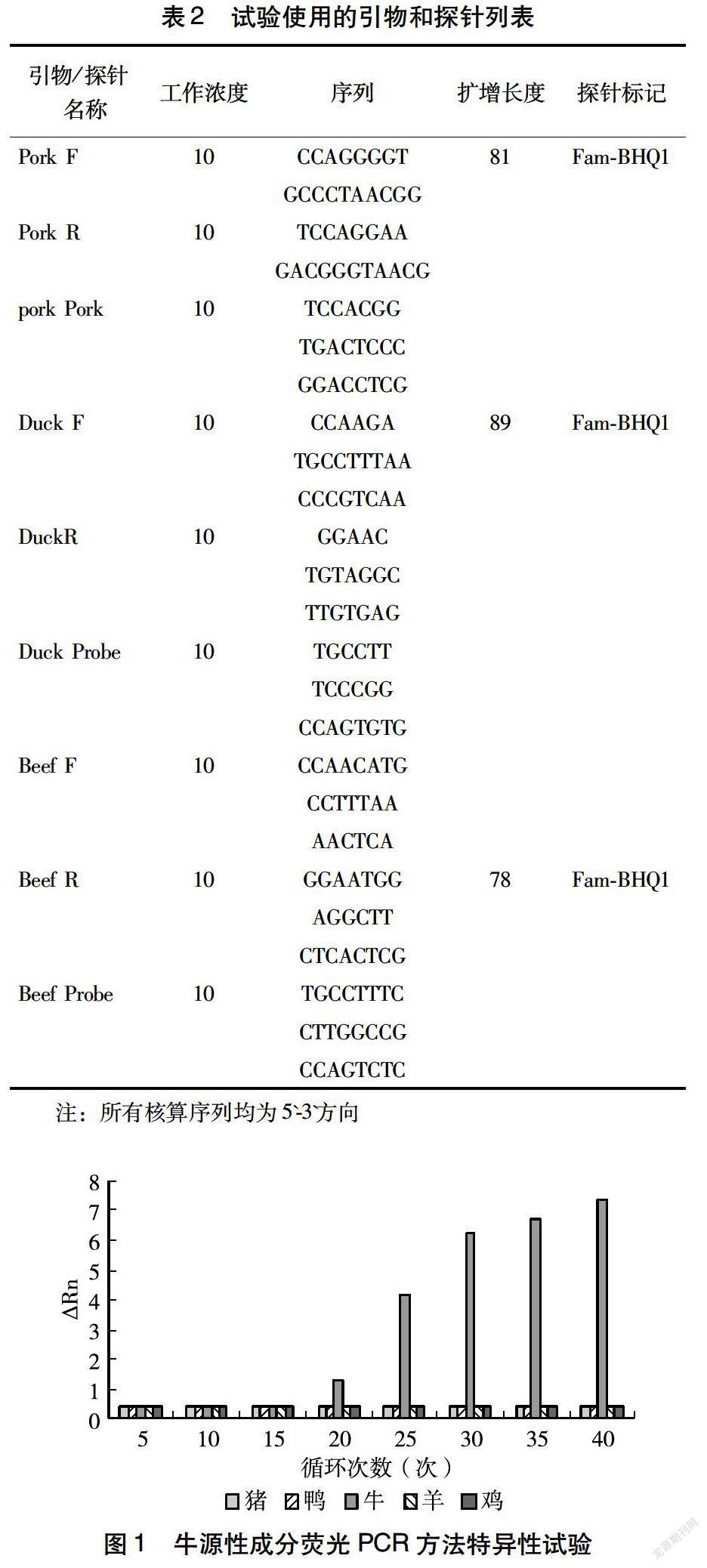
1.2.3 荧光PCR检测 (1)荧光PCR反应条件:PCR反应体系为35 μL,各成分含量分别为:10×缓冲液3.5 μL,2.5 mmol/L 4×dNTPs 1 μL;引物1.1 μL;氯化镁2.9 μL;模板11 μL;无菌超纯水24 μL;Tap DNA聚合酶2.4 μL(2.4 U/μL)。(2)荧光PCR扩增条件:循环参数为95 ℃变性4 min,然后运行35个循环,每个循为94 ℃变性30 s,55 ℃变性25 s,75 ℃变性60 s,35个循环后75 ℃保温持续300 s,形成扩增产物。(3)荧光PCR质量控制:设定每个样本的荧光PCR检测均为平行样本[14],扩增Ct值选取2个样的Ct值均值。(4)引物和探针:为了完成对样本中牛肉和猪肉的质量百分比的检测[15],以牛源性基因、猪源性基因和鸭源性基因为靶基因设定特异性的引物和探针(表2)。
2 结果与分析
2.1 引物及探针的特异性测试
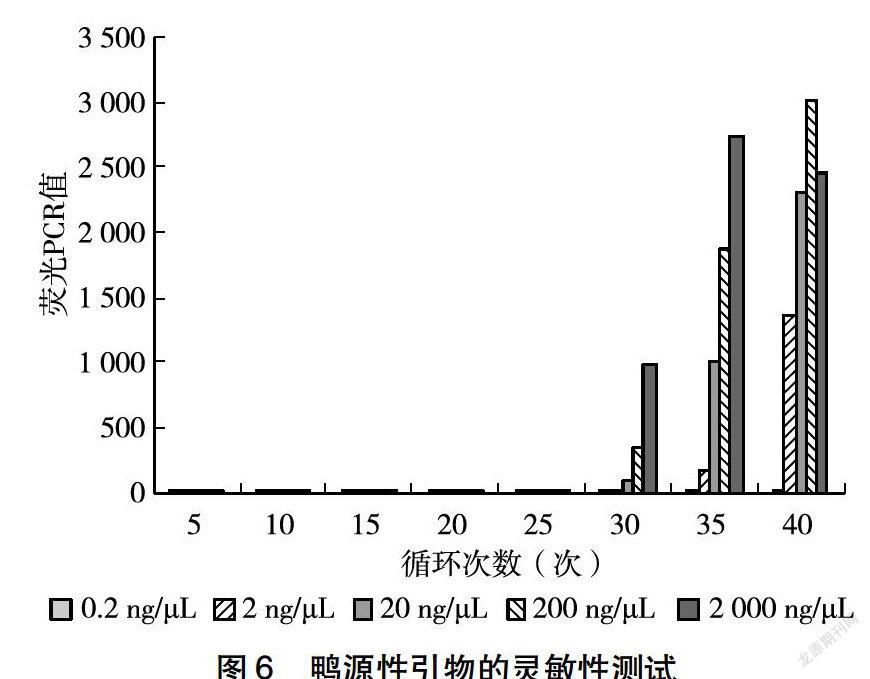
为了验证本研究设计引物的特异性,选取猪、鸭、牛、羊、鸡的DNA为模板,使用2.5中的引物和探针完成样本扩增。通過图1~3可以看出,针对牛源性基因设计的特异性引物和探针与其他物种DNA无反应,只与牛DNA的会产生特异性扩散曲线;针对猪源性基因设计的特异性引物和探针与其他物种DNA无反应,只与猪DNA的会产生特异性扩散曲线;针对鸭源性基因设计的特异性引物和探针与其他物种DNA无反应,只与鸭DNA的会产生特异性扩散曲线,说明本研究设计的引物和探针均具备良好的特异性。
2.2 引物的灵敏性检测
为了检测文中研究的引物在荧光PCR检测反应中的灵敏度,选取样品V15,利用鱼精DNA(2 000 ng/μL)溶液10倍稀释样品V15中的牛源性DNA(2 000 ng/μL)、猪源性DNA(2 000 ng/μL)、鸭源性DNA(2 000 ng/μL),获取稀释反应后DNA样品,浓度分别为0.2、2、20、200、2 000 ng/μL。当获取的稀释后样本DNA浓度下降为0.2 ng/μL时,牛、猪、鸭源性引物和探针均无法扩增出特意曲线,即Ct>40(图4~6)。
2.3 相同质量的牛肉、猪肉、鸭肉所提取的DNA浓度差异 为使荧光PCR检测技术在对样本检测时,判断不同动物源性成分的质量百分比,需要检测相同质量的牛肉、猪肉、鸭肉提取的DNA浓度差异。分别取牛肉、猪肉、鸭肉各0.02 g和0.04 g完成测试,按照2.3方法提取牛肉、猪肉、鸭肉的DNA,并按照公式d=M/DNA,获取不同肉类样品质量与该样品的DNA质量数的比值。通过表3可以看出,当质量是0.02 g时,牛d=M/DNA=938.9、猪d=M/DNA=161、鸭d=M/DNA=41.1;当质量是0.04 g时,牛d=M/DNA=926、猪d=M/DNA=583.9、鸭d=M/DNA=188.5。质量不同时,d值会存在操作误差或者仪器检测误差,因此取两次试验的平均值,即d牛=932.45、d猪=154.95、d鸭=114.8。
2.4 检测样本中牛肉、猪肉、鸭肉的质量百分比
使用荧光PCR检测V1~V14样本中不同动物源性成分的质量百分比含量,分别从V1~V14样本中取0.04 g肉样,实行荧光PCR检测,获取其质量百分比结果。通过表4、表5可以看出,使用荧光PCR可以检测出所有样本中掺入的猪肉和鸭肉,并且质量百分比的误差均在5%以内,满足牛肉中掺杂肉成分的检测需求。
2.5 实际样品检测结果
为验证本文荧光PCR方法的实际鉴定检验情况,从北京某超市购买标明主要成分为牛肉的8种肉制品,用本文方法提取DNA并检测。通过表6、图7可以看出,使用荧光PCR方法对8种实际样品检测后,发现各种牛肉食品中牛源性含量均有不同,且DNA条带能够清楚呈现,说明本文方法适用于大部分肉制品的掺入成分检测。
3 结论
利用荧光PCR技术定量检测牛肉中掺杂肉成分,结果表明,本研究设计的引物和探针具备检测特异性和敏感性,可有效检测出样品中牛肉、猪肉、鸭肉的DNA浓度差异,判断不同动物源性成分的质量百分比含量。对市面上8种牛肉制品实施检测发现,存在未含牛源性成分的牛肉制品,市面上存在假肉现象,本文方法还可应用于肉制品中牛源性成分检测。◇
参考文献
[1]徐依婷,穆月英.我国城镇居民食品消费需求分析与预测模拟[J].中国食物与营养,2017,23(7):46-50.
[2]李祥洲.我国农产品质量安全问题治理对策探讨[J].中国食物与营养,2017,23(1):12-16.
[3]陆俊贤,唐修君,樊艳凤,等.利用荧光定量PCR技术鉴别畜禽肉中猪源性成分[J].食品研究与开发,2017,38(10):110-112、172.
[4]杨华,汪小福,肖英平,等.牛肉及其制品中掺入鸡肉、鸭肉和猪肉的多重数字PCR快速检测方法研究[J].浙江农业学报,2017,29(6):994-1000.
[5]纪艺,等.几种动物生鲜肌肉组织样品DNA提取方法的比较研究[J].浙江农业学报,2019,31(9):1471-1477.
[6]张颖颖,等.液相色谱串联质谱对掺假牛肉的鉴别及定量研究[J].现代食品科技,2017,33(2):230-237.
[7]王维婷,等.COI序列应用于羊肉掺伪非定向筛查技术的研究[J].现代食品科技,2019,35(2):216-222.
[8]谢凤莲,孙万成,罗毅皓.牦牛肉品质相关的去饱和脂肪酶1基因表达差异分析[J].食品研究与开发,2019,40(5):1-5.
[9]胡连霞,孙晓霞,陈启跃,等.GNM C7-8实时荧光PCR系统对掺假肉制品中多种动物源性成分的同时检测[J].食品工业科技,2019,40(14):240-246.
[10]高志强,等.双重实时荧光PCR定量检测动物产品中牛源性成分[J].生物技术通报,2018,34(9):190-194.
[11]朱扬,劉永峰,魏燕超,等.牛肉及其中式加工品中猪肉成分的定性、定量检测方法研究[J].中国农业科学,2018,51(22):4352-4363.
[12]刘艳,王鸣秋,李诗瑶,等.基于实时荧光定量PCR和数字PCR的肉制品中牛源性成分检测[J].现代食品科技,2019,35(7):254-260.
[13]石盼盼,李旭,魏法山,等.肉类掺假的分子生物学检 测[J].食品与生物技术学报,2017,36(7):773-777.
[14]冯健,李英花,严昌国.延边黄牛黑皮质素受体-4基因多态性及其与肉质性状的相关性分析[J].中国畜牧兽医,2017,44(5):1406-1413.
[15]杜洪振,等.猪牛肉掺假鉴定技术及其特异性物质研究进展[J].食品研究与开发,2017,38(13):199-204.
Abstract:Objective The fluorescent PCR method for the detection of adulterated beef was studied.Method The DNA of beef,pork and duck were extracted respectively by DNA extraction method,and the specific primers and probes were set with different homologous genes as target genes,the DNA was amplified by the reaction conditions of fluorescent PCR,and the mixed meat samples with different doping ratios were analyzed.Result The results showed that the primers and probes designed by this method had good specificity and sensitivity,could effectively detect the difference of DNA concentration of beef,pork and duck meat of the same quality,could detect the quality percentage of pig derived and duck derived components in beef,and the error was within 5%.At the same time,it could detect the difference of cattle derived content in actual beef food,and through DNA detection the strip was clear.Conclusion The method was effective for the detection of adulterated meat in beef.
Keywords:fluorescence PCR;component detection;DNA extraction;primer;probe;specificity;amplification condition;sensitivity

