赤松茸多糖的提取及对小鼠免疫力的影响
伍玉兰 冯婉滢 张玲雨 王晓琛 张颖颖

摘 要:目的:从赤松茸中提取粗多糖,并探讨其对小鼠免疫功能的影响。方法:采用水提醇沉的方法提取赤松茸多糖,取40只雌性昆明小鼠,分为5组,随后用不同剂量的赤松茸多糖(200、100、50 mg/kg·d)灌胃,7 d后检测小鼠脏器指数及血清干扰素γ(IFN-γ)指标;用MTT法研究赤松茸多糖对小鼠脾脏细胞、腹腔巨噬细胞体外增殖影响。结果:体内对照研究显示:赤松茸多糖可有效提高脾脏、胸腺指数及血清IFN-γ水平(P<0.05);体外对照研究显示:在区间内,赤松茸多糖可显著促进脾脏细胞(0.25~2 mg/mL,P<0.05)以及巨噬细胞(0.5~1 mg/mL,P<0.05)增殖。结论:赤松茸多糖对小鼠免疫力有明显增强作用,对细胞免疫的增强效果尤为显著。
关键词:赤松茸多糖;IFN-γ;免疫活性;环孢素A;水提醇沉
赤松茸是一种与赤松林树根共生的野生食用菌[1],近年来已人工培育成功,是欧美各国栽培的著名食用菌之一,也是联合国粮农组织推荐发展中国家栽培的食用菌之一[2],且目前已在我国引种成功。作为具有较高营养价值的食用菌之一,赤松茸子实体中富含蛋白质、维生素、多糖和矿物质等化学成分,其中多糖为其所含重要生物活性物质,具有提升机体免疫能力的功效,这表明赤松茸还具有药用价值,是珍贵的药食两用真菌[3-5] 。近年来,食用真菌的深度开发利用成为研究热点,多糖是其主要有效成分之一,目前市场上已有的真菌多糖类保健品达上百种[6] 。但赤松茸多糖的相关研究尚少,国内已有研究多集中于赤松茸多糖的发酵条件、抑菌作用、抗氧化活性及对小鼠心血管系统的影响[5],对其免疫活性的药理研究报道较少。为深入研究赤松茸多糖对机体免疫功能的影响,本实验从赤松茸中提取了多糖,以环孢素A建立小鼠免疫缺陷模型,研究赤松茸多糖对小鼠体内免疫的影响,并以脾脏细胞、巨噬细胞对其体外免疫活性进行研究,以期为临床赤松茸营养食品和药品开发提供科学依据。
1 材料
1.1 实验动物
昆明系(KM)小鼠40只,雌性,SPF级,体质量18~20g,购于济南朋悦动物繁育有限公司,合格证号SCXK(鲁)20140007。
1.2 试剂与仪器
1.2.1 试剂 小鼠血清的IFN-γ试剂盒,北京中科海博科技有限公司,批号:201705;环孢素A、75%乙醇、80%乙醇、丙酮、蒸馏水、生理盐水、PBS缓冲液,Thermo Fisher Scientific;RPMI-1640培养液,Thermo Fisher Scientific;一次性无菌细胞培养皿,上海广锐生物科技有限公司;EP管、DragonLab移液器(20、100、200、1 000 μL)及配套吸头、200目钢丝网、双抗(青霉素与链霉素混合液),Thermo Fisher Scientific;红细胞裂解液,Solarbio Life Sciences。
1.2.2 仪器 高速离心机TD5A,盐城凯特实验仪器有限公司;LGJ-18A冷冻干燥机,北京四环科学仪器厂有限公司;恒温磁力搅拌器,环宇科学仪器厂;普朗DNM-9602酶标、N-3010旋转蒸发仪,EYELA东京理化器械株式会社;BS210S电子天平,Sartorius;数码生物显微摄影系统,上海彼爱姆光学仪器制造有限公司;电热恒温鼓风干燥箱,上海精宏实验设备有限公司;CO2培养箱,Thermo Fisher Scientific;光学显微镜、倒置显微镜,奥林巴斯。
2 方法
2.1 赤松茸多糖的提取
如附图所示[7-8]提取赤松茸多糖。将松茸子实体烘干后粉碎过筛,准确称取600 g子实体粉末,按料水比1∶ 25加入蒸馏水(g∶ mL),置于恒温搅拌器中,转速600 r/min、75 ℃加热、浸提20 min,离心。重复浸提1次,将两次上清液合并,用旋转蒸发仪浓缩至适当体积。然后加入75%乙醇,醇沉,于4 ℃冰箱静置12 h,离心,收集沉淀,用80%乙醇和丙酮各洗3次。用适量蒸馏水复溶沉淀并冷冻干燥,冷冻干燥后将其配制成1%水溶液。用Sevag试剂(氯仿∶ 正丁醇=4∶ 1)7.5 mL,振荡15 min,以4 000 r/min的转速离心3 min,去除游离蛋白,最后再次用75%乙醇沉淀得粗多糖,冷冻干燥后备用。
2.2 体内免疫活性
2.2.1 造模与给药 将40只雌性小鼠随机分为5组:正常组、模型组和赤松茸多糖高、中、低剂量组,每组8只。除正常组外,其余各组小鼠均连续3 d腹腔注射环孢素A(100 mg/kg·d),每天1次,建立免疫低下模型小鼠。随后分别给予赤松茸多糖高、中、低剂量组小鼠多糖溶液(200、100、50 mg/kg·d)连续灌胃7 d,每天1次;正常组和模型组则灌胃等量生理盐水。
2.2.2 小鼠脏器指数测定 末次给药后,测定小鼠体质量,摘眼球取血,脱颈椎处死,分离胸腺和脾脏并称重。根据式(1)、(2)计算各组小鼠胸腺指数和脾脏指数:
2.2.3 IFN-γ含量测定 收集小鼠血清,用ELISA法测定各组小鼠血清IFN-γ含量。按照ELISA试剂盒说明书上的步骤操作,测得相应OD值。据此绘制标准曲线并求得其线性方程为y=1 552.6x-100.56,相关系数R2=0.994 3,表示在一定范圍内线性关系良好,最后根据该曲线求出对应IFN-γ含量。
2.3 体外免疫活性
2.3.1 配制药液 赤松茸多糖用PBS配制成浓度为50 mg/mL的药液,无菌过滤,用前浓度稀释为10 mg/mL。
2.3.2 小鼠脾脏细胞的增殖实验 制备小鼠脾脏细胞悬液[9],台盼蓝染色检测细胞生存率大于95%,调整悬液细胞浓度为1.5 ×106个/mL。将该细胞悬液加入96孔板,每孔加入100 μL。多糖组加入赤松茸多糖药液,每孔100 μL,使多糖最终浓度分别为0.062 5、0.125、0.25、0.5、1、2 mg/mL,空白组则加入等体积的双抗RPMI-1640培养液(10%胎牛血清、青霉素100 U/mL、链霉素100 μg/mL)。最后采用MTT法进行体外培养,将脾脏细胞置于37 ℃、5% CO2条件下孵育44 h后取出,参照文献方法[9]进行OD值检测。
2.3.3 小鼠腹腔巨噬细胞的增殖实验 制备小鼠腹腔巨噬细胞悬液[10],台盼蓝染色检测细胞生存率大于95%,调整悬液细胞浓度为2×106个/mL。将该细胞悬液接种于96孔板,每孔150 μL,在37 ℃、5% CO2条件下培养3 h,取出,弃上清液,用PBS缓冲液洗涤3次去除未贴壁细胞,得纯化小鼠腹腔巨噬细胞。在上述纯化后巨噬细胞96孔板中,多糖组加入赤松茸多糖药液,每孔100 μL,使多糖最终浓度分别为0.06、0.12、0.25、0.5、1、2 mg/mL,空白组则加入等体积的双抗RPMI-1640培养液。按2.3.2方法进行细胞培养及OD值测定。
2.4 统计学方法
采用SPSS 25.0软件进行数据分析。计量资料用±s表示,组间比较采用独立样本t检验,检验水准(α)为0.05。
3 结果与分析
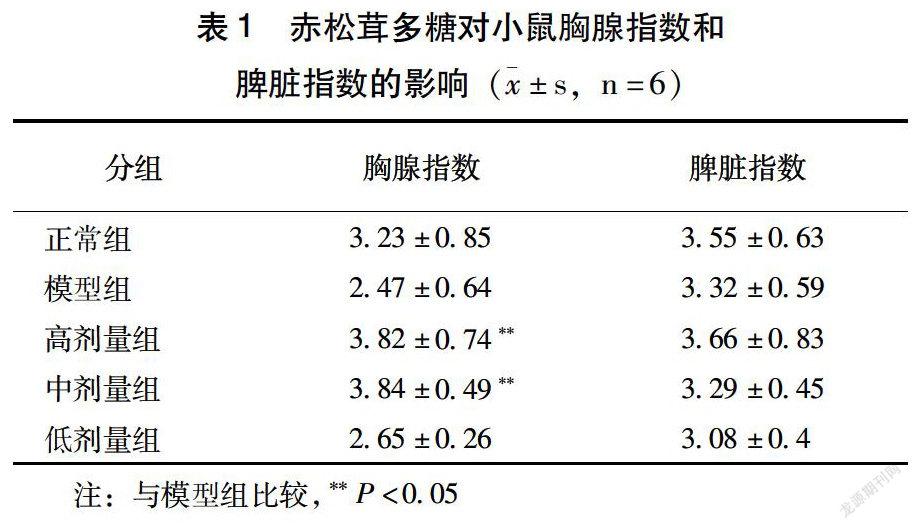
3.1 赤松茸多糖对小鼠脏器指数的影响
如表1所示,模型组与正常组比较,模型组胸腺指数、脾脏指数均低于正常组,表示造模成功。赤松茸多糖高、中、低剂量组与模型组相比,赤松茸多糖对小鼠胸腺增长有一定促进作用,胸腺指数增大,差异有统计学意义(P<0.05);同时对小鼠脾脏也有促增长作用且随着剂量增加,脾脏指数增大,但差异无统计学意义(P>0.05)。
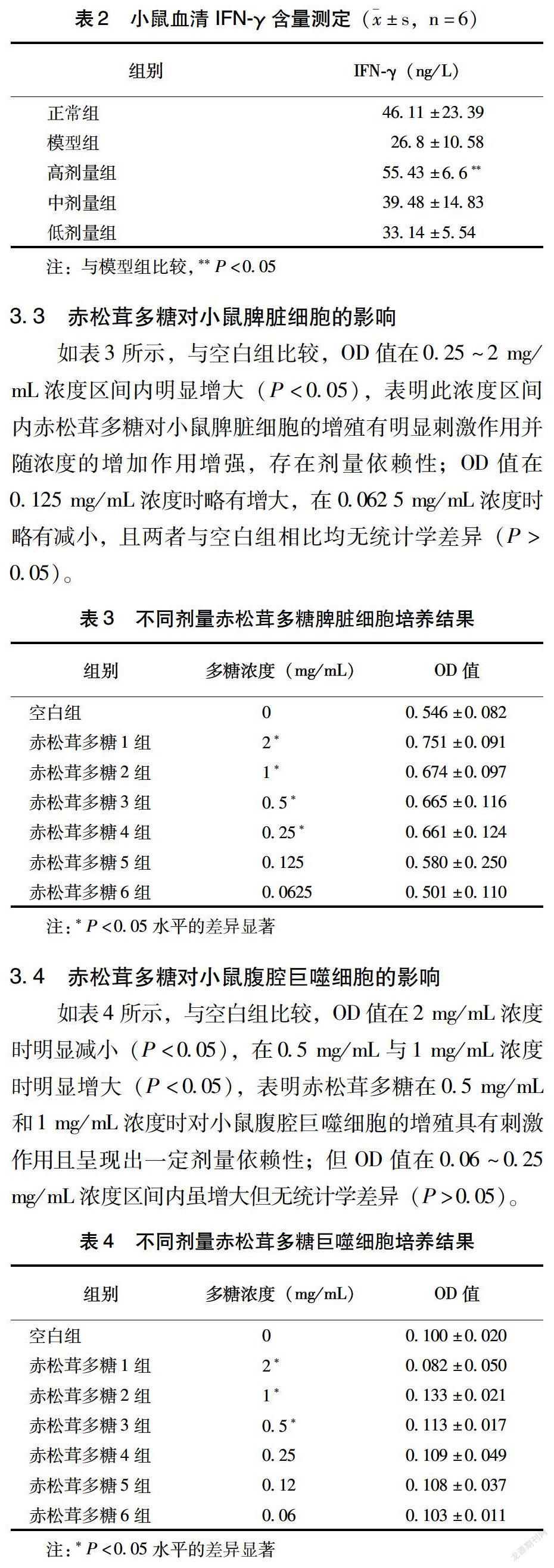
3.2 赤松茸多糖对小鼠血清IFN-γ含量的影响
如表2所示,模型组与正常组比较,血清IFN-γ含量明显降低,表明建模成功。与模型组相比,高剂量组IFN-γ含量显著升高(P<0.05),且与中、低剂量组差异明显,说明高剂量组可显著升高免疫低下小鼠IFN-γ含量。
3.3 赤松茸多糖对小鼠脾脏细胞的影响
如表3所示,与空白组比较,OD值在0.25~2 mg/mL浓度区间内明显增大(P<0.05),表明此浓度区间内赤松茸多糖对小鼠脾脏细胞的增殖有明显刺激作用并随浓度的增加作用增强,存在剂量依赖性;OD值在0.125 mg/mL浓度时略有增大,在 0.062 5 mg/mL浓度时略有减小,且两者与空白组相比均无统计学差异(P>0.05)。
3.4 赤松茸多糖对小鼠腹腔巨噬细胞的影响
如表4所示,与空白组比较,OD值在2 mg/mL浓度时明显减小(P<0.05),在0.5 mg/mL与1 mg/mL浓度时明显增大(P<0.05),表明赤松茸多糖在0.5 mg/mL和1 mg/mL浓度时对小鼠腹腔巨噬细胞的增殖具有刺激作用且呈现出一定剂量依赖性;但OD值在0.06~0.25 mg/mL浓度区间内虽增大但无统计学差异(P>0.05)。
4 讨论
多糖是植物的有效成分之一[11],同时也广泛分布于香菇、银耳、鸡苁菌等真菌中[12] 。现代药理研究证明,真菌多糖具有免疫调节、抗肿瘤、抗病毒、抗凝血、抗放射、抗衰老等功效[13] 。环孢素A为11个氨基酸组成的环状多肽,是从霉菌代谢产物中提取得到的第三代免疫抑制剂,对体液免疫和细胞免疫都有较好的抑制作用[14] 。本实验以环孢素A(100 mg/kg·d)连续3 d对小鼠进行腹腔注射,成功构建免疫低下小鼠模型。
脾脏是人体最大的外周免疫器官,是T/B淋巴细胞定居和发生免疫应答的主要场所;胸腺是人体的中枢免疫器官,是T淋巴细胞发育成熟的场所,二者均对机体免疫反应起着重要作用。因此胸腺和脾脏可作为评判机体免疫功能强弱的指标[15] 。本研究体内实验显示,赤松茸多糖可有效提高小鼠胸腺、脾脏指数。其中,胸腺指数相较于模型组差异具有统计学意义,说明赤松茸多糖能增强小鼠胸腺功能,提高小鼠免疫力。而脾脏指数虽有提高,但差异无统计学意义,说明其可能也潜在地增强了脾脏功能。体外增殖实验显示,赤松茸多糖在0.25~2 mg/mL浓度区间内能够明显刺激脾脏细胞的增殖且该作用存在明显的量效关系,体内外免疫实验趋势一致,均说明赤松茸多糖能够有效提高机体免疫应答。
巨噬细胞是体内一种重要的固有免疫细胞[16-17],可吞噬并消化细胞残片与病原体,进而清除衰老细胞[18]、抵挡病原微生物的入侵。因此,通过测定药物干预后巨噬细胞的增殖情况,可有效反映药物对机体免疫功能的影响。IFN-γ是细胞免疫中的主要细胞因子之一,可由Th1细胞分泌,能促进Th1细胞自身的增殖分化,同时具有直接促进T/B细胞分化成熟的作用[19],从而促进机体免疫应答[20] 。本研究体内实验表明,赤松茸多糖可明显提高小鼠血清中IFN-γ的含量,且有一定的剂量依赖效应,提示在一定程度内适量增加松茸多糖剂量可进一步增强小鼠免疫功能。此外,小鼠体外腹腔巨噬细胞增殖实验表明,赤松茸多糖在0.5 mg/mL与1 mg/mL浓度时能够明显刺激巨噬细胞的增殖,且该作用存在明显的量效关系。
综上所述,赤松茸多糖能够有效调节机体免疫器官胸腺、脾脏功能以及某些细胞因子如IFN-γ的分泌,从而增强机体免疫力。松茸多糖作用于环孢素A所致免疫缺陷小鼠后,可有效提高其胸腺、血清IFN-γ水平,作用于體外培养脾脏细胞及巨噬细胞,均可促进其增殖,说明该多糖对小鼠的细胞免疫有较好调节作用,有望作为免疫刺激增强剂进一步深入开发。◇
参考文献
[1]萨仁图雅,图力古尔.大球盖菇研究进展[J].食用菌学报,2005,4(12):57-64.
[2]黄年来.大球盖菇的分类地位和特征特性[J].食用菌,1995(6):11.
[3]佘冬芳,樊卫国,徐彦军.白灵菇和大球盖菇的营养分析与比较[J].食用菌,2007(4):57-58.
[4]王晓炜,詹巍,陶明煊,等.大球盖菇营养成分、抗氧化活性物质分析[J].食用菌,2007(6):62-63.
[5]陈君琛,翁敏劼,赖谱富,等.大球盖菇多糖的分子质量分布及其单糖的组成[J].中国农业科学,2011,44(10):2109-2117.
[6]郝瑞芳,景浩.真菌多糖的研究进展[J].中國食物与营养,2008(4):19-22.
[7]翁敏劼.大球盖菇多糖的提取、结构及生物活性研究[D].福州:福建农林大学,2010.
[8]陈君琛,赖谱富,周学划,等.响应面法优化大球盖菇粗多糖提取工艺[J].食品科学,2012,33(2):139-142.
[9]杜宝香,相美容,付业佩,等.北沙参多糖的分离、纯化及其体外免疫活性考察[J].中国实验方剂学杂志,2018,24(11):27-31.
[10]冯燕玲.茶多糖对免疫抑制小鼠腹腔巨噬细胞与脾淋巴细胞免疫功能的影响[D].南昌:南昌大学,2015.
[11]王萍,贾晓顺,朱庆均,等.分级醇沉对罗勒多糖体外抑菌及免疫活性的影响[J].中国食物与营养,2019,25(1):63-66.
[12]刘博,徐德昌.真菌多糖研究进展[J].中国甜菜糖业,2007(3):26-29.
[13]淑俐,邓放明.真菌多糖的生物活性研究进展[J].中国食物与营养,2007(1):27-28.
[14]杨燕宁,朱伽月,宋秀胜,等.环孢素A临床应用的研究进展[J].国际眼科杂志,2017,17(3):463-466.
[15]陈兰芬.姬松茸多糖对小鼠免疫调节作用的初步研究[J].中国临床研究,2014,27(6):724-725、728.
[16]付业佩,杜宝香,范珊珊,等.附子黑顺片多糖的提取及对免疫活性的研究[J].中华中医药杂志,2018,33(9):4147-4150.
[17]刘帆,张颖颖,侯林.安儿宁颗粒的体外抗菌、抗炎和免疫增强活性研究[J].中国药房,2019,30(16):2221-2225.
[18]Arias CF,Arias CF.How do red blood cells know when to die?[J].R Soc Open Sci,2017,4(4):160850.
[19]胡天惠,林超,项媛媛,等.潞党参口服液对免疫抑制小鼠的免疫调节作用[J].药学与临床研究,2019,27(3):171-174、186.
[20]宋广福,陈丽娜,许玉凤,等.参芪扶正注射液对免疫低下小鼠的免疫调节作用及其机制研究[J].中医药导报,2017,23(20):17-20.
Abstract:Objective To extract the crude polysaccharide from Stropharia rugoso-annulata,and to explore its effect on the immune function of mice.Method The polysaccharide of Stropharia rugoso-annulata was extracted by the method of water extraction and alcohol precipitation,40 mice were divided into 5 groups,and the mice were given intragastric administration with different doses of the polysaccharides(200,100,50 mg / kg·d),and the organ index and the serum IFN-γ index were detected after 7 days.The effect of Stropharia rugoso-annulata polysaccharide on the proliferation of spleen cells and peritoneal macrophages in mice was studied by MTT method.Result In vivo control study showed that Stropharia rugoso-annulata polysaccharide could effectively increase the level of spleen,thymus index and serum IFN-γ(P<0.05).In vitro control study showed that Stropharia rugoso-annulata polysaccharide could significantly promote the proliferation of spleen cells(0.25~2 mg/mL,P<0.05)and macrophages(0.5~1 mg/mL,P<0.05)in the interval.Conclusion Stropharia rugoso-annulata polysaccharide has a significant effect on mouse immunity,especially on cellular immunity.
Keywords:the polysaccharide from Stropharia rugoso-annulata;IFN-γ;immune activity;cyclosporine A;water-extraction-alcohol-precipitation method

