PLA2R真核表达细胞株的构建及其在膜性肾病诊断中的应用
王超男,李伟皓,沈宝艳,李江雪,张 佳,刘晓梅,张菲菲,张智萍,冯晓燕,张贺秋
(1.东方海洋(北京)医学研究院,北京 100071; 2.河北医科大学第二医院特检科,石家庄 050000;3.蒙城县第一人民医院肾病免疫风湿科,安徽亳州233500)
膜性肾病(membranous nephropathy,MN)是一种器官特异性自身免疫疾病,是导致成人肾病综合征的常见病因[1-3]。根据病因将膜性肾病分为两类,第一类为没有明确病因的“原发性膜性肾病(idiopathic membranous nephropathy,IMN)”,约占总患病人数的70%。第二类为由乙型肝炎、系统性红斑狼疮、癌症和药物不良反应等引起的“继发性膜性肾病(secondary membranous nephropathy,SMN)”,约占总患病人数的30%[4]。IMN 和SMN 的临床表现和组织学表现相同,但治疗方法完全不同[5-6],IMN 的治疗更为复杂,包括多种治疗方案,所以针对IMN 的正确鉴别诊断尤为重要。
目前临床上IMN 的诊断主要包括两类方法,一类是侵入性诊断方法,如肾脏穿刺、组织学检查或肾组织电镜检查等,但侵入性方法为有创性操作,会对患者造成一定程度上的伤害,风险高,可能会引起一系列并发症,并且不适于动态观察患者病情。2009年,BECK 等[7-8]首次发现了膜性肾病的靶抗原-M 型磷脂酶A2 受体(phospholipase A2 receptor,PLA2R),表明PLA2R 是IMN 的一个主要自身抗原。随之出现了另一类非侵入性的PLA2R 自身抗体血清学诊断方法[9-10],不仅快速、简便易行,而且可以动态观察病情,指导治疗[11],主要包括细胞免疫荧光方法(immunofluorescence assay,IFA)和酶联免疫吸附法(enzymelinkedimmunosorbentassay,ELISA)。但ELISA 方法由于存在与抗人IgG 的非特异反应,易出现假阳性。而IFA 方法不但具有血清学检测的优势,还能够直观观察荧光的细胞分布,提高检测的特异性和准确性,被誉为自身抗体血清学检测的“金标准”。
但是目前对于PLA2R 自身抗体的检测只有德国欧蒙公司的进口试剂,且价格昂贵。因此,本研究目的在于构建表达PLA2R 蛋白的稳定细胞株,并对其在膜性肾病诊断中的应用进行探索,以期能够为实现PLA2R 自身抗体检测试剂的国产化奠定基础。
1 材料与方法
1.1 研究对象 收集河北医科大学第二医院和蒙城县第一人民医院2018 ~2019年就诊并进行抗PLA2R 抗体检测的肾病患者血清共97 例,患者年龄16 ~74 岁,平均年龄48.2±15.9 岁,男性61 例,女性36 例。根据欧蒙抗PLA2R 抗体IgG 检测试剂盒(酶联免疫吸附法),当血清抗PLA2R 抗体<14 RU/ml 时,则认为血清呈抗PLA2R 抗体阴性,当血清抗PLA2R 抗体≥14 RU/ml 时,则认为血清呈抗PLA2R 抗体阳性。阴性组55 例,男性32 例,女性23 例,平均年龄48±16.2 岁;阳性组42 例,男性27 例,女性15 例,平均年龄48±15.9 岁。血清无脂血、溶血等不合格情况,收集于干燥洁净EP 管,−80℃冻存备用。
1.2 试剂与仪器 pIRES-PLA2R 质粒(北京中美泰和公司);质粒抽提纯化试剂盒(QIAGEN 公司);Lipofectamine 2000 转染试剂(Thermofisher公司);CHO(中国仓鼠卵巢脑细胞,Chinese Hamsters Ovary)细胞(ATCC);抗生素G-418(Sigma公司);通用总蛋白质提取试剂盒(上海生工公司);总RNA 提取试剂盒(上海生工公司);RTPCR 试剂盒SuperScript ™ One-Step RT-PCR System(Thermofisher 公司);兔抗PLA2R 多抗(Atlas公司) ;FITC-羊抗兔IgG抗体(北京中杉金桥公司);FITC-羊抗人IgG 抗体(北京中杉金桥公司)。
1.3 方法
1.3.1 PLA2R 真核表达质粒的构建:综合生物信息学分析和文献报道,从NCBI 数据库调取PLA2R的全长编码基因(NM_007366.4)。由于PLA2R全长编码基因的长度较长,为避免在基因调取和扩增过程中产生基因突变,委托北京中美泰和公司进行基因合成并将全长基因连接到真核表达质粒pIRESneo 中,构建pIRES-PLA2R 质粒。用质粒纯化试剂盒抽提pIRES-PLA2R 质粒并琼脂糖凝胶电泳鉴定。
1.3.2 PLA2R 稳定表达细胞株的构建:pIRESPLA2R 质粒定量后用于真核细胞转染。在转染前一天将CHO 细胞以3×105个/ 孔的密度接种于6 孔板,37 ℃培养过夜。按照Lipofectamine 2000 转染试剂说明书,分别用PLA2R 真核表达质粒pIRES-PLA2R、空质粒pIRESneo 和不含质粒的PBS 转染CHO 细胞。转染48 h 后更换为含1mg/ml G-418 的完全培养液,每隔3 天更换新鲜培养液。
1.3.3 PLA2R 稳定表达细胞株的鉴定:待CHOPLA2R 组、CHO-Control 组正常生长且PBS 对照组细胞全部死亡时,收取CHO-PLA2R 组和CHOControl 组的部分细胞进行RT-RCR,Western 免疫印迹和IFA 鉴定。
1.3.3.1 RT-RCR 鉴 定:用 总RNA提取试剂盒提取CHO-PLA2R 组 和CHO-Control 组细胞的总RNA,进行反转录PCR 鉴定。根据PLA2R 全长基因,设计合成RT-PCR 鉴定引物F1(序列:TCGTTTCCTTACGGTGGCCGCT)和R1(序列:TTCTGCAGAGGTGGGATCAG)。 根 据RT-PCR试剂盒说明书,取4μl RNA 提取物作为扩增模板,F1/R1 作为引物对,按试剂盒要求进行一步法RTPCR,50℃ 30 min 逆转录,95℃ 15 min 预变性后,进行PCR 循环:95℃ 45 s,58℃ 15 s,72℃ 30 s,循环40 次,72℃延伸5 min。取PCR 产物5 μl 进行1g/dl 琼脂糖凝胶电泳。
1.3.3.2 Western 免疫印迹鉴定:用细胞总蛋白提取试剂盒提取CHO-PLA2R 组和CHO-Control 组的细胞总蛋白,进行Western 免疫印迹鉴定。取总蛋白80μg 进行8g/dl SDS-PAGE,然后电转印于PVDF膜。封闭后加入1:1 000 稀释的抗PLA2R 抗体,4℃孵育过夜。洗膜后加入1:500 稀释的FITC-羊抗兔IgG,室温孵育1 h。洗膜后ECL 显色。
1.3.3.3 细胞免疫荧光鉴定:在IFA 方法鉴定前一天将经G-418 筛选的CHO-PLA2R 细胞和CHOControl 细胞以1×105个/孔的密度接种于96 孔板中,37℃培养过夜,PBS 洗1 次,每次5 min。用4ml/dl 多聚甲醛固定,PBS 洗3 次。PBS 洗后加入1∶100 稀释的FITC-兔抗PLA2R 抗体,湿盒室温孵育2h,PBS 洗3 次。加入1∶400 稀释的FITC-羊抗兔IgG,湿盒室温孵育30min,PBS 洗3 次。防荧光淬灭剂封片,置荧光显微镜下观察,同时设未转染的细胞作为对照。
1.3.4 PLA2R 稳定表达细胞株的细胞免疫荧光方法的初步评价:用CHO-PLA2R 细胞作为基质对97例肾病患者血清样本进行检测。在IFA 方法检测前一天将CHO-PLA2R 细胞以1×105个/孔的密度接种于96 孔板中,37℃培养过夜,PBS 洗1 次,每次5min。4ml/dl 多聚甲醛固定15 min。PBS 洗后加入1∶50 稀释的血清样本,湿盒室温孵育2 h。PBS洗后加入1∶300 稀释的FITC-羊抗人IgG,湿盒室温孵育30 min。PBS 洗后加入防荧光淬灭剂封片,置荧光显微镜下观察。
1.4 统计学分析 使用Kappa 检验对两种方法的评价结果进行统计学分析。对P 值和Kappa 值进行分析。如果P<0.05,则具有一定的一致性。Kappa值<0.2 则说明一致性程度较差;0.2~0.4 则说明一致性程度一般;0.4~0.6 则说明一致性程度中等;0.6~0.8 则说明一致性程度较强;0.8~1.0 则说明一致性程度很强。
2 结果
2.1 PLA2R 真核表达质粒的鉴定 北京中美泰和公司完成基因合成和pIRES-PLA2R 质粒构建,并提供测序报告证明PLA2R 基因序列完全正确。
抽提pIRES-PLA2R 质粒。根据pIRESneo 质粒说明书,pIRESneo 质粒分子量大小应为5.3kb,合成的全长编码基因大小为4 389bp,因此pIRESPLA2R 质粒的分子量大小约为9.8kb。琼脂糖凝胶电泳显示pIRES-PLA2R 质粒分子量大小与预期分子量大小一致,见图1。成功抽提供细胞转染的PLA2R 真核表达质粒pIRES-PLA2R,质粒浓度为0.48 μg/μl。
2.2 PLA2R 稳定表达细胞株CHO-PLA2R 的鉴定分别以PLA2R 真核表达质粒pIRES-PLA2R 和空质粒pIRESneo 转染CHO 细胞,经G-418 筛选后获得表达PLA2R 的稳定细胞株CHO-PLA2R 和对照细胞株CHO-Control,鉴定结果见图1。
2.2.1 RT-PCR鉴定提取CHO-PLA2R 组 和CHOControl 组细胞的总RNA:以鉴定引物F1/R1 进行一步法RT-PCR。结果显示CHO-PLA2R 组在350bp处出现一条唯一条带,而CHO-Control 组细胞未见扩增条带,见图2。与预期结果相符,表明稳定转染细胞株CHO-PLA2R 能够正常转录PLA2R 基因。
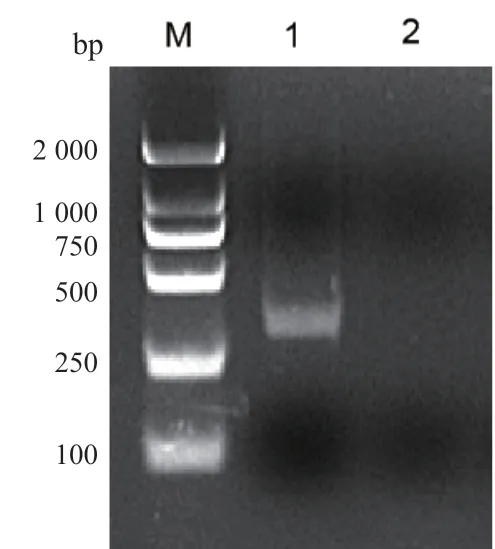
图2 细胞总RNA RT-PCR 鉴定
2.2.2 Western 免疫印迹鉴定提取CHO-PLA2R 组和CHO-Control 组细胞的总蛋白:以PLA2R 兔多抗为一抗进行Western 免疫印迹实验。结果显示CHO-PLA2R 组在约180kD 处有明显条带,与PLA2R 蛋白的预期分子量相符,而CHO-Control组未见相应条带,见图3。表明稳定转染细胞株CHO-PLA2R 可以稳定表达PLA2R 蛋白。
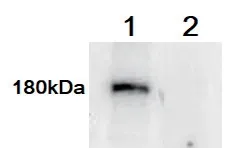
图3 细胞总蛋白Western 免疫印迹鉴定
2.2.3 细胞免疫荧光鉴定:以抗PLA2R 抗体为一抗进行IFA 实验,结果显示,CHO-PLA2R 细胞在细胞质部分呈现较强的绿色荧光,而CHO-Control细胞则几乎无荧光(见图4)。表明成功构建稳定细胞株CHO-PLA2R,可以高水平表达PLA2R 蛋白。
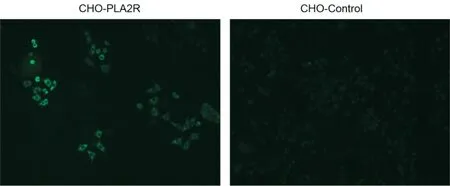
图4 CHO-PLA2R 细胞IFA 方法鉴定
2.3 PLA2R 稳定表达细胞株CHO-PLA2R 的初步应用 用筛选出的CHO-PLA2R 细胞对97 例临床肾病患者样本进行检测,检测结果见表1。PLA2R自身抗体的ELISA 检测结果为阴性55 例,阳性42例。55 例ELISA 检测阴性(<14 RU/ml)样本中,CHO-PLA2R 细胞IFA 方法检测结果均为阴性见图5,特异性符合率100%(55/55)。ELISA 检测阳性(≥14 RU/ml)样本共42 例,其中阳性高值(≥100 RU/ml))样本26 例,阳性低值(14 ~99 RU/ml)样本16 例。ELISA 检测阳性样本中,IFA方法检测结果阳性32 例(见图5),阴性10 例,符合率76.2%(32/42)。其中,ELISA 检测阳性高值26 例样本中,IFA 方法检测结果阳性24 例,阴性2 例,符合率92.3%(24/26);ELISA 检测阳性低值16 例样本中,IFA 方法检测结果阳性8 例,阴性8 例,符合率50%(8/16)。97 例肾病患者血清样本两种检测方法的总符合率为89.7%(87/97)。

表1 97 例肾病患者血清样本抗PLA2R 抗体ELISA 方法与IFA 方法结果对比
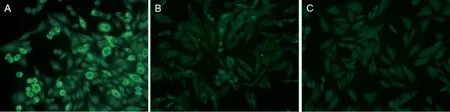
图5 血清样本IFA 实验结果
使用Kappa 检验对两种方法评价结果的一致性进行统计学分析,ELISA 结果阳性样本和ELISA 结果阴性样本均具有一定的一致性(均P<0.05),其中ELISA 结果阳性样本一致性程度中等(Kappa=0.456),ELISA 结果阴性样本一致性很强(Kappa=1.0)。
3 讨论
慢性肾病被称为“沉默的杀手”,很多患者早期没有症状,其中约30%~50%的患者将发展为终末期肾病,对患者的身心健康造成极大影响[1-2]。我国的MN 发病几率逐年上升,从2005年到2017年,MN 在我国的肾活检病人中发病率由9.1%增长到26.5%[9]。MN 可根据病因分为原发性膜性肾病和继发性膜性肾病,其中IMN 的发病率在我国已达到70%~80%[4]。IMN 和SMN 的临床表现十分相近,但治疗方法却完全不同,因此正确鉴别IMN在临床诊断和治疗工作中具有十分重要的意义。目前,MN 诊断的金标准是肾穿刺活检术,但其为有创性操作,不便于病情的动态观察,也不能鉴别IMN 与SMN。
PLA2R 是I 型跨膜蛋白,属于C 型外源性凝集素家族[12-13]。2009年,BECK 研究团队在70%的IMN 患者体内检出PLA2R,提示PLA2R 可能参与了IMN 发病过程。随后,HOXHA 等[14]人发现IMN 患者体内抗PLA2R 抗体的阳性率高达81%。日本一项研究结果显示,IMN 患者体内抗PLA2R抗体的阳性率为53%[15]。近期国内的一项研究结果显示,IMN 患者体内抗PLA2R 抗体的阳性率为57%[16],另一项研究中阳性率高达85.4%[17]。以上研究提示抗PLA2R 自身抗体可能是导致IMN 的致病抗体。多个研究表明,抗PLA2R 抗体诊断IMN 的灵敏度可达70%~85%,特异度更是高达99%[18-20]。因此,抗PLA2R 抗体作为一种病原标志物极具诊断意义。此外,针对PLA2R 自身抗体开发的血清学检测不仅快速、简便易行,还可以动态监测病情活动,为IMN 的治疗和预后提供参考。因此,本文构建了表达PLA2R 的稳定细胞株,以期提供一种高效的IMN 体外诊断工具。
本文首先构建了真核表达质粒pIRES-PLA2R。用pIRES-PLA2R 质粒对CHO 细胞进行稳定转染,RT-PCR 实验、Western 免疫印迹实验和IFA 实验分别从分子、蛋白和细胞水平证明成功构建表达PLA2R 蛋白的稳定细胞株CHO-PLA2R。
将所构建的细胞株应用于抗PLA2R 抗体的IFA 方法体外诊断,与ELISA 方法相比,阴性样本的符合率为100%(55/55);阳性样本的总符合率为76.2%(32/42),其中阳性高值样本的符合率为92.3%(24/26),阳性低值样本的符合率为50%(8/16);样本的总体符合率为89.7%(87/97)。使用Kappa 检验分析两种方法的一致性,ELISA 阳性样本和ELISA 阴性样本均具有一定的一致性,其中ELISA 阳性样本的一致性程度中等,也就是对阳性样本检测的符合率较低;ELISA 阴性样本结果一致性强,也就是对阴性样本检测的符合率高。ELISA 阳性样本结果一致性不强主要是由于弱阳性样本的符合率不高(50%,8/16)。
部分ELISA 检测阳性样本在本实验中使用IFA方法未能成功检出,分析原因可能是作为对照的ELISA 方法由于酶联板的非特异吸附、二抗的非特异性结合、血清中的其他自身抗体引起的非特异反应大大增加了假阳性率,使得ELISA 方法弱阳性结果的准确性降低。而IFA 方法是检测自身抗体的经典方法。理论上,只要胞膜或胞浆中存在相应的抗原,就可特异性检测对应抗体,因此,根据是否存在荧光可以检测是否存在相应的自身抗体(图5A,5B)。另一方面,根据荧光的分布特点及其与对照细胞的荧光比较可以排除非特异荧光结果,从而能够减少假阳性,提高准确性,减少误诊。例如在本文的方法中,有些样本检测时整个细胞均呈现荧光,或者在细胞核而非细胞质呈现强荧光,还有些样本的荧光分布与CHO-Control 对照细胞完全相同,即可判定为非特异性反应。实验结果显示,基于CHO-PLA2R 细胞株建立的IFA 检测方法具有很高的特异性,为IMN 的深入研究及体外诊断提供了有力的生物学工具。但是,该方法对ELISA检测灰区附近的弱阳性样本无法明确判断,导致出现假阴性结果。我们将对IFA 方法进一步改进,以提高灵敏度。另外,与ELISA 方法相比,IFA 方法无法进行精确定量检测,不能用于IMN 患者的疗效评估,在临床上需要与ELISA 方法联合使用。
——一道江苏高考题的奥秘解读和拓展

