两种方法提取的鸡肺胶原蛋白性质及保湿性研究
杨 恒,陈银基,邹 烨,王道营,徐为民,胡慧敏,陈 晨
(1.南京财经大学食品科学与工程学院,江苏南京 210023;2.江苏省农业科学院农产品加工所,江苏南京 210014)
胶原蛋白是一种透明的白色无支链纤维结构蛋白[1-2],由动物细胞的细胞基质合成。它在动物体内占蛋白质总量的25%~30%,广泛存在于动物组织中,如皮肤、肌膜、韧带和血管等,主要决定结缔组织的韧性,起着保护机体、支撑器官的作用[3-5],胶原蛋白被广泛应用于医学材料、皮革工业、化妆品、食品工业等[6]。
我国是一个畜牧业大国,畜禽生产总量居世界前列[7]。2018年全球肉鸡生产量达到9250万吨,我国肉鸡摆脱了H7N9疫情的影响,生产形势回暖,产量达到1170.0万吨,仅次于美国、巴西和欧盟。在国际肉鸡生产呈现持续增长态势的情况下,肉鸡副产物的产量也逐年上升[8]。鸡血、鸡粪、鸡毛、鸡骨等肉鸡副产物均已开始被加工利用,可制备成食品添加剂、动物饲料或复合材料,但国内外对鸡肺利用和加工的相关报道却很少,利用率很低,大量的丢弃不仅造成资源浪费,还会污染环境、传播疾病、危害养禽业[9]。通过前期预试验,酸法提取的胶原蛋白得率占除杂后冻干鸡肺(干重)的8.39%,表明鸡肺中含有丰富的胶原蛋白,鸡肺具有较高的开发利用价值。但是,酸法提取有着工艺耗时过长等缺陷,还需不断改进和完善。超声波辅助提取法是一种极具潜力的食品加工技术,具有高效节能、绿色环保等特点[10],常被应用在天然产物的提取中[11]。
本文以新鲜鸡肺为研究对象,乙酸为提取剂,采用传统酸法和超声辅助酸法提取胶原蛋白,并对其性质进行比较,探讨超声波辅助酸法提取鸡肺胶原蛋白的可行性和优势,为进一步促进鸡肺的综合利用及其胶原蛋白开发提供科学依据。
1 材料与方法
1.1 材料与仪器
鸡肺 江苏立华牧业股份有限公司;羟脯氨酸 上海源叶生物科技有限公司;纤维素透析袋(500~1000) 上海源叶生物科技有限公司;SDS-PAGE上样缓冲液 南京沃博生物科技有限公司;蛋白定量(TP)测定试剂盒 南京建成科技有限公司;异丙醇、NaHCO3、乙酸、氯化钠、磷酸二氢钠、磷酸氢二钠、柠檬酸、乙酸、乙酸钠、氢氧化钠、高氯酸、对二甲基氨基苯甲醛、异丙醇、氯胺T 均为国产分析纯。
SCIENTZ-IID超声波细胞粉碎机 宁波新芝生物科技股份有限公司;奥豪斯ST20笔式酸度计 美国奥斯豪公司;JYL-D051九阳料理机 九阳股份有限公司;Gen5全波长酶标仪 美国伯腾仪器有限公司;SYC-6水浴摇床 上海新苗医疗器械制造有限公司;国华78-1磁力加热搅拌器 常州国华电器有限公司;Centrifuge 5810R离心机 德国Eppendorf艾本德股份公司;PTX-FA210S电子天平 福州华志科学仪器有限公司;德国Christ实验室型Alpha1-2LD plus冻干机 德国Christ公司;SHB-III循环水式多用真空泵 南京科尔仪器设备有限公司;EVO-LS10扫描电子显微镜 德国ZEISSE Oberkochen公司;UV-6100紫外分光光度仪 上海美普达仪器有限公司;Zetasizer Nano Zs90马尔文激光粒度分析仪 英国Malvern仪器有限公司;L-8900高效氨基酸分析仪 日本Hitachi公司;Nicolet 200SXV傅里叶变换红外光谱仪 美国Nicolet公司;Rigaku D/Max2500X射线衍射仪 日本理学公司。
1.2 实验方法
1.2.1 鸡肺胶原蛋白提取工艺流程及操作要点
1.2.1.1 工艺流程 新鲜鸡肺→脱脂→去除非胶原成分→真空冷冻干燥(-40 ℃,48 h)→超声辅助酸法提取或常规酸法提取→10000 r/min离心10 min取上清液→加入NaCl至溶液浓度为0.9 mol/L→10000 r/min离心10 min取沉淀→用0.5 mol/L乙酸溶解→在0.1 mol/L乙酸环境中透析2 d→真空冷冻干燥(-40 ℃,48 h)
1.2.1.2 操作要点 参照蔡盼盼[12]的方法处理鸡肺。
鸡肺脱脂:取一定量的新鲜鸡肺,先用清水浸泡并剔除大体积脂肪块,再冲洗三次除去表面杂质。匀浆后置于烧杯以料液比1∶9 (V/V)加入异丙醇溶液并充分搅拌,4 ℃下静置24 h,然后10000 r/min离心10 min取沉淀,用蒸馏水冲洗至中性,充分沥干后-18 ℃冷冻保存,备用。
去除鸡肺中的非胶原蛋白成分:称取脱脂鸡肺80 g,用0.1 mol/L的NaHCO3溶液(1∶10,W/V)在20 ℃下连续磁力搅拌8 h以去除杂质和色素(非胶原成分),取10000 r/min离心10 min后的沉淀物,用蒸馏水反复洗涤3次,充分沥干后在-18 ℃冷冻保存,备用。
酸法提取:准确称量冻干的除杂鸡肺样品1.0 g,以料液比1∶90 g/mL加入0.5 mol/L的乙酸溶液再置于水浴摇床中20 ℃下提取24 h。
超声辅助酸法提取:准确称量冻干的除杂鸡肺样品1.0 g,以料液比1∶90 g/mL加入0.5 mol/L的乙酸溶液,365 W超声处理10 min,然后置于20 ℃水浴振荡器中320 min。
1.2.2 鸡肺胶原蛋白氨基酸组成分析 参照国标GB/T 5009.124-2003,将20 mg胶原蛋白样品溶解于2 mL 6 mol/L HCl溶液中,水解在110 ℃条件下进行24 h,并用氨基酸自动分析仪测定水解产物。
1.2.3 紫外光谱扫描分析 用0.5 mol/L乙酸溶液溶解适量胶原蛋白样品,10000 r/min离心20 min,取上清液扫描紫外吸收光谱。扫描范围在190~400 nm,光谱间隔为1.0 nm。
1.2.4 SDS-PAGE分析 参照Matmaroh等[13]的方法。用12%的分离胶和5%的浓缩胶进行电泳。将20 μL样品(用0.5 mol/L的乙酸溶解鸡肺胶原蛋白样品,料液比为5 mg/mL)与5 μL上样缓冲液混合,沸水浴5 min,12000 r/min离心5 min,取20 μL处理后的样品上样。电泳先在80 V进行约20 min;然后在120 V进行约1.5 h。电泳结束后用考马斯亮蓝R-250染色20 min,然后用脱色液脱色至条带可以清晰分辨为止。
1.2.5 傅里叶红外光谱分析 参照GB/T 6040-2002的方法,用傅立叶变换红外光谱仪扫描。将适量样品和KBr混匀后研磨成粉末状,取适量压片后放入样品室,用干燥KBr做背景扫描。扫描区间在500~4000 cm-1,分辨率设置为2 cm-1。
1.2.6 X-射线衍射分析 使用射线衍射仪测定,X-射线源是管电压为30 kV 的Cu靶Kα射线,管电流为10 mA,设置λ=0.154 nm,扫描速度为0.06 °/s,扫描范围在5~35 °(2θ)。
1.2.7 粒径分布 用0.5 mol/L乙酸溶解蛋白样品浓度至1.0 mg/mL,缓慢加入石英比色皿中,设置参数后用马尔文激光粒度分析仪扫描。取3次连续测试的平均值作为胶原蛋白样品的最终粒径分布。
1.2.8 扫描电子显微镜(SEM) 将冷冻干燥后的样品固定在载物台上,经离子溅射喷金处理4 min后,在加速电压为5.0 kV条件下,用扫描电子显微镜观察不同放大倍数下胶原片的横截面特征,并比较表面微观结构异同。
1.2.9 溶解性 参照陈日春[14]的方法测定胶原蛋白的溶解性。
将冻干胶原蛋白样品用0.5 mol/L乙酸配制成3 mg/mL的溶液,取8 mL至50 mL离心管中,用6 mol/L NaOH或6 mol/L HCl调节pH分别为1、2、3、4、5、6、7、8、9、10。加入蒸馏水至体积为10 mL,在4 ℃条件下振荡30 min,10000 r/min离心15 min。用考马斯亮蓝法测定溶解蛋白质含量。
分别取5 mL 6 mg/mL的胶原蛋白溶液,再分别加入5 mL浓度为0、2%、4%、6%、8%、10%和12%的NaCl溶液,分散液在4 ℃振荡30 min,10000 r/min离心15 min。用考马斯亮蓝法测定溶解蛋白质含量。
1.2.10 吸湿性和保湿性 参照季文静等[15]的方法测定胶原蛋白的吸湿、保湿性。
吸湿性测定:准确称取0.1 g冻干胶原蛋白于玻璃培养皿中,再置于相对湿度(RH)60%,温度20 ℃的恒温恒湿箱中。分别称量放置2、4、6、8、10、12、24 h后样品的质量。吸湿率的计算公式为:

式(1)
式中:Wo为样品吸湿前质量(g);Wn为样品吸湿后质量(g)。
保湿性测定:准确称取0.1 g冻干胶原蛋白于玻璃培养皿中,加入10%的水,再置于相对湿度(RH)25%,温度20 ℃的恒温恒湿箱中。分别称量放置2、4、6、8、10、12、24 h后样品的质量。保湿率的计算公式为:

式(2)
式中:Ho为放置前水分质量(g);Hn为放置后水分质量(g)。
1.3 数据处理

2 结果与分析
2.1 鸡肺胶原蛋白的氨基酸分析
根据表1氨基酸结果分析可知,两种方法所得的胶原蛋白氨基酸组成基本相似。常规酸提的胶原蛋白中氨基酸总量为90.02%,超声辅助酸提的胶原蛋白氨基酸总量为93.44%。必需氨基酸分别占总量的16.83%和19.36%。甘氨酸含量所占比例最大,分别占氨基酸总量的24.12%和23.93%。甘氨酸和胶原蛋白超螺旋结构的最终形成有密切的关系,使三股螺旋的α链紧密地结合在一起[16]。亚氨基酸由脯氨酸和羟脯氨酸组成,含量为19.74%和22.28%,对胶原的热稳定性起重要作用。另外,丙氨酸、精氨酸、谷氨酸和天冬氨酸含量较高,这些氨基酸对胶原蛋白的功能特性具有重要作用。蛋氨酸含量较少,不含有L-半胱氨酸和色氨酸,与卢昭[17]的研究结果相一致。
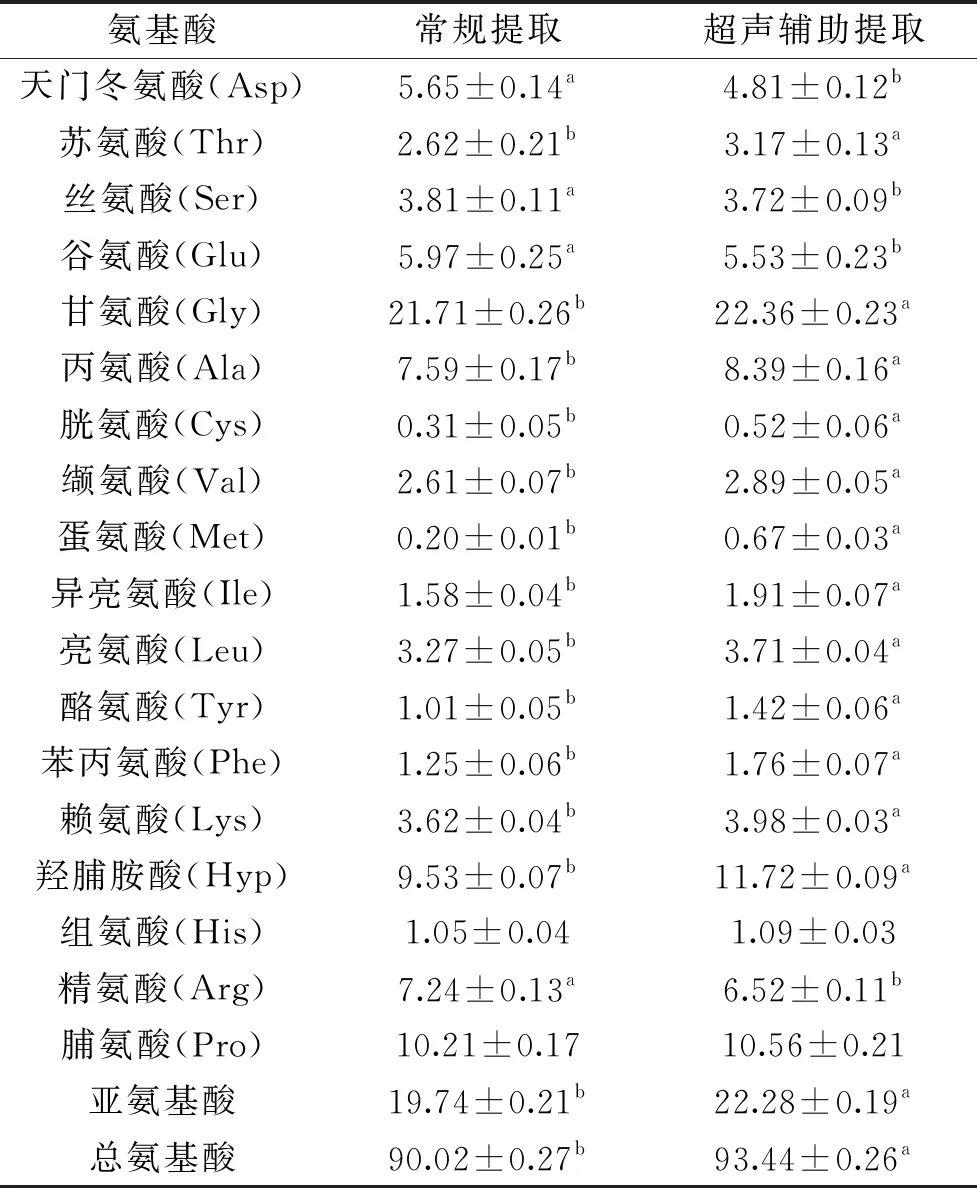
表1 常规提取和超声辅助提取胶原蛋白氨基酸分析(%)
2.2 紫外光谱分析
胶原蛋白结构中含有在紫外区域吸收的发色团。UV光谱扫描结果如图1所示,超声辅助酸提胶原蛋白的最大吸收峰在224.9 nm处,酸提胶原蛋白的最大吸收峰在229.0 nm处。这主要归因于胶原蛋白分子中的肽键C=O的n→π*跃迁,在220 nm左右通常具有强烈的紫外吸收[18]。蛋白质一般都含有Try、Tyr和Phe,它们分子中都含有共轭双键,属于敏感的发色基团。其中Try在280 nm波长处吸收峰最强,因此大多数蛋白质在280 nm处有较强的吸收峰[19]。而胶原蛋白结构比较特殊,几乎不含有Try,因此可通过检测280 nm波长处的吸光值来判断胶原蛋白的纯度[20]。在该图中,超声辅助酸提的胶原蛋白在280 nm处具有较弱的吸收峰,这与胶原的吸收特性相一致,而酸提的胶原蛋白在275.1 nm处有较小的吸收峰,这可能是由于分子内部仍含有Tyr残基,存在着共轭双键引起的。

图1 鸡肺胶原蛋白的紫外光谱图
2.3 SDS-PAGE分析
由图2可知,两种方法提取的鸡肺胶原蛋白均由140 kDa的α1链、125 kDa的α2链、较高分子量的少量γ链和β链组成,与氨基酸分析结果相一致。该肽链组成与胶原蛋白的肽链组成特征高度一致,说明所提取的蛋白质属于胶原蛋白[21],与氨基酸分析结果相一致。而在α2链条带下未发现其余明显的条带,说明所提取的胶原蛋白纯度较高,蛋白构象稳定,基本结构保存较好,超声辅助酸提没有水解胶原蛋白成多肽和小分子胶原蛋白,与张强等[22]的研究结果相符。

图2 鸡肺胶原蛋白的SDS-PAGE图
2.4 鸡肺胶原蛋白的红外光谱分析
天然胶原蛋白含有独特的三螺旋构型,结果显示鸡肺胶原蛋白具有典型的胶原蛋白傅里叶变换红外光谱特征吸收峰,即在酰胺A、B及Ⅰ、Ⅱ和Ⅲ带具有明显的特征吸收[23]。在红外光谱的酰胺A带通常吸收范围是3400~3440 cm-1,这主要是由于自由的N-H键伸缩振动引起,当N-H基团参与多肽中的氢键形成时,其波数会蓝移,一般在3300 cm-1左右[24]。由图3可知,酸提和超声辅助酸提的胶原蛋白酰胺A带的特征吸收分别为3274.06和3273.57 cm-1,特征吸收峰位置基本一致,两种方法所提取的胶原蛋白中均存在氢键。酰胺I带是由C=O伸缩振动引起,吸收峰一般不受肽链侧基的影响,其振动频率和胶原蛋白的有序程度相关,取决于肽链的构型,酰胺I带对三螺旋结构的变化非常敏感[25]。酸提和超声辅助酸提的胶原蛋白酰胺I带的吸收峰为1644.02和1625.22 cm-1,符合通常的吸收波数1630~1680 cm-1。酰胺II带是由于N-H弯曲振动和CN伸缩共振吸收引起,酸提和超声辅助酸提的胶原蛋白酰胺II带的吸收峰分别为1540.85和1532.65 cm-1,在胶原蛋白酰胺Ⅱ带的吸收峰一般范围1500~1600 cm-1之间。酸提和超声辅助酸提的胶原蛋白在1239.04和1236.15 cm-1处出现了酰胺III带的特征吸收,且在1251和1500 cm-1的酰胺II带和酰胺III带间又出现了吸收带,也表明了样品的螺旋结构保持较好[26]。红外光谱分析结果表明所提取鸡肺胶原蛋白的三股螺旋结构保持较好,在提取过程中未被破坏。

图3 鸡肺胶原蛋白的红外光谱图
2.5 鸡肺胶原蛋白的X-射线衍射光谱
所提样品胶原蛋白的X-射线衍射光谱如图4所示,超声辅助酸提和常规酸法提取的胶原蛋白均有三个衍射峰且吸收峰位置一致。第一个峰位置在7.6 °,该峰表明了胶原纤维分子链间的距离;第二个峰出现在22.3 °,该峰相对宽大,它是由于胶原蛋白分子内部复杂的结构层次而引起的漫散射所产生;第三个峰是一个尖且窄的峰,出现位置在31.5 °,该峰表示胶原蛋白分子三螺旋结构上相邻氨基酸残基之间的距离[27]。

图4 鸡肺胶原蛋白的X-射线衍射光谱
根据X-射线的波长(λ=0.154)和θ角,代入布拉格方程2dsinθ=λ计算出各个衍射峰所对应的d值。
由表2可知,酸提和超声辅助酸提的鸡肺胶原蛋白分子链间的距离分别为0.78和0.77 nm,相较比目鱼纤维分子链间距略小[28],说明提取的鸡肺胶原蛋白分子链间的范德华力和氢键作用较大,分子链间距离较小,排列较为紧凑。在胶原蛋白的三螺旋结构中,螺距为0.96 nm,每圈螺旋含3.3个氨基酸残基,沿螺旋中心轴方向相邻氨基酸残基的间距为0.29 nm[29],计算结果得到第三个峰的d值0.30和0.29 nm与此相接近,也与胡子鲶鱼皮酸溶性胶原蛋白和鳕鱼酸溶性胶原蛋白测得的数据相似。以上结果说明超声辅助酸提的鸡肺胶原蛋白较好地保持了原有的螺旋结构。

表2 胶原蛋白的X-射线衍射峰对应d值
2.6 鸡肺胶原蛋白的粒径分布
图5是常规酸提的鸡肺胶原蛋白和超声辅助酸提的鸡肺胶原蛋白的粒径分布图,由图5中可看出,超声辅助酸提的胶原蛋白主要分布在295 nm左右,而常规酸提的胶原蛋白主要分布在340 nm左右。经过超声处理后所提取的胶原蛋白的整体粒径小于常规酸提的胶原蛋白。超声波产生的机械效应和空化效应使胶原蛋白中的以氢键结合的大分子断裂成小分子(肽链)[30]。小分子与大分子通过氢键作用重新结合,但整体粒径变小。超声辅助酸提的胶原蛋白在60 nm左右有小部分分布,可能是因为小分子肽链未能与大分子肽链形成氢键导致。说明超声处理对胶原蛋白的结构有破坏氢键并改变胶原蛋白聚集形态的作用。
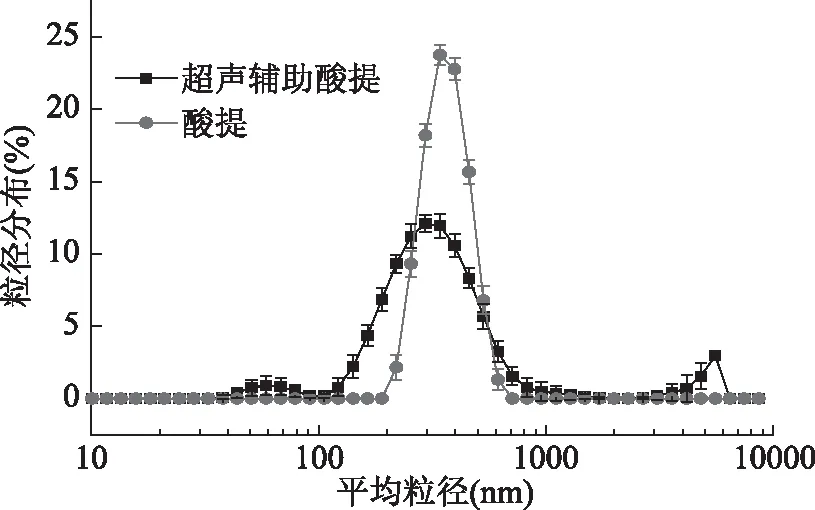
图5 鸡肺胶原蛋白的粒径分布
2.7 鸡肺胶原蛋白的扫描电镜
胶原蛋白的显微结构对实际应用有重要影响[31]。由图6可知,超声辅助酸提的鸡肺胶原蛋白在扫描后呈现出三维立体空间结构,由分布规则且均匀的丝状和薄片状的纤维相互交联而成。酸提的鸡肺胶原蛋白较超声辅助酸提的鸡肺胶原蛋白表面更细腻光滑,存在较少的折叠褶皱现象,这可能是超声处理有效地分散了蛋白质,使蛋白质结构变得疏松。但两种方式提取的胶原蛋白均以片状表面附着松散纤维状分布,与马鲛鱼胶原的显微结构类似[32],说明在提取过程中胶原蛋白的纤维结构得以保持。经超声处理的胶原蛋白可能更容易被加工利用,在食品、化妆品、生物医药材料等方面有更开阔的前景。

图6 鸡肺胶原蛋白的扫描电镜图
2.8 胶原蛋白的溶解性
2.8.1 pH对胶原蛋白溶解度的影响 图7表明了pH对胶原蛋白溶解度的影响。在酸性范围内,鸡肺胶原蛋白的溶解度较大,且在pH3附近达到最大值,随着pH的继续增加,胶原蛋白的溶解度开始下降,随着pH的继续增大,胶原蛋白的溶解度又开始增加。总体上胶原蛋白的溶解度随着pH的增加有先升高后下降再回升的趋势。胶原蛋白属于两性电解质,其溶解度的大小和等电点联系紧密,胶原蛋白一般在pH6~9时具有等电点。在等电点附近,胶原蛋白所带的净电荷几乎为零,分子间由于没有静电斥力的作用而发生聚集然后沉降,所以溶解度较小。当偏离等电点时,胶原蛋白带有一定量的净电荷,分子之间因为静电斥力不易发生聚集和沉降,分散性较好,因此溶解度较大。图中在pH3时蛋白质分子的残基所带净电荷最多,因此胶原蛋白溶解度最大[33]。酸提鸡肺胶原蛋白等电点为7,在此pH下溶解度最小;超声辅助酸提的胶原蛋白等电点为6,在此pH6下溶解度最小。这可能是由于超声波产生的空化效应和机械效应改变了蛋白质颗粒大小和氢键组成,从而影响了等电点的大小。
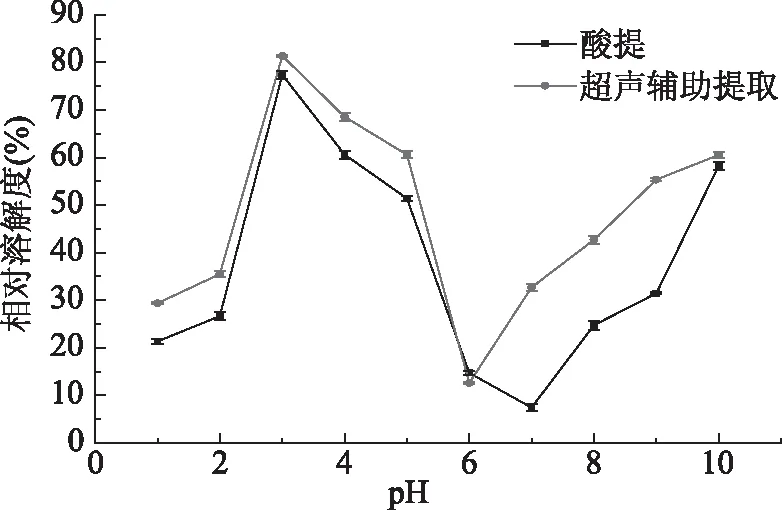
图7 pH对胶原蛋白溶解度的影响
2.8.2 NaCl浓度对胶原蛋白溶解度的影响 两种方法提取的胶原蛋白在不同浓度NaCl中的溶解性如图8所示。NaCl浓度在0~2%时胶原蛋白的溶解度相对较高且保持稳定,仅有小范围的浮动。当NaCl浓度继续增加,酸提和超声辅助酸提的胶原蛋白的溶解度均持续明显下降。胶原蛋白在NaCl溶液中存在着盐溶和盐析作用,在不同浓度下出现的溶解度变化是两者共同作用的结果。当NaCl浓度较低时,盐离子能够与胶原蛋白分子结合,使胶原分子表面所带的正电荷增加,分子间斥力变大,胶原蛋白结构保持稳定,溶解度较大;当NaCl浓度较高时,强极性的盐离子争夺与胶原蛋白分子结合的水分子,破坏分子周围的水化膜,使胶原脱水而析出,导致溶解度的降低[34]。超声辅助酸提的胶原蛋白溶解度要略高于常规酸法提取的胶原蛋白,这可能是由于超声效应使蛋白质颗粒变小,溶解度增大。
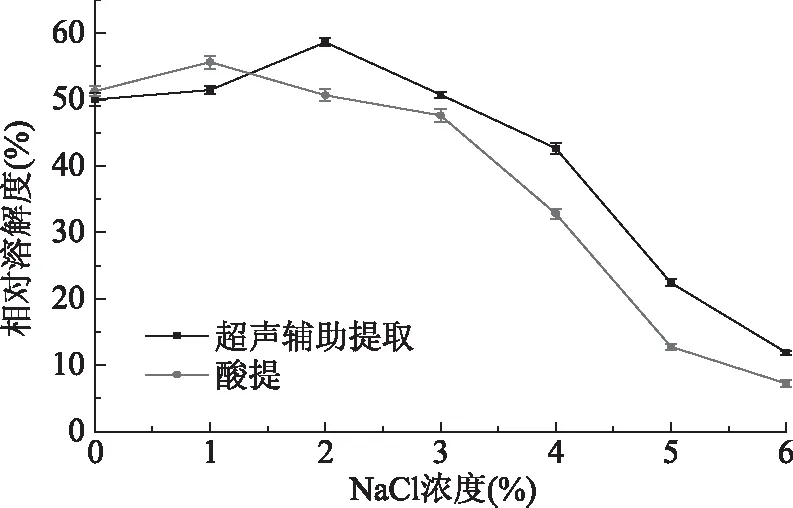
图8 NaCl浓度对胶原蛋白溶解度的影响
2.9 鸡肺胶原蛋白的吸湿保湿性
2.9.1 鸡肺胶原蛋白的吸湿性 图9是超声辅助酸提胶原蛋白和酸提胶原蛋白24 h内在20 ℃、相对湿度60%的吸湿性曲线。从图9中可看出,超声辅助酸提胶原蛋白的吸湿能力明显高于酸提胶原蛋白,在24 h时超声辅助酸提胶原蛋白的吸湿性达到酸提胶原蛋白的1.25倍,说明超声波处理可以提高胶原蛋白的吸湿能力。胶原蛋白的吸湿性与分子中的亲水基团有关,经超声辅助酸提的胶原蛋白,可能由于超声波的机械效应和空化效应,蛋白质结构变得疏松,分子内部更多的亲水基团暴露,使得胶原蛋白更容易与水分子结合,吸湿性增强。

图9 鸡肺胶原蛋白的吸湿性
2.9.2 鸡肺胶原蛋白的保湿性 胶原蛋白中富含甘氨酸、丙氨酸、天门冬氨酸等游离氨基酸,它们是天然保湿因子的主要成分,可起到保持肌肤水分的作用[35]。从图10可以看出,在RH=25%的一定时间内,超声辅助酸提胶原蛋白的保湿能力明显高于酸提胶原蛋白,在24 h时超声辅助酸提胶原蛋白的保湿性是酸提胶原蛋白的1.17倍。参与保水性变化的主要是游离水,游离水的保持同蛋白质的空间结构、静电荷量等有密切关系,当蛋白质呈网络状疏松结构时,可以包容更多水分,胶原蛋白的三螺旋结构又起到很好的保水作用[36],经过超声辅助酸提得到的胶原蛋白持水性能增加可能是因为超声波对蛋白质呈网络状疏松结构起到了一定的作用[37],同时又使得蛋白质分子内部亲水基团暴露,能与更多的水分子结合。

图10 鸡肺胶原蛋白的保湿性
3 结论
常规提取和超声辅助酸提的胶原蛋白中甘氨酸含量最高,分别为24.12%和23.93%,亚氨基酸其次,分别为19.74%和22.28%。SDS-PAGE和紫外光谱显示提取的胶原蛋白纯度较高,结构保持较好。傅里叶变换红外光谱和X-射线衍射光谱说明超声辅助酸提和常规酸法提取的胶原蛋白都较好地保存了胶原蛋白的三螺旋结构;粒径分布、扫描电镜分析和胶原蛋白的溶解性表明了超声辅助酸提时超声波的空化效应和机械效应能够改变蛋白质的颗粒大小和氢键组成,蛋白质结构更为疏松,使得胶原蛋白的吸湿性和保湿性均有明显增强。
本试验表明了鸡肺可作为胶原蛋白的来源,超声辅助酸法提取能够在保持了胶原蛋白结构的基础上,增强吸湿保湿性。超声辅助酸法提取能有效降低设备的酸腐蚀,节约能耗,是较为可行的方法。所提取的胶原蛋白经加工可用于食品、化妆品、生物医药等领域,具有广阔的发展前景和潜在的商业应用。该研究为后续鸡肺胶原蛋白结构和理化性质的进一步研究提供了一定的数据基础。

