杂合抗菌肽MeHNP1真核表达载体的构建与初步表达
于 婷,王思霁,刘 畅,崔敬爱
(吉林农业大学食品科学与工程学院,吉林长春 130118)
在分子水平上研究生物体对于外来病原体的防御系统,是目前生物化学和分子生物学科研究的热点问题。抗菌肽(AMPs)是一类热稳定性好且具有广泛抗菌特性的小分子肽类物质,主要由生物体的免疫防御系统产生[1]。与传统抗生素相比,抗菌肽表现出更稳定和更广泛的抗菌活性,除了对细菌、真菌的抑制作用外,还能够抑杀一些病毒和原虫[2-3]。由于抗菌肽分子量较小,通过化学方式获得的天然抗菌肽存在很多弊端,且天然抗菌肽的抑菌活性与溶血活性会造成抗菌肽在实际应用中的局限性,如抗菌肽在抑制细菌和病毒的同时也可能杀死正常的宿主细胞,抗菌肽杀死病原菌是通过胞内作用靶点与病原菌的DNA、RNA结合,从而抑制蛋白质的合成或者与质膜相互作用破坏病原菌的细胞膜[4-6]。有研究人员证实,通过移动、替换、插入或去除氨基酸残基能够提高天然抗菌肽的稳定性,同时可以保留或者提升抗菌肽的抗菌活性并降低毒性[7-8]。因此根据天然抗菌肽的特性进行全新的抗菌肽设计,是未来抗菌肽研究的一个重要方向[9-10]。
Melittin是由意大利蜜蜂毒中提取的一种由26个氨基酸残基组成的溶血性较强的a-螺旋结构肽[11-12],可以很好地抵抗革兰氏阳性菌和革兰氏阴性菌的侵害,但同时具有较强的溶血活性,易引起动物细胞溶血,因此严重限制了其在实际中的应用[13]。人体防御素是抗微生物和病毒类的一种抗菌肽,最早是在人的多形核中性粒细胞中发现的,能够有效地抵抗革兰氏阳性菌、革兰氏阴性菌、真菌及病毒的侵害,同时不具有溶血活性,是先天免疫系统中抗微生物的第一道防线[14-17]。本研究基于蜂毒肽(Melittin)和人体防御素(HNP-1)的氨基酸序列的空间结构特点,选取它们的活性片段进行杂合,设计出杂合抗菌肽Me-HNP1基因,并将其连接至高效表达载体pPICZa A上,通过电转化的方式转入巴斯德毕赤酵母内,以甲醇作为诱导剂进行诱导表达,为抗菌肽的研究奠定了基础。
1 材料与方法
1.1 材料与仪器
穿梭表达质粒pPICZa A、大肠杆菌E.coliTop10、毕赤酵母菌 由吉林农业大学食品工程与生物化学教研室保存;限制性内切酶EcoRI、NotI、T4DNA连接酶、ExTaq、DNA聚合酶、d NTPs、DNA回收试剂盒、10000DNA marker、蛋白marker、诱导剂、Tricine-SDS-PAGE试剂、质粒小量提取试剂盒 均购于Solarbio公司;引物 由上海生工公司合成;其他试剂 均为国产分析纯。
Applied Biosystems7070型ABIPCR扩增仪 上海创萌生物科技有限公司;JY04S-3C型凝胶成像分析系统 北京东方电子;DYY-11型电泳仪 北京六一设备厂;HNY2102c型恒温培养振荡器 天津市欧诺仪器仪表有限公司;JS-400-A型恒温金属浴 上海培清科技;TGL-16型高速台式离心机 上海安亭科学仪器厂;1652100型电转化仪 伯乐 biorad;GL-16G-Ⅱ型低温高速冷冻离心机 安亨仪器设备公司。
1.2 实验方法
1.2.1 Me-HNP1基因的设计与合成 蜂毒肽分子含有3个K和2个R残基且带有6个正电荷,因此蜂毒肽是带有净正电荷的碱性肽。有科研人员研究了由蜂毒肽C端的15个氨基酸组成的多肽及其类似物发现,其溶血性是蜂毒肽的1/300[17-19]。根据抗菌肽基因库(http://aps.unmc.edu/AP/main.php)得到蜂毒肽(Melittin)氨基酸序列:GIGAVLKVLTTGL PALISWIKRKRQQ和人体防御素(HNP-1)的氨基酸序列:ACYCRIPACIAGERRYGTCIYQGRLWAFCC通过BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)对比抗菌肽基因序列,利用Prot Param、Antheprot、ProtScale、EMBOSS pepwindows等生物信息学工具对其进行理化分析,最终确定杂合抗菌肽的氨基酸序列。根据巴斯德毕赤酵母密码子的选择偏爱性[20]编码其基因以提高其在毕赤酵母中的表达量,利用Primer 5.0软件设计杂合抗菌肽Me-HNP1上下游引物,根据分泌表达载体pPICZaA自身结构特点,在序列两端分别引入EcoRI和NotI酶切位点,引物见表1。以Melittin和HNP-1基因序列作为模板,F1和R1、F2和 R2分别作为Melittin和HNP-1的上下游引物PCR扩增获得Melittin和HNP-1基因序列,然后以获得的基因片段为模板,F3和R3为上下游引物,PCR扩增得到目的基因Me-HNP1基因片段,全长149 bp。

表1 合成Me-HNP1基因的引物序列
采用PCR扩增方法合成杂合抗菌肽基因,50 μL反应体系中加入模板2 μL、F3 1 μL、R3 1 μL、Ex Taq DNA聚合酶1 μL、dNTPs 4 μL、10×Buffer 6 μL、去离子水35 μL,94 ℃预变性5 min,95 ℃变性30 s,67 ℃退火30 s,72 ℃延伸30 s,共30个循环,72 ℃延伸10 min,4 ℃保存。
1.2.2 目的基因的回收与纯化 取经过PCR扩增后得目的基因5 μL与6×loading buffer混合均匀,进行2.0%琼脂糖凝胶电泳。将验证成功的目的基因置于紫外灯下切下所需片段胶体于微量离心管内称重,然后加入三倍体积的Buffer DE-A,均匀混合,75 ℃加热完全融化,再加入1.5倍体积的Buffer DE-B和异丙醇,12000 r/min离心2 min,去除滤液,加入洗涤液12000 r/min离心min,加入脱盐液重复操作,12000 r/min离心1 min,最后加入洗脱液12000 r/min离心1 min,收集离心管内液体,-20 ℃保存待用。
1.2.3 表达载体pPICZa A-Me-HNP1的构建 表达载体pPICZa A-Me-HNP1的构建策略如图1。

图1 重组质粒pPICZαA-Me-HNP1
将杂合抗菌肽Me-HNP1基因与载体pPICZa A在限制性内切酶EcoRI和NotI作用下分别进行双酶切,酶切后产物于16 ℃条件下过夜连接。
1.2.4 目的基因转化与基因测序 采用常规方式[21]制备大肠杆菌感受态细胞并进行目的基因的转化。采用Zeocin筛选法[22],筛选克隆转化子,送往上海生工进行基因测序。
1.2.5 构建重组酵母GpMe-HNP1 将测序正确的质粒线性化处理后通过电转化的方式转入提前制备好的酵母感受态细胞内,电转化的条件为:U=2000 V,T=5 ms电击两次。电击结束后,立即于超净台内加入已灭菌预冷的山梨醇溶液(1 mol/L)1 mL混合均匀,转移至小量离心管中,设置28 ℃金属浴1.5 h,取100 μL转化子均匀的涂布与YPDS选择性培养基(含有100 μg/mL的Zecoin)中,30 ℃避光条件下培养3 d。得到的菌株继续在含有Zecoin浓度为200、300 μg/mL的YPDS培养基中培养,培养后的菌株即为高拷贝、甲醇诱导的His+Muts表型的目的菌株,用于后续诱导表达蛋白实验。
1.2.6 重组酵母GpMe-HNP1的诱导表达 将1.2.5中构建得到的重组酵母GpMe-HNP1和含有空质粒的酵母菌GS115分别接种于5 mL的YPDZ培养基中,32 ℃,200 r/min 摇床中避光振荡培养,在200 mL BMGY培养基中加入1%体积的上述菌液,32 ℃,220 r/min避光过夜培养约16 h测其OD600 nm值在2~6之间时停止培养,在已灭菌的离心管中加入上述菌液5000 r/min,离心8 min。收集离心后菌体沉淀,在摇瓶中加入100 mL BMMY培养基重悬后的菌体沉淀,在30 ℃、250 r/min条件下培养7 d,每24 h取出1 mL培养液并补加甲醇,使甲醇浓度为0.5%~1%,取出的培养液4 ℃,12000 r/min,离心5 min。即可得到诱导表达的粗蛋白。
1.2.7 目的蛋白纯化 通过凝胶过滤色谱法[23]将得到的粗蛋白进行纯化处理。
1.2.8 Tricine-SDS-PAGE电泳 由于本研究中杂合抗菌肽的相对分子量较小,故采用Tricine-SDS-PAGE的方式进行蛋白电泳[24]。
2 结果与分析
2.1 目的基因Me-HNP1的扩增
目的基因在2%琼脂糖凝胶电泳验证下,在149 bp位置出现一条与预期结果相同的特异性条带,如图2。

图2 目的基因2%琼脂糖凝胶电泳
2.2 重组克隆载体的双酶切验证
将阳性转化子采用solarbio质粒小量提取试剂盒提取出pPicza-A-Me-HNP1。通过1%琼脂糖凝胶电泳验证限制性内切酶EcoRI/NotI双酶切后得到的产物,结果如图3所示,出现两条清晰条带,一条约149 bp,说明杂合抗菌肽Me-HNP1基因已成功插入表达载体。
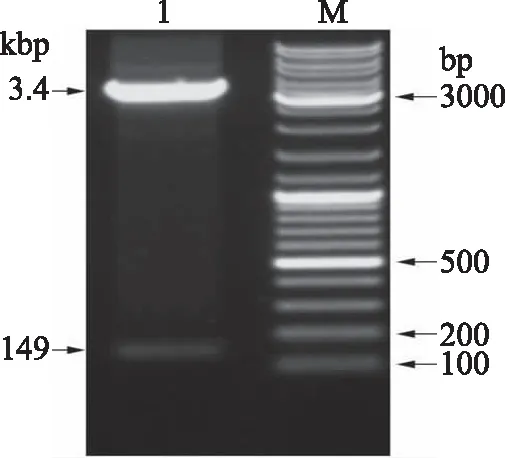
图3 重组质粒双酶切的鉴定
2.3 重组菌表达产物的Tricine-SDS-PAGE鉴定
将成功转入目的基因的毕赤酵母GS115诱导表达后得到的粗蛋白经纯化处理后进行Tricine-SDS-PAGE电泳,结果如图4,由图可知,诱导表达后的样品在5 kDa处有一条清晰地条带,与实验预期相符,而空载体表达产物泳道并无条带出现,表示杂合抗菌肽Me-HNP1成功于毕赤酵母中表达。

图4 蛋白分离纯化后的Tricine-SDS-PAGE图
2.4 杂合抗菌肽理化参数对比
通过Protparam在线软件对两种抗菌肽理化参数分析对比如表2。

表2 抗菌肽理化参数对比
通过表格可以看出,改造后的杂合抗菌肽Me-HNP1与HNP1相比,正电荷数、理论PI值、脂溶性、半衰期均有所增加。基本符合作为一种具有潜力的新型抗菌肽的特征。
2.5 杂合抗菌肽疏水性结果分析
利用Protscale预测氨基酸疏水性结果如图5。

图5 Prot Scale Me-HNP1疏水性预测结果
正值表示疏水,负值表示亲水,该蛋白亲水性较强,最大值为1.633位于第5位氨基酸处,最小值为-2.333位于第11位氨基酸处。
3 讨论
随着这些年来抗生素在人们生活中的广泛使用,在带给人们生活巨大效益的同时也带来了很多安全隐患,比如,使越来越多的细菌产生抗药性,并以惊人的速度发展。而天然抗菌肽是从动植物体内发现的一种作用机制独特,且不容易产生抗药性的小分子肽类物质,作为新型抗菌物质有着广阔的前景。抗菌肽的功能与其结构息息相关,因此在设计与合成新型抗菌肽时应充分考虑其空间结构特征[25]。本研究将Melittin和HNP-1两种不同空间构型的抗菌肽通过空间结构预测,预期实现杂合抗菌肽Me-HNP1的高抗菌活性和低溶血性。大量研究表明,抗菌肽的正电荷数、两亲性、疏水性等对抗菌肽的抗菌活性影响较大,因此提高其正电荷数和两亲性等结构参数有利于提高其抗菌活性[26]。本研究杂合抗菌肽Me-HNP1与人体防御素HNP-1相比,理化性质明显提高,通过预测可知,其具有成为优秀抗菌肽潜力,并通过人工合成方式成功得到杂合抗菌肽Me-HNP1。
表达系统的选择对于基因工程的研究起到至关重要的作用,虽然目前对于大肠杆菌类原核表达系统的研究已经较为深入,但是基于抗菌肽对于细菌具有较强的抑杀作用,不适宜在原核系统中表达,其表达产物主要以包涵体形式存在,表达后的分离纯化过程较为复杂,需要进行变性复性以及二次酶切,步骤较繁琐,难以直接获得大量具有天然活性的抗菌肽[27]。而酵母作为真核表达系统,不仅具有真核表达系统的优点,同时具有原核表达系统的优点,繁殖速度快,表达量高等,因此本研究选择毕赤酵母作为表达系统,大大提高了其蛋白表达量。而pPICZa A为毕赤酵母表达系统中常用的一种穿梭型质粒具有诸多优点,5′片段含有的AOX1启动子可以对分泌表达进行严格的调控,同时C-端含Myc和His标签,可以用于检测和纯化重组蛋白[28]。为蛋白的表达和纯化提供了极大的便利。
目前抗菌肽在食品方面的应用主要集中在植物性食品和动物性食品中,通过在果蔬类食品中转入抗菌肽基因进而提高蔬果对于外来病原微生物的抵抗能力,在一定程度上降低了农药的使用率,从而给人们提供一个更加安全可靠的是食品环境。相比较而言,抗菌肽在动物性食品中的应用研究较多,主要是由于抗生素类药物在动物性食品中的应用仍然存在许多弊端和不确定性,因此大量学者致力于研发一种新型替代药物从而降低动物类食品中的危害性,研究表明将抗菌肽以动物饲料添加剂或兽药的方式饲喂动物可以有效的减少动物的发病率,降低抗生素类药物的使用,从而提高食品的安全性[29-30]。
4 结论
通过研究表明,本研究设计合成的杂合抗菌肽Me-HNP1基因已在穿梭质粒pPICZa A中成功构建,利用生物信息学软件预测可知杂合抗菌肽Me-HNP1具有很好的抑菌潜力,通过电转化的方式使杂合抗菌肽Me-HNP1基因转入巴斯德毕赤酵母中,并以甲醇为诱导剂成功在毕赤酵母中表达。

