复合酶法提取黄秋葵可溶性膳食纤维的工艺优化及其理化特性、结构表征
梁文康,苏 平,魏 丹
(浙江大学生物系统工程与食品科学学院,浙江杭州 310058)
黄秋葵(Abelmoschusesculentus(L.)Moench)为锦葵科、秋葵属的草本植物,原产自非洲、南亚等热带或亚热带地区,引入中国后,在江浙、两湖和广东等地区被广泛种植[1]。黄秋葵是目前广受青睐的新型蔬菜,不仅口感嫩滑、味道鲜美,而且具有很高的营养价值,黄阿根等[2]测定黄秋葵果荚中的蛋白质和总糖含量均接近20%,黄酮物质的含量超过2%。膳食纤维是一类重要的生物活性物质,被称为第七大营养素,王琰等[3]证实黄秋葵果荚中总膳食纤维含量高达40%,其中可溶性膳食纤维(SDF)达到膳食纤维总含量的20%以上。黄秋葵果荚的提取物具有较好的抗氧化性,以及降低血糖、缓解机体疲劳等多种生理功能[4-7],可作为膳食纤维的良好来源,用于制备具有多种功能特性的膳食纤维食品。
膳食纤维的常用的提取方法有酸碱提取法[8]、酶解法[9]和微生物法[10]等。酸碱提取法成本低,操作简便,应用最广泛,但易造成溶剂残留,且强酸或强碱环境会造成纤维素、半纤维素等组分的损失,使提取得到的膳食纤维的生理活性受到影响[8]。酶提取法虽然成本略高于化学溶剂法,但不容易破坏被提取物的结构,使其功能性得到良好的保持[11]。目前关于黄秋葵膳食纤维提取的研究较少[12],常用的方法为酸碱提取法。韦鹭等[12]对酸水解法提取黄秋葵膳食纤维的工艺进行优化,最高得率为12.65%。而黄秋葵膳食纤维的酶法提取尚未见报道。
因此本研究以黄秋葵果荚为原料,采用酶解法提取黄秋葵可溶性膳食纤维,通过响应面实验探究黄秋葵可溶性膳食纤维得率最高时的工艺参数。对提取产物进行结构表征,探究提取前后黄秋葵可溶性膳食纤维的结构变化,同时测定黄秋葵可溶性膳食纤维的理化性质,以此为基础可进一步研究黄秋葵可溶性膳食纤维的生理功效,也为黄秋葵保健食品的开发提供科学依据。
1 材料与方法
1.1 材料与仪器
黄秋葵 由嘉兴市捌零壹农业生物科技有限公司提供,产自浙江嘉善;α-淀粉酶(4000 U/g)、糖化酶(10万U/g)、中性蛋白酶(10万U/g) 上海源叶生物科技有限公司;乙醇、盐酸、氢氧化钠(均为分析纯) 国药集团化学试剂有限公司;花生油 市售。
JA1003N电子天平 上海菁海仪器有限公司;PH070A鼓风干燥箱 上海一恒科技有限公司;UV-2550紫外可见分光光度计 日本Shimadzu公司;Multiskan GO全波长酶标仪 美国Thermo公司;Nicolet iS10傅立叶红外光谱仪 美国赛默飞世尔科技公司;D8 Advance X射线衍射仪 德国布鲁克科技有限公司;SU-8010 冷场发射扫描电子显微镜 日本日立公司;TGL20M高速冷冻离心机 湖南凯达科学仪器有限公司。
1.2 实验方法
1.2.1 黄秋葵SDF的提取
1.2.1.1 工艺流程 黄秋葵果荚→干燥→粉碎→复合酶酶解→灭酶→蛋白酶酶解→灭酶→离心→收集滤液→醇沉→收集沉淀→真空冷冻干燥→黄秋葵SDF
1.2.1.2 操作要点 a.预处理:黄秋葵果荚清洗后切分成2~3 cm的小段,55 ℃热风干燥12 h,粉碎后过40目筛,密封后放置于干燥器中备用。
b.复合酶酶解:参考文献[13]中使用α-淀粉酶(最适pH为6.0~7.0)和糖化酶(最适pH为4.5)复合提取可溶性膳食纤维的方法,准确称取充分干燥后的秋葵粉样品2.00 g,加入一定体积的蒸馏水,将溶液pH调节至6.5,加入一定量的α-淀粉酶和糖化酶等比例混合的复合酶,在适宜温度下的水浴中保持一段时间,期间不断搅拌;
c.灭酶:提取液放入100 ℃水浴中,灭酶5 min;
d.蛋白酶酶解:将提取液冷却至室温,调节pH至7.0,加入质量浓度为1.0%的蛋白酶,在50 ℃水浴中保持60 min,期间不断搅拌;
e.灭酶:蛋白酶处理后的提取液放入100 ℃水浴中,灭酶5 min;
f.醇沉:提取液离心,离心条件为5000 r/min,15 min。收集上清液,加入四倍体积的95%乙醇,静置12 h后过滤,收集滤渣,真空冷冻干燥后得到黄秋葵可溶性膳食纤维。
1.2.2 单因素实验 准确称取黄秋葵粉2.00 g,置于50 mL离心管中,以复合酶的质量浓度1.5%、复合酶酶解时间60 min,复合酶酶解温度60 ℃、料液比1∶20为基本条件,通过改变单一因素来探究其对黄秋葵SDF提取造成的影响。料液比分别为1∶15、1∶20、1∶25、1∶30、1∶35 g/mL;复合酶添加量分别为0.5%、1.0%、1.5%、2.0%、2.5%;复合酶酶解时间分别为20、40、60、80、100 min;复合酶酶解温度分别为40、50、60、70、80 ℃。具体步骤如1.2.1所述,研究各个因素对黄秋葵SDF提取得率的影响。
1.2.3 响应面试验 使用软件Design Expert 10.0,方法选用Box-Behnken,自变量为料液比(A)、复合酶添加量(B)、复合酶酶解时间(C)、复合酶酶解温度(D),响应指标即秋葵SDF得率。根据之前单因素试验的结果,确定了自变量的试验水平如下:
1.2.4 黄秋葵SDF得率的计算 计算公式为:
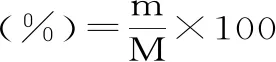
式(1)
式中:m为干燥后可溶性膳食纤维的重量(g);M为干燥后秋葵粉的重量(g)。
1.2.5 黄秋葵SDF理化性质测定
1.2.5.1 持水力的测定 持水力(water holding capacity,WHC)即在除重力、大气压力之外的外力作用情况下样品结合水分的能力。测定方法:准确称取1.00 g样品,加水30 mL,振荡均匀后在37 ℃水浴中放置12 h,以4000 r/min,离心15 min后称重,按照式(2)计算黄秋葵膳食纤维的持水力[14]:

式(2)
1.2.5.2 膨胀力的测定 膨胀力(swelling capacity,SC)即样品充分吸收水分后,所占的体积与未吸水前实际体积的差值。测定方法:准确称取2.00 g样品,置于100 mL量筒中,加蒸馏水60 mL,充分混合后在4 ℃下放置24 h,记录样品吸水前后的刻度值。按照式(3)计算黄秋葵膳食纤维的膨胀力[15]:
膨胀力(SC)=(样品吸水后刻度(mL)-初始刻度(mL))/样品粉重量(g)
式(3)
1.2.5.3 持油力的测定 持油力(oil holding capacity,OHC)即在不受除重力、大气压力之外的外力作用情况下样品结合油分的能力。测定方法:准确称取1.00 g样品,加花生油10 g,振荡均匀后在37 ℃水浴中放置12 h,以4000 r/min,离心15 min后称重,按照式(4)计算黄秋葵膳食纤维的持油力[16]:
持油力(OHC)=(样品结合油后重量(g)-样品粉重量(g))/样品粉重量(g)
式(4)
1.2.6 黄秋葵SDF的结构表征
1.2.6.1 扫描电镜观察显微结构 按照文献[17]中的方法对黄秋葵SDF及黄秋葵粉进行处理,使用扫描电镜观察黄秋葵SDF及黄秋葵粉的显微结构,观察在100倍和5000倍两个放大倍数下二者的表面形态。
1.2.6.2 傅里叶红外光谱分析 样品在50 ℃烘箱中干燥24 h,溴化钾粉末在105 ℃烘箱中干燥24 h。取2 mg样品和200 mg 溴化钾混合,在红外灯下充分研磨。将混合均匀的粉末压制成薄片,使用红外光谱仪扫描[18],扫描波数为400~4000 cm-1,分别记录黄秋葵SDF和黄秋葵粉的红外光谱曲线并分析。
1.2.6.3 X射线衍射分析 按照文献[19]中的方法进行样品的准备及分析参数的设置。样品在50 ℃烘箱中干燥24 h,使用X射线衍射仪分析,阳极靶为Cu,X射线波长λ=0.156 nm,工作电压40 kV,管流20 mA,扫描范围5°~70°,扫描间隔0.02°。分别记录黄秋葵SDF和黄秋葵粉的X射线衍射图谱并分析。
1.3 数据处理
所有数据均重复3次取平均值,使用SPSS 18.0进行单因素方差分析,使用Origin 8.0进行图表的制作与处理。数据采用平均值±标准差的形式表示。
2 结果与分析
2.1 酶解法提取黄秋葵SDF的单因素实验
2.1.1 料液比对黄秋葵SDF得率的影响 图1中,随着料液比的增加,黄秋葵SDF得率先增加而后趋于稳定。在料液比为1∶25 g/mL时,SDF得率最高,为7.95%。适当的料液比可以使酶与底物充分反应,从而影响SDF的得率[20],在一定范围内SDF的得率随料液比的增大而升高;当酶和底物已经充分接触,料液比继续增加,得率变化不大。因此,综合考虑提取效率和成本,较为适宜的料液比为1∶25 g/mL。
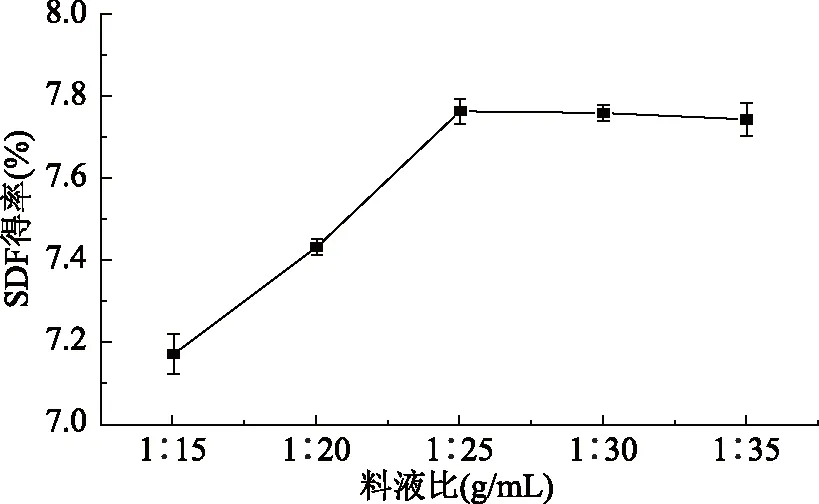
图1 料液比对黄秋葵可溶性膳食纤维得率的影响
2.1.2 加酶量对黄秋葵SDF得率的影响 由图2可知,当复合酶的添加量从0.5%增加至2.0%时,黄秋葵SDF得率不断升高,当添加量为2.0%时,增加至8.88%,表明越来越多的酶同底物结合,充分发生反应。随着加酶量的继续增加,SDF的得率有所下降,SDF得率下降的原因可能是过量的复合酶继续作用于可溶性膳食纤维,导致产物减少[21]。因此加酶量以2.0%为宜。
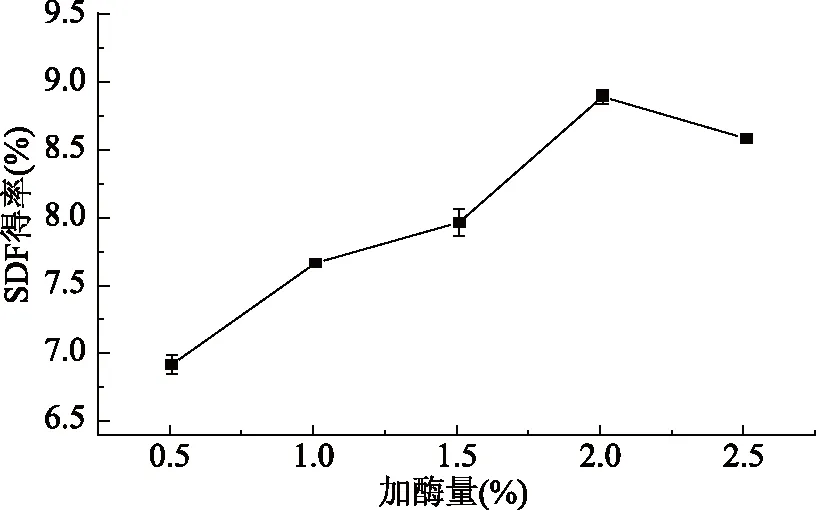
图2 加酶量对黄秋葵可溶性膳食纤维得率的影响
2.1.3 酶解时间对黄秋葵SDF得率的影响 由图3可知,酶解时间在20~60 min时,SDF得率上升,在酶解时间为60 min时,达到最大,为8.22%;酶解时间继续增加,SDF得率呈下降趋势。起初随着酶解时间的增加,酶和底物充分反应,但当酶解时间过长时,酶的活性受外界因素影响而下降,影响提取的效率;另一方面酶水解了可溶性膳食纤维,造成产量的下降[21]。因此适宜的酶解时间为60 min。
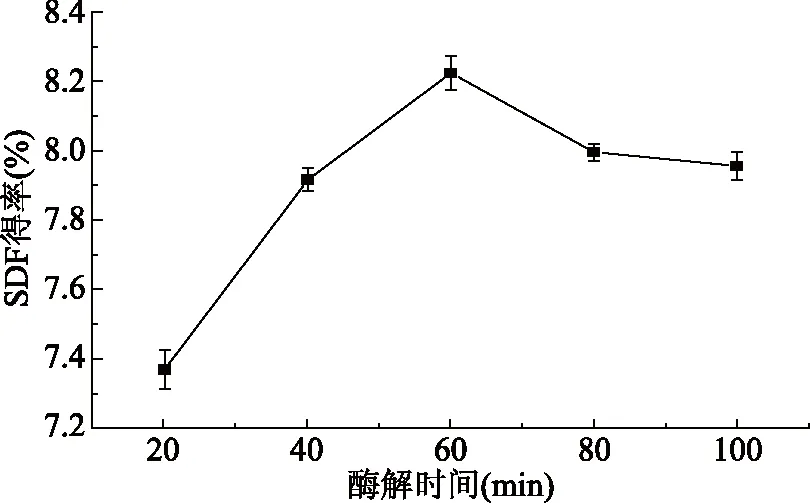
图3 酶解时间对黄秋葵可溶性膳食纤维得率的影响
2.1.4 酶解温度对黄秋葵SDF得率的影响 由图4可知,在40~60 ℃时,SDF得率随酶解温度的升高而增加;在酶解温度为60 ℃时,SDF得率达到峰值,为8.88%。温度会直接影响酶分子的活性,适宜的温度可以使酶的活性最大程度地发挥;当温度过高时,酶的活性大大损失,导致提取效率降低[22]。因此,较为适宜的酶解温度为60 ℃。
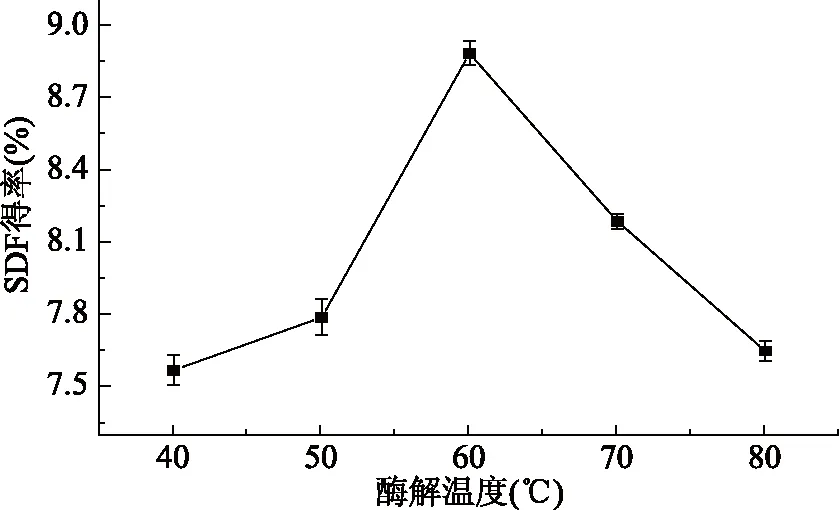
图4 酶解温度对黄秋葵可溶性膳食纤维得率的影响
2.2 酶解法提取黄秋葵SDF的响应面优化试验
2.2.1 回归模型的构建及方差分析 酶解法提取黄秋葵SDF的响应面试验设计方案见表1,按照方案中的工艺条件提取黄秋葵SDF,得到的试验结果如表2所示。使用Design Expert 10.0对试验数据进行拟合,得到二次多项式回归方程为:
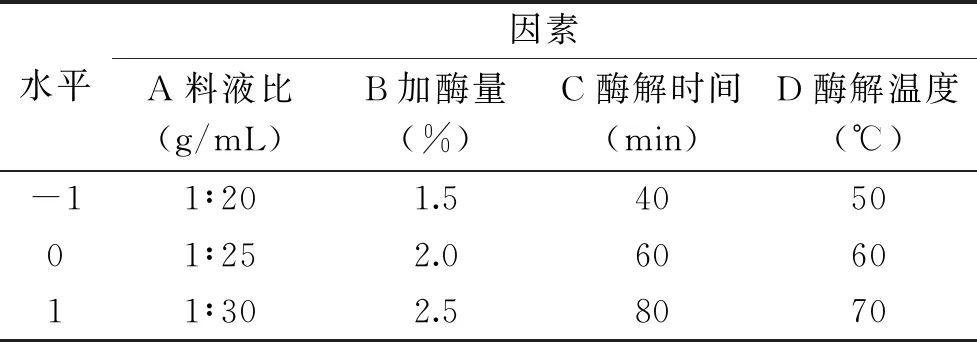
表1 响应面试验因素水平
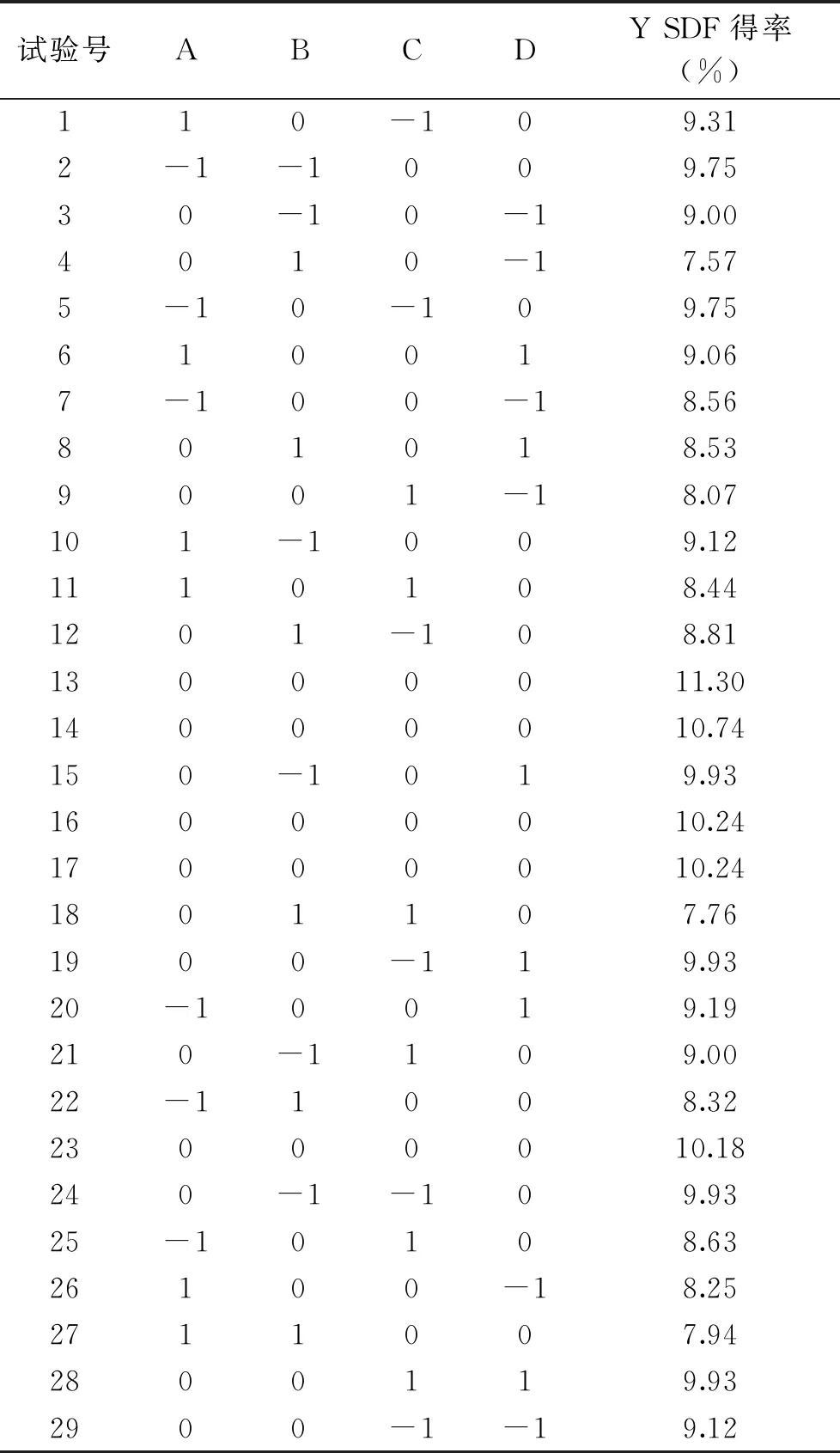
表2 响应面试验设计方案与结果
Y=10.54 - 0.17A-0.65B-0.42C+0.50D+0.062AB+0.062AC+0.045AD-0.030BC+0.0075BD+0.26CD-0.89A2-0.98B2-0.60C2- 0.79D2
通过分析变量的P值来反应其对响应值的影响程度,P值越小,说明该变量对响应值的影响越显著。由表3可知,加酶量(B)、酶解时间(C)和酶解温度(D)对黄秋葵SDF得率的影响均极显著(P<0.01),料液比(A)对黄秋葵SDF得率的影响不显著(P>0.05)。通过对比表3中的F值可以看出,混合酶添加量对黄秋葵SDF提取效率的影响最大,酶解温度、酶解时间次之,料液比影响相对较小。此外,二次项A2、B2、C2、D2对黄秋葵SDF得率的影响均极显著(P<0.01),各因素间的两两交互作用对黄秋葵SDF得率的影响均不显著(P>0.05)。
2.2.2 响应面分析 响应面图是描绘了当其它因素水平不变时,两个因素的水平发生变化对响应值所产生的影响情况的图形,如图5所示。
由图5a可知,在料液比为1∶22~1∶26 g/mL,加酶量为1.7%~1.9%时,SDF得率有极大值。当加酶量和酶解温度固定,料液比和酶解时间对得率的影响如图5b所示,随着料液比或酶解时间的增加,黄秋葵中SDF的提取效率均呈现先上升后下降的趋势。在图5e中,随着加酶量或酶解温度的增加,黄秋葵中SDF的得率先上升后下降。由图5f可知,在酶解时间为50~60 min,酶解温度为60~65 ℃时,黄秋葵SDF的得率有极大值。图5中酶解时间(C)和酶解温度(D)交互作用的响应面曲线较陡峭,对响应值影响最大;其它交互作用对应的响应面曲面较平缓,表明对响应值无显著影响,同表3的方差分析结果一致。
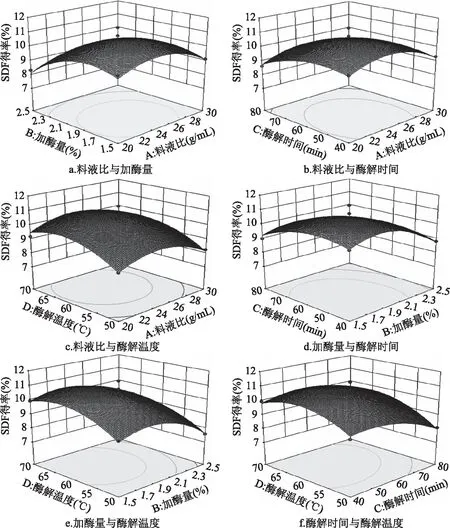
图5 酶解法提取黄秋葵SDF的两因素交互作用响应面图
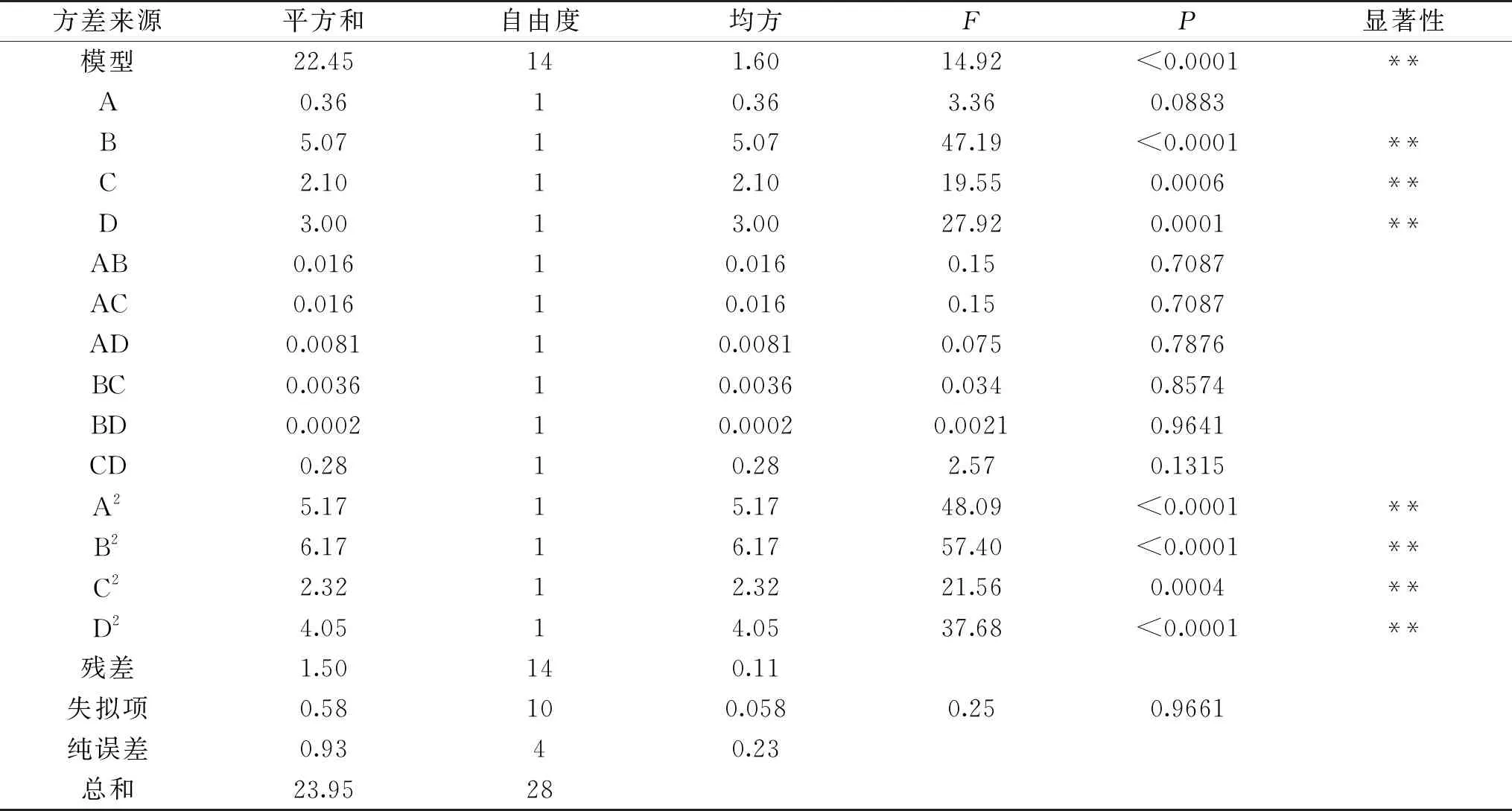
表3 响应面试验回归模型的方差分析
在此模型的基础上,使用软件预测酶解法提取黄秋葵SDF的最佳工艺参数为料液比1∶24.43 g/mL、加酶量1.83%、酶解时间54.21 min、酶解温度62.64 ℃,该条件下得到黄秋葵SDF得率的最大预测值为10.78%。
2.2.3 优化结果与验证 考虑实际情况,将工艺参数调整为:料液比1∶24 g/mL、加酶量1.8%、酶解时间54 min、酶解温度62 ℃。在此条件下进行验证,设置3组平行实验,实际提取得到黄秋葵SDF得率为10.94%±0.14%,相对误差为1.48%,实验值与预测值之间的差异不显著(P>0.05),证明模型预测结果准确,能够可靠地反映提取过程中各因素对黄秋葵SDF得率的影响情况。
2.3 黄秋葵SDF的理化性质
持水力、膨胀力和持油力是膳食纤维的重要理化性质,能够反映膳食纤维的品质。在最优提取工艺下提取得到的黄秋葵SDF的持水力、膨胀力、持油力测定结果如表4所示,并与几种其它来源的SDF进行比较。
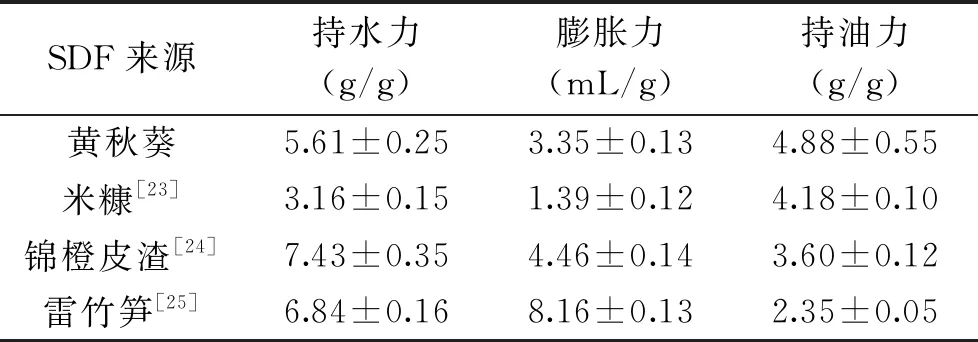
表4 几种不同来源的可溶性膳食纤维的持水力、膨胀力和持油力
由表4可知,黄秋葵SDF的持水力为(5.61±0.25) g/g,高于米糠膳食纤维;黄秋葵SDF膨胀力为(3.35±0.13) mL/g,高于米糠膳食纤维;黄秋葵SDF的持油力为(4.88±0.55) g/g,高于米糠膳食纤维、锦橙皮渣膳食纤维和雷竹笋膳食纤维。表明优化提取后的黄秋葵SDF具有良好的持水力、膨胀力和持油力。黄秋葵SDF的持油力来自于其表面暴露出的亲油基团,膳食纤维对油脂的吸附作用可以对肠道起到保护作用。研究表明[26],黄秋葵SDF的持水力可以增加粪便的含水量,而膨胀性使其在溶于水后体积膨胀,同样具有促进排便的作用。由图6可知,黄秋葵SDF在100×倍数下呈现大小不一、排布紧密的粒状,颗粒形状较为清晰,结构较为完整;原料黄秋葵粉在100×倍数下呈碎块化,为不均匀分布的颗粒、片状物和棒状物,形状不规则、排列松散。未经处理的黄秋葵粉表面含有较多的淀粉和蛋白质,在5000×倍数下可观察到其表面较为光滑;黄秋葵SDF在5000×倍数下可观察到片状结构,符合膳食纤维的一般形态,表面较提取前的黄秋葵粉更为粗糙,说明提取充分除去了淀粉、蛋白质[27]。观察黄秋葵SDF的微观结构,其表面分布有许多小孔,使其具有良好的持水性和吸附特性。因此若对黄秋葵SDF进行进一步的超声或超微粉碎处理,可能会打破其片状结构,使蜂窝状小孔充分暴露,比表面积增加,实现对吸附性等功能特性的改良。
2.4 黄秋葵SDF的扫描电镜结果
图6(a1)、(b1)为放大100倍的黄秋葵SDF和黄秋葵粉的扫描电镜图,图6(a2)、(b2)为放大5000倍的黄秋葵SDF和黄秋葵粉的扫描电镜图。

图6 黄秋葵SDF与黄秋葵粉的扫描电镜图
2.5 傅里叶红外光谱分析
使用傅里叶变换红外(fourier transform infrared,FTIR)光谱仪,对黄秋葵SDF和黄秋葵粉进行扫描分析,得到相应的红外光谱,如图7所示。通过分析黄秋葵SDF的红外光谱中吸收峰的位置与强度,可以反映SDF中存在的某些化学基团和结构。比较黄秋葵粉和黄秋葵SDF的吸收峰位置与形状,可以得到提取前后混合物的组成变化情况。
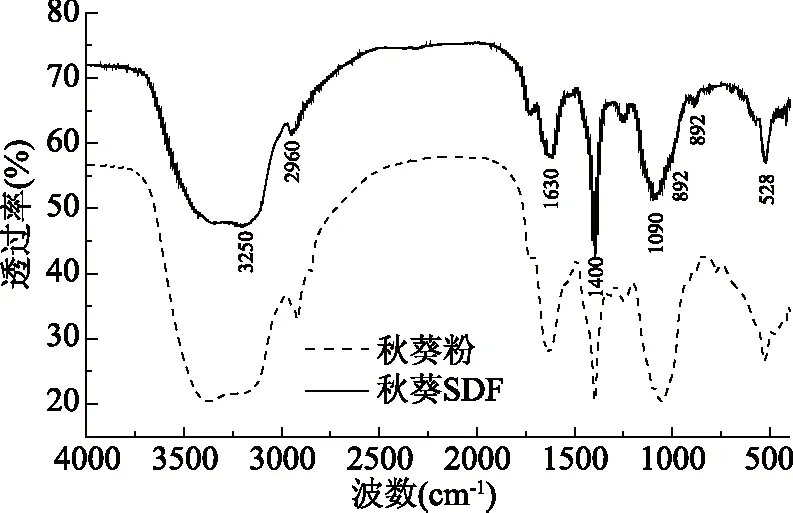
图7 黄秋葵粉与黄秋葵SDF的傅里叶红外光谱图
由图7可知,黄秋葵SDF在3250 cm-1处有宽而强的吸收峰,此吸收峰由O-H伸缩振动引起,表明秋葵SDF中含有较多羟基,形成了缔合状态的氢键。在2960 cm-1处呈现弱峰,此吸收峰由糖类中的-CH3或-CH2-上的C-H伸缩振动引起。在1630 cm-1处的吸收峰由C=O伸缩振动引起,是羧基或醛基的特征峰,说明黄秋葵SDF中含有糖醛酸。在1400 cm-1处的吸收峰由C-H弯曲振动引起。在1090 cm-1处出现强吸收峰,此峰由C-O伸缩振动或O-H变角振动引起,说明黄秋葵SDF中存在糖环C-O-C或C-O-H结构。整体来看,黄秋葵SDF的红外图谱符合多糖类物质的典型特征[28]。
原料黄秋葵粉与黄秋葵SDF光谱的吸收峰位置大致相似,而黄秋葵SDF在892 cm-1处出现了新的吸收峰,该峰是β-吡喃糖的特征吸收峰,由C-H变角振动引起,说明黄秋葵SDF中存在β-吡喃糖。该吸收峰可能是在提取过程中由淀粉水解形成的。
2.6 X射线衍射分析
通过对黄秋葵SDF和黄秋葵粉进行X射线衍射(X-ray diffraction,XRD),分析图谱可以推断材料的晶体结构。通过比较黄秋葵粉和黄秋葵SDF的XRD图谱,可以探究提取过程对SDF晶体的结构、序列和尺寸的影响。
分析黄秋葵SDF的XRD图谱,如图8A所示,可以看出:黄秋葵SDF在扫描角度2θ为22°处出现明显的结晶衍射峰,在31°处有较弱的结晶衍射峰,符合纤维素Ⅰ晶型的特征,说明黄秋葵SDF为结晶区和无定形区共同存在的状态[29]。比较黄秋葵SDF与黄秋葵粉的XRD图谱,发现在提取前后的图线形状及出峰位置没有明显改变,混合物的晶体结构变化不大,说明提取过程对SDF的结晶区没有造成明显的破坏。比较纵坐标可以得知,黄秋葵SDF与提取前相比,峰强度下降,而且22°附近的主衍射峰变宽,这可能是由于SDF中部分晶体的序列和尺寸发生了改变。研究表明[30],膳食纤维的结晶区暴露,表现为衍射峰强度的减小,可以使膳食纤维的持水性、溶胀性等特性增强,进而使膳食纤维的一些生理功能得到改善。
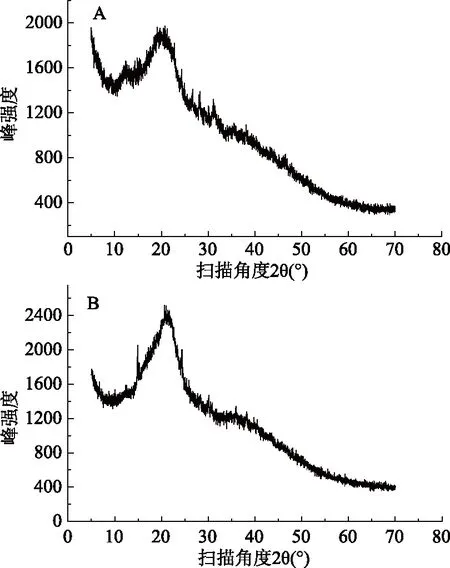
图8 黄秋葵粉与黄秋葵SDF的X射线衍射图谱
3 结论
复合酶法提取黄秋葵SDF的最优条件为:料液比1∶24 g/mL、加酶量1.8%、酶解时间54 min、酶解温度62 ℃,该条件下得到黄秋葵SDF的得率为10.94%。黄秋葵SDF的持水力为(5.61±0.25) g/g,膨胀力为(3.35±0.13) mL/g,持油力为(4.88±0.55) g/g,同其它来源膳食纤维的对比表明,黄秋葵SDF具有良好的理化特性,具有成为相关保健食品原料的潜力。黄秋葵SDF的微观结构呈现膳食纤维类物质常见的片状结构,其表面粗糙且分布有许多小孔;黄秋葵SDF的红外光谱符合膳食纤维类物质的典型特征,含有较多缔合状态的氢键,并且存在糖醛酸和β-吡喃糖;黄秋葵SDF的XRD图谱符合纤维素Ⅰ晶型的特征,在提取前后黄秋葵SDF的晶体序列和尺寸发生了改变。

